远缘杂交结合胚培养法获得厚皮甜瓜阿鲁斯达令双单倍体
来源:优秀文章 发布时间:2022-10-21 点击:
孙博文 黄耀 孙亚亭 刘麒 郑莉娜 孙沛 钱春桃






摘要:
旨在系统地研究通过远缘杂交结合胚培养获得甜瓜双单倍体的方法,以拓宽甜瓜双单倍体获得路径。以西印度瓜( Cucumis anguria L.)为远缘花粉供体,对厚皮甜瓜阿鲁斯达令进行授粉,并结合胚培养方法进行研究,以期获得厚皮甜瓜阿鲁斯达令的双单倍体。结果表明,对阿鲁斯达令甜瓜进行远缘授粉后如果不作处理,子房会全部败育,而对子房表面涂抹坐果灵后坐果率可达73.33%;授粉28 d后,共采收22个远缘杂交果实,累计获得359粒种子;胚培养后获得4株再生植株,再生植株占比为1.11%;通过流式细胞仪鉴定得出,再生植株有二倍体、混倍体2种类型。对比二倍体再生植株和母本阿鲁斯达令发现,二倍体再生苗的叶、花较小,植株长势较弱,果实较圆,平均花粉活力较低。对二倍体再生植株R3、母本阿鲁斯达令自交1代(S1 代)群體形态学性状进行遗传变异系数比较发现,R3 S1 代群体各项指标的遗传变异系数均远低于母本阿鲁斯达令S1 代群体。利用筛选出的2对在阿鲁斯达令基因组中具有多态性的简单重复序列(SSR)引物CMATN240、CMCTN71对R3 S1 代群体进行基因型分析,结果表明,20株R3 S1 代群体均为纯合带型。通过形态学鉴定、SSR分子标记鉴定分析发现,获得的再生植株R3为双单倍体。由研究结果可知,通过远缘杂交结合胚培养获得了甜瓜再生植株,通过细胞流式仪倍性鉴定、SSR标记分析与S1 代群体性状遗传变异系数鉴定得出,再生植株为双单倍体。
关键词:
厚皮甜瓜; 远缘杂交; 胚培养; 双单倍体
中图分类号:
S652.036 文献标识码:
A 文章编号:
1000-4440(2022)03-0775-07
Production of doubled haploid in muskmelon Earl’s Darling by interspecific hybridization and embryo culture
SUN Bo-wen 1 , HUANG Yao 1,2 , SUN Ya-ting 1 , LIU Qi 1,2 , ZHENG Li-na 1 , SUN Pei 1 , QIAN Chun-tao 1
(1.College of Horticulture, Nanjing Agricultural University/State Key Laboratory of Crop Genetics and Germplasm Innovation, Nanjing 210095, China; 2.New Rural Development Research Institute of Nanjing Agricultural University, Suzhou 215500, China)
Abstract:
This article systematically studied the method of obtaining doubled haploid of melon through interspecific hybridization and embryo culture to broaden the way of obtaining doubled haploids. In this study, Cucumis anguria L. was used as a distant pollen donor to pollinate the thick-skinned muskmelon Earl’s Darling, and embryo culture method was combined to obtain doubled haploids. The results showed that all ovaries were aborted after distant pollination, and the fruit setting rate could reach 73.33% after applying 4-chlorophenoxyacetic acid. After 28 days of pollination, 22 distant hybrid fruits were harvested, and 359 seeds were obtained. Four regenerated plants were obtained after embryo culture, and the proportion of regenerated plants was 1.11%. Flow cytometry identified two types of regenerated plants, diploid and mixoploid. Compared with the female parent, the leaves and flowers of diploid regenerated seedlings were smaller, plant growth was weaker, fruits were rounder, and average pollen vigor was lower. The genetic variation coefficients of the S1 generation of the diploid regenerated plant R3 and the female parent Earl’s Darling were compared, and it was found that the genetic variation coefficients of the indicators of the R3 S1 population were far lower than those of the female parent Earl’s Darling S1 population. Two pairs of polymorphic simple sequence repeat (SSR) primers CMATN240 and CMCTN71 were selected to perform genotype analysis of the R3 S1 population, the results showed that the 20 R3 S1 populations were all homozygous. Morphological identification and SSR molecular marker identification analysis showed that the regenerated plant R3 obtained in this study was a double haploid. The regenerated plants of muskmelon were obtained by distant hybridization and embryo culture. The results of flow cytometry, SSR marker analysis and genetic variation coefficient of S1 population traits show that the regenerated plants are doubled haploids.
Key words:
muskmelon; interspecific hybridization; embryo culture; doubled haploid
甜瓜( Cucumis melo L.)为葫芦科甜瓜属一年生作物,可分为厚皮甜瓜、薄皮甜瓜两大类。厚皮甜瓜果形独特、芳香味浓,具有很高的经济价值,但是其生长发育喜好空气干燥、光照充足、昼夜温差大的大陆性气候条件,因此在20世纪80年代前仅种植于中国新疆、甘肃等西北地区 [1] 。随着“厚皮甜瓜东移”工程的开展,厚皮甜瓜逐渐成为东部沿海地区的重要栽培作物 [2] 。栽培面积的扩大对品种培育提出了更高要求,传统育种方式选育周期长、工作量大,而利用单/双单倍体(Haploid/doubled haploid,H/DH)进行育种,可以缩短育种年限、提高育种效率。
在甜瓜中,培育单倍体/双单倍体的方法包括利用辐射花粉授粉 [3] 、未受精子房离体培养 [4] 、花药培养 [5] 等,其中辐射花粉培养被认为是最成熟实用的方法 [6] 。目前,国外已经有多个优异双单倍体材料用于甜瓜育种 [7-9] ,其中不少源于厚皮甜瓜 [7, 10-11] ,也有学者系统地研究了DH植株的性状特征 [12] ,这些研究结果为将甜瓜双单倍体用于育种研究奠定了基础。国内学者韩丽华 [13] 和高宁宁等 [14] 分别通过离体胚珠、子房培养获得了单倍体,并通过染色体加倍获得了厚皮甜瓜双单倍体。但是,目前国内有关甜瓜双单倍体特征特性的研究仍很少 [12, 15] 。
目前,关于小麦 [16] 、大麦 [17] 、玉米 [18] 、油菜 [19] 等大田作物远缘杂交结合胚培养诱导双单倍体的研究已经有一定进展。De Vaulx [20] 曾利用种间杂交培育出甜瓜单倍体,其后就再未见相关报道。因此,本试验在参考大田作物相关研究的基础上,利用甜瓜近缘野生种西印度瓜( C. anguria L.)对厚皮甜瓜阿鲁斯达令进行远缘授粉,结合胚培养培育厚皮甜瓜双单倍体,并对其特征特性进行研究。本研究通过系统地研究利用远缘杂交技术培育甜瓜双单倍体的途径,可以在理论、实践上为甜瓜育种提供更多有益支持。
1 材料与方法
1.1 试验材料
厚皮甜瓜阿鲁斯达令由上海惠和种业有限公司提供,是由日本引进的网纹甜瓜F1 代品种;野生种西印度瓜由南京农业大学葫芦科作物遗传与种质创新实验室提供。试验材料种植于南京农业大学新农村发展研究院有限公司温室大棚。2020年3月中旬播种育苗,4月初定植,进行常规栽培管理。
1.2 试验方法
1.2.1 远缘杂交 在开花前1 d的16∶00- 17∶00 ,选取第2 d要开放的阿鲁斯达令雌花(完全花),进行去雄套袋隔离处理,同时选取第2 d要开放的西印度瓜雄花进行套袋隔离。第2 d 8∶00 用3朵西印度瓜雄花对1朵阿鲁斯达令雌花授粉,授粉后套袋。通过预试验发现,远缘授粉后甜瓜很难坐果,于是在授粉后设置涂抹、不涂抹25 mg/L 坐果灵(4-Chlorophenoxyacetic acid, PAPC) [21] 2种处理方式(涂抹位置为雌花果梗处)。14 d后统计坐果率。每个处理设3次重复,每次授粉10朵雌花。授粉后4~ 5 h在柱头喷施10 mg/L N -苯基- N ′-1, 2, 3-噻二唑-5-脲(TDZ),以促进幼胚发育 [22] 。相关公式:
坐果率=坐果数/授粉雌花数×100%。
1.2.2 胚培养及再生植株驯化 授粉后28~ 35 d收取果实。用流水冲洗果实10 min后在超净工作台上用75%乙醇对果皮进行表面消毒。剖开消毒后的果实,取出种子,用刀片刮除种子表面的瓜囊组织,将种子接种于装有MS固体培养基的组培瓶(容量为350 ml)中(接种量为1瓶20~ 30粒种子),再将组培瓶转入培养室中培养。在MS基本培养基中添加3%蔗糖、8%琼脂,调节溶液pH值为5.8~ 6.0 [23] 。培养条件:温度(25± 1) ℃、光照度2 000 lx、光/暗周期16 h/8 h。
待再生植株长出3~ 5张真叶,并且根系长到3~ 5 cm长时进行幼苗驯化。在3 d内逐渐打开瓶盖,完成再生植株的瓶内驯化后取出再生植株,洗净根系附着的培养基,用2%多菌灵溶液浸泡根30 s [24] ,随后将再生植株移入含已灭菌基质的营养钵中,浇透水,待幼苗有新叶长出时移栽到大棚内。
1.2.3 倍性的鉴定 参考汪艳等 [25] 的方法,选取再生植株幼嫩叶片作为测定材料,委托金迪未来生物科技(北京)有限公司采用流式细胞仪鉴定再生植株的倍性。
1.2.4 二倍体再生植株的形态学观察 选取倍性鉴定为二倍体的再生植株,对二倍体再生植株、母本阿鲁斯达令的叶、花、果实等形态特征进行对比观察。
1.2.5 二倍体再生植株花粉活力的测定 分别取二倍体再生植株、母本阿鲁斯达令的雄花花粉于载玻片上,加1~2滴1%醋酸洋红溶液,摇匀后盖上盖玻片,置于顯微镜下检测,深红色的花粉表示有活力,无色或淡红色的花粉表示没有活力。每片随机选择3个视野,按照下式统计花粉生活力 [26] :
花粉生活力=活花粉粒数/总花粉粒数×100%。
1.2.6 二倍体再生植株自交后代整齐性鉴定 变异系数( CV )可以表示群体内某一性状的离散程度,变异系数越小,表示性状的一致性越高 [27] 。因此,可以利用二倍体再生植株自交后代的整齐性进一步判断其纯合性。分别选取20株二倍体再生植株R3自交后代和阿鲁斯达令自交后代,测量节间距、茎粗、最大叶长和叶宽,按下式计算 CV :
CV=S/x- ×100
式中:
S 为标准差; x- 为某性状的均值。
1.2.7 二倍体再生植株自交后代简单重复序列(SSR)标记的鉴定 利用SSR标记的共显性特点鉴定二倍体再生植株的纯合性。从葫芦科作物基因组数据库的30对標记中筛选出2对在母本扩增产物中显示杂合条带的引物(表1)。用十六烷基三甲基溴化铵(CTAB)法提取亲本材料阿鲁斯达令和20株R3 S1 代植株叶片的DNA,SSR引物由南京金斯瑞生物科技有限公司合成。20 μl扩增反应体系:1 μl模板DNA,10.0 μl 2× Taq master mix,各1 μl上、下游引物,7 μl ddH2 O。扩增反应在PCR仪中进行,PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,28个循环;72 ℃延伸8 min,4 ℃保存。产物用1%聚丙烯酰胺凝胶电泳检测。
2 结果与分析
2.1 坐果灵对远缘杂交坐果率的影响
以西印度瓜为父本,对阿鲁斯达令进行授粉后,对子房表面进行涂抹、不涂抹坐果灵溶液2种处理。如表2所示,2种处理方式的甜瓜坐果率差异显著,不涂抹坐果灵的甜瓜子房败育,3 d内子房发黄,坐果率为0;涂抹坐果灵处理显著提高了甜瓜的坐果率,坐果率可达73.33%。由此可见,通过对甜瓜进行远缘授粉后,涂抹坐果灵处理可以提高坐果率,提高了幼胚发育的概率。
2.2 胚培养和倍性鉴定
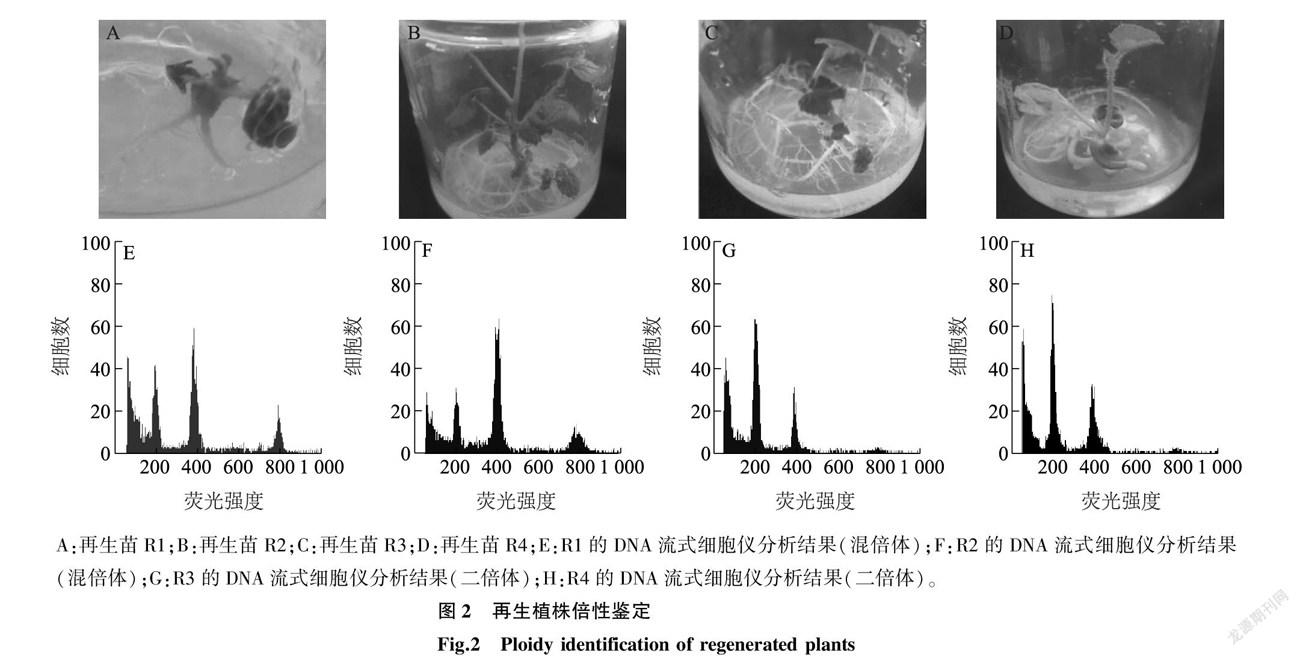
授粉28 d后,采收22个甜瓜果实,累计获得359粒种子。将收获的种子接种在MS固体培养基上培养10 d后观察可知,种子均萌发出肉眼可见的绿色胚(图1A);继续培养7 d后,幼胚突出种皮,萌发出芽(图1B),共有4个胚萌发,将其转移到1/2 MS培养基中单独培养后,这些胚均长出了根,最后均发育成完整植株,分别命名为R1、R2、R3、R4,统计可知,再生植株占比为1.11%。
如图2所示,用DNA流式细胞仪对获得的4株再生植株进行倍性鉴定,测定结果显示,再生植株同时存在二倍体和混倍体,其中R3、R4为二倍体,R1、R2为混倍体。
2.3 二倍体再生植株R3、R4形态特征和花粉活力
观察发现,二倍体再生植株R3、R4和母本阿鲁斯达令在形态上有明显区别。由图3可以看出,与母本阿鲁斯达令相比,二倍体再生植株R3、R4的叶片、花瓣较小,果实较圆,且R3、R4植株长势较弱;二倍体再生植株R3和R4之间在叶色、叶形、花形等方面有差异,可能因为它们是由不同配子发育而来的。由表3可以看出,二倍体再生植株R3、R4的雄花单位面积花粉数、花粉平均生活力均远低于母本阿鲁斯达令的相应指标。
2.4 R3自交S1 代整齐性鉴定
将再生植株R3、R4进行自交留种,各自自交授粉3朵雌花,每3朵雄花授粉1朵雌花。授粉45 d后,R3采收1个果实,累计获得20粒饱满的种子;R4植株仅有1朵雌花,自交后未坐果。本试验对杂交种阿鲁斯达令S1 代、再生植株R3 S1 代群体的节间距、茎粗、最大叶长和最大叶宽这4个数量性状进行变异系数分析。由表4可以看出,R3 S1 代群体的节间距、茎粗、最大叶长和最大叶宽的变异系数远小于阿鲁斯达令S1 代群体。变异系数代表性状观测数值的变异程度,较小的变异系数意味着群体存在较小的变异,整齐度高,基因型的纯合度高。
2.5 R3自交S1 代的SSR标记分析
从30对引物中筛选到在母本阿鲁斯达令、R3 S1 代群体间具有多态性的引物CMATN240、CMCTN71。利用2个SSR标记对母本阿鲁斯达令、R3 S1 代群体进行带型分析。如图4所示,原始母本阿鲁斯达令均为双带型(杂合带型),而20株R3 S1 代群体均为单带型(纯合带型)。由此可见,R3为双单倍体。进一步计算可知,在本研究中,双单倍体诱导率为0.28%[双单倍体数(1株)/接种种子数(359粒)× 100%= 0.28%]。
3 讨 论
本研究建立的通过远缘杂交结合胚培养获得厚皮甜瓜的双单倍体技术,拓宽了甜瓜双单倍体的培育途径,对于创制甜瓜育种材料和提高育种效率具有重要意义。目前的国内外报道显示,辐射花粉授粉是诱导甜瓜单/双单倍体最有效的途径。在本试验中,远缘杂交再生植株率为0.28%,与张永兵等 [28] 得出的辐射花粉授粉诱导率(0.29%)相似,低于薛皓等 [29] 报道的1.09%。然而,本研究可以直接形成双单倍体,不需要单倍体染色体加倍环节,减少了操作环节,降低了技术难度。
在本研究中,R4植株仅出现1朵雌花,且未能坐果。DH株系育性变异的现象在双单倍体群体中并不罕见。陈英等 [30] 认为,籼粳杂交F1代的DH植株后代部分存在胚囊或者花粉败育的现象;有研究者通过对水稻DH群体的研究发现植株出现雄性不育和花器官发育正常的现象,而对雌花授予正常的花粉后,雌花可以结实 [31] ;谢冰等 [32] 认为,DH株系发生育性不良的现象可能由于胚状体发育过程中出现了变异,进而导致育性降低。今后可通过激素调节改善植株的育性 [33] ,以进一步促进DH植株的应用。研究者通过对葫芦科作物单倍体的研究,获得了二倍体和混倍体,如Przyborowski等 [34] 在用黄瓜辐射花粉授粉诱导过程中获得了二倍体和混倍体,该作者认为,这一现象与胚拯救过程中胚的染色体自发加倍有关。Kurtar等 [35] 发现,南瓜单倍体比较容易在子叶型胚形成以前获得,子叶型胚大多是染色体已加倍的二倍体或混倍体。本试验只获得二倍体和混倍体的再生植株,推测可能与培养的时期较靠后有关。本研究中的接种过程在授粉后28 d,此时绝大多数幼胚发生败育,形成空壳种子,而没有败育的胚已发育为成熟的子叶型胚,即本研究中的绿胚。因此,在今后研究中,为了提高出胚成苗率并避免混倍体出现,胚培养的时间可以适当提前。
在禾本科植物中,通常采用外源激素促进幼胚发育。TDZ是一种人工合成的植物生长调节剂,具有生长素、细胞分裂素的双重作用,可以调节植物内源激素来诱导幼胚发育 [36] 。在田间远缘授粉后,笔者对甜瓜的子房柱头涂抹TDZ,随后用胚拯救技術,最后成功获得4个胚,表明外源TDZ在甜瓜上也能促进幼胚发育。
当栽培环境相同时,遗传变异系数是衡量群体遗传稳定性的重要指标,变异系数小的群体的遗传基础较单纯。冯建云 [37] 对羽衣甘蓝杂交F1 代群体及用其小孢子通过离体培养获得的DH群体进行了数量性状变异系数比较,发现DH群体各项指标的变异系数均远小于F1 代群体,且整齐度高。本研究是在同一地块进行的,肥力和环境相同,环境因素差异带来的影响可以忽略不计。本研究获得的R3 S1 代群体典型数量性状的变异系数远低于杂交种阿鲁斯达令S1 代群体,整齐度高,可能为DH系。同时,本试验利用筛选出的2对SSR引物对R3 S1 代群体进行纯合分析,发现20株R3的自交后代在这2个位点(由CMATN240、CMCTN7引物扩增出)都是纯合的,证明获得的二倍体再生植株R3是双单倍体。
参考文献:
[1] 孙国胜,孙春青,潘跃平,等. 中国南方厚皮甜瓜栽培研究进展及育种展望[J]. 中国瓜菜, 2014, 27(S1):
17-20.
[2] 顾闽峰,郭 军,吴永成,等. 江苏沿海地区厚皮甜瓜育种研究现状及思考[J]. 江苏农业科学, 2009(6):
205-207.
[3] NASERTORABI M, MADADKHAH E, MOGHBELI H, et al. Enhanced production of doubled haploid lines from parthenogenetic Iranian melon plants obtained of irradiated pollen ( Cucumis melo L.)[J]. International Research Journal of Applied and Basic Sciences, 2012, 3(8):
1595-1600.
[4] FICCADENTI N, SESTILI S, ANNIBALI S, et al. In vitro gynogenesis to induce haploid plants in melon ( Cucumis melo L.)[J]. Journal of Genetics and Breeding, 1999, 53(3):
255-257.
[5] 陶正南. 甜瓜花药培养诱导成植株[J]. 植物生理学通讯, 1987(5):
43.
[6] GALAZKA J, NIEMIROWICZ-SZCZYTT K. Review of research on haploid production in cucumber and other cucurbits[J]. Folia Horticulturae, 2013, 25(1):
67-78.
[7] LOTFI M, ALAN A R, HENNING M J, et al. Production of haploid and doubled haploid plants of melon ( Cucumis melo L.) for use in breeding for multiple virus resistance[J]. Plant Cell Reports, 2003, 21(11):
1121-1128.
[8] KUZUYA M, HOSOYA K, YASHIRO K, et al. Powdery mildew ( Sphaerotheca fuliginea ) resistance in melon is selectable at the haploid level[J]. Journal of Experimental Botany, 2003, 54(384):
1069-1074.
[9] SARI N, SOLMAZ I, YETISIR H, et al. New Fusarium wilt resistant melon ( Cucumis melo var. cantalupensis ) varieties developed by dihaploidization[J]. Acta Horticulturae, 2010, 871(871):
267-272.
[10] SAUTON A, VAULX R D. Obtention de plantes haplodes chez le melon ( Cucumis melo L.) par gynogenèse induite par du pollen irradi[J]. Agronomie, 1987, 7(2):
141-148.
[11] FICCADENTI N, VERONESE P, SESTILI S, et al. Influence of genotype on the induction of haploidy in ( Cucumis melo L.) by using irradiated pollen[J]. Journal of Genetics and Breeding, 1995, 49(4):
359-364.
[12] SARI N. Characterization of some agronomic traits and β -carotene contents of orange fleshed altinbas melon dihaploid lines[J]. Ekin Journal of Crop Breeding and Genetics, 2017, 3(1):
12-18.
[13] 韩丽华. 厚皮甜瓜未受精胚珠离体培养技术[D]. 保定:
河北农业大学, 2004.
[14] 高宁宁,李晓慧,康利允,等. 厚皮甜瓜未受精子房离体培养获得胚囊再生植株[J]. 果树学报, 2020, 37(7):
1036-1045.
[15] 贾媛媛,张永兵,刁卫平,等. 双单倍体甜瓜的获得及其初步定性研究[J]. 江苏农业科学, 2008(1):
116-118.
[16] 孙敬三,刘 辉,路铁刚,等. 利用小麦×玉米获得小麦单倍体[J]. 植物学报, 1992(11):
817-821,893.
[17] 牟春红,王 彬,谢兆辉,等. 植物孤雌生殖的诱导及其在育种中的应用[J]. 中国农业科学, 2002(11):
1319-1324.
[18] 张瑞泉,马德海. 利用远缘花粉诱导玉米孤雌生殖培育自交系(初报)[J]. 北京农业科技, 1980(6):
15-18,45.
[19] 罗 鹏. 油菜的孤雌生殖及其实际应用[J]. 中国农业科学, 1981(4):
37-40.
[20] DE VAULX R D. Obtention de plantes haploides chez le melon ( Cucumis melo L.) apres pollinisation par Cucumis ficifolius A. Rich[J]. CRA cad Sci Paris, 1979, 289:
875-878.
[21] 田守波,朱为民,王 虹,等. 坐果灵对不同类型番茄坐果、品质及产量的影响[J]. 上海农业学报, 2020, 36(1):
59-63.
[22] 陈肖英,叶庆生,刘 伟. TDZ研究进展(综述)[J]. 亚热带植物科学, 2003(3):
59-63,58.
[23] 苏 芃,HIEN N H,管 苇,等. 辐射花粉授粉技术诱导黄瓜单倍体[J]. 江苏农业学报, 2015, 31(1):
134-137.
[24] 唐桃霞. 西葫芦未授粉子房培养及胚囊植株倍性鉴定技术研究[D]. 杨凌:
西北农林科技大学, 2015.
[25] 汪 艳,肖 媛,刘 伟,等. 流式细胞仪检测高等植物细胞核DNA含量的方法[J]. 植物科学学报, 2015, 33(1):
126-131.
[26] 刘绚霞. 醋酸洋红染色法测定油菜花粉的生活力[J]. 陕西农业科学, 1998(1):
26-27.
[27] 姚淑均. 滇楸优树及其子代苗期性状遗传变异研究[D]. 北京:
中国林业科学研究院, 2013.
[28] 张永兵,陈劲枫,伊鸿平,等. 辐射花粉授粉诱导甜瓜单倍体[J]. 果树学报, 2006(6):
892-895.
[29] 薛 皓,王建设,徐世才,等. 甜瓜辐射花粉诱导单倍体的影响因素研究[J]. 长江蔬菜, 2008(20):
7-10.
[30] 陈 英,何 平,陆朝福,等. 籼粳交加倍单倍体后代性状遗传的研究[J]. 作物学报, 1999, 25(4):
451-457.
[31] RONGBAI L, PANDEY M P, PANDEY S K, et al. Agro-morphological characterization of ovary culture-derived plants of rice ( Oryza sativa L.)[J]. Euphytica, 1999, 106(3):
197-203.
[32] 谢 冰,王晓云,王秀峰,等. 西葫芦胚囊植株及其自交后代主要农艺性状的初步观察[J]. 西北农业学报, 2009, 18(4):
339-343.
[33] 马二磊,黄芸萍,丁伟红,等. 硝酸银和赤霉素對甜瓜的诱雄效果[J]. 江苏农业科学, 2018, 46(17):
161-162.
[34] PRZYBOROWSKI J, NIEMIROWICZ-SZCZYTT K. Main factors affecting cucumber ( Cucumis sativus L.) haploid embryo development and haploid plant characteristics[J]. Plant Breeding, 1994, 112(1):
70-73.
[35] KURTAR E S, SARI N, ABAK K. Obtention of haploid embryos and plants through irradiated pollen technique in squash ( Cucurbita pepo L.)[J]. Euphytica, 2002, 127(3):
335-344.
[36] 徐晓峰,黄学林. TDZ:
一种有效的植物生长调节剂[J]. 植物学通报, 2003(2):
227-237.
[37] 冯建云. 羽衣甘蓝游离小孢子培养体系的优化与利用[D]. 沈阳:
沈阳农业大学, 2008.
(责任编辑:徐 艳)
收稿日期:2021-08-30
基金项目:江苏省农业重大新品种创新项目(PZCZ201718)
作者简介:孙博文(1997-),男,河南许昌人,硕士,研究方向为蔬菜遗传育种与生物技术。(E-mail)2372765736@qq.com。黄耀为共同第一作者。
通讯作者:钱春桃,(E-mail)chuntaoq@njau.edu.cn
推荐访问:单倍体 远缘 甜瓜