欧李原花青素对马铃薯淀粉消化的影响
来源:优秀文章 发布时间:2023-03-26 点击:
李奎,魏代巍,李姝琪,张惠玲*
1(宁夏食品微生物应用技术与安全控制重点实验室,宁夏 银川,750021)2(宁夏大学 食品与葡萄酒学院,宁夏 银川,750021)
马铃薯在中国的种植面积及产量是全世界之首,历年来是我国最重要的粮食作物之一[1]。在欧美国家和地区,马铃薯一直是主食,例如最常见的炸薯条就是最典型的主食,在我国,主要以小麦大米杂粮作为主食,马铃薯仍然作为蔬菜来食用[2-3]。于是农业部在2015年提出马铃薯主粮化的战略性政策,其实现手段是把马铃薯加工成馒头、面条、米粉等传统主食[4]。而马铃薯淀粉中的快消化淀粉(rapidly digested starch,RDS)含量较高,将马铃薯作为原料制备则会进一步增加馒头升糖指数(glycemic index, GI值)[5-6]不利于糖尿病人群的食用,正常人群长期食用也可能会因为高GI值诱发糖尿病,所以如何开发低GI马铃薯主食产品问题亟待解决。
近年来,越来越多的科研工作者将目光聚焦到原花青素辅助治疗糖尿病方面的研究。原花青素不仅能够抑制人体内糖基化晚期终产物的形成[7],还能有效抑制碳水化合物消化过程中起关键作用的水解酶的活性,如α-淀粉酶、α-葡萄糖苷酶,能够减缓食物的水解进程,避免餐后体内血糖急剧升高,从而实现糖尿病预防和辅助治疗的作用。有研究表明称,不同来源的原花青素对淀粉的消化影响不同[8]。郭雅靖等[9]研究了葡萄籽、高粱麸皮、蔓越莓和苹果中的原花青素对α-淀粉酶活性的影响,结果表明,这4种物质中的原花青素对α-淀粉酶活力都有着抑制作用,其中葡萄籽和高粱麸皮中的原花青素对α-淀粉酶活力的抑制作用更明显。MATSUI等[10]研究发现,松树皮中的多酚物质主要是原花青素,其原花青素对α-葡萄糖苷酶活性是有抑制作用的。前期研究表明,龙眼皮原花青素能显著抑制α-淀粉酶活性,其抑制类型为非竞争型可逆抑制[11]。刘承毅等[12]研究了油茶果壳原花青素对α-淀粉酶活性抑制作用,研究表明纯化后原花青素对α-淀粉酶活性的抑制率可达到95.36%,抑制类型是可逆竞争性抑制。ZHANG等[13]研究发现原花青素A1-丙酮缩合物对α-葡萄糖苷酶有较强的抑制活性。最近研究表明葡萄籽原花青素能与马铃薯淀粉形成复合物,抑制马铃薯淀粉的消化[14]。
目前对于淀粉消化性的研究主要集中于纯淀粉,而在真实食品体系中,淀粉的结构往往随加工条件发生改变,淀粉与食品中其他物质的相互作用及其对食品基质的影响十分复杂。本文将马铃薯淀粉与欧李原花青素制备成复合体,通过分析其结构、理化和消化特性探究欧李原花青素抑制马铃薯淀粉消化的机理,为原花色素类物质调控马铃薯淀粉的消化提供一些新思路,能够针对性开发适合特殊人群的膳食。
1.1 材料与试剂
马铃薯,青薯9号,来自宁夏固原;
欧李,农大4号,来自宁夏中卫;
无水乙醇、甲醇、盐酸,麦克林公司;
醋酸钠,天津市瑞金特化学品有限公司;
石油醚、磷酸盐缓冲液,天津市化学试剂一厂;
3,5-二硝基水杨酸,国药集团化学试剂有限公司;
溴化钾,北京奥博星生物技术有限责任公司;
猪胰α-淀粉酶、淀粉葡萄糖苷酶、D-葡萄糖试剂盒,上海麦克林生物科技有限公司。
1.2 仪器与设备
冷冻干燥机DF-Ⅱ、数显集热式磁力搅拌器DF-Ⅱ,常州爱华仪器制造有限公司;
Nicolet 5700傅里叶变换红外光谱,美国热电尼高力公司;
D8-ADVANCE X-射线衍射仪,德国BRUKER公司;
EVO18扫描电子显微镜,北京欧波同光学技术有限公司;
V-5100紫外可见分光光度计,上海精科实业有限公司;
PHS-2C高速冷冻离心机,杭州奥利龙仪器有限公司;
HHS-21-6电热恒温水浴锅,上海博讯实业有限公司;
GL-88B旋涡混合器,上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 马铃薯淀粉制备
选用新鲜的马铃薯(青薯9号),清洗去泥去皮,切成小块,放入研钵中捣碎,加水,再用纱布进行过滤,用水冲洗,滤渣重复上述操作。将过滤到盆中的淀粉乳液静置数小时,倒出上清液,加水搅拌,再次静置数小时。用布式漏斗减压抽滤后得到湿淀粉,把湿淀粉用60 ℃烘箱烘干,最终得淀粉制品。
1.3.2 欧李原花青素-马铃薯淀粉混合物制备
准确称取500 mg的马铃薯淀粉于离心管中,分别按淀粉质量的0%、1.0%、2.0%和3.0%称取原花青素0、5、10、15 mg加入到离心管中,再加入9 mL的去离子水,混匀,于恒温水浴锅中糊化,95 ℃下糊化20 min,取出冷却至室温,置4 ℃冰箱内7 d,然后在-20 ℃冰箱中预冻4 h后进行冷冻干燥,干燥后的样品用研钵研磨成细粉,过100目筛,置于干燥容器内备用。
1.3.3 原花青素-马铃薯淀粉复合物扫描电镜(scanning electron microscope,SEM)观察
SEM检测条件:经过离子溅射镀膜仪将样品镀金,厚度为250~500 nm,在EVO18扫描电子显微镜中观察颗粒形态与结构,工作电压:3 kV、放大倍数:100倍。
1.3.4 X-射线衍射(X-ray diffraction, XRD)测定
X-射线衍射的测试条件:Cu靶,管流为40 mA,管压为40 kv,扫描速度为2°/min,步长为2°起始角为4°,终止角为40°,进行连续扫描。
1.3.5 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
红外光谱检测条件:以10 kN持续2 min。对于每个光谱,32次连续扫描和双面在该范围内以4 cm-1的分辨率采集干涉图室温下为4 000~400 cm-1。
1.3.6 欧李原花青素对α-淀粉酶作用的分子模拟
采用AutoDock Vina软件[15-16]对α-淀粉酶与欧李原花青素之间进行分子对接模拟,用Py-Mol软件[17],进行分子对接分析。从蛋白质数据库(protein Data Bank,PDB,http://www.rcsb.org/)中下载α-淀粉酶的晶体结构,PDB编号:1UA3(猪胰-淀粉酶)。利用ChemBioDraw Ultra 14.0绘制出小分子结构,导入ChemBio3D Ultra 14.0转化为三维结构,AutoDock Tools 软件用于将蛋白质和小分子格式转化为PDBQT,在对接之前,通过去除水分子对蛋白质进行预处理。
1.3.7 葡萄糖含量的测定
1.3.7.1 水解马铃薯淀粉
消化液制备:将500 mg马铃薯淀粉加入到8 mL的磷酸盐缓冲剂(pH值5.2)中,在95 ℃的水浴中连续搅拌,糊化20 min,然后取出冷却至37 ℃,再加入5 mL的酶解液。加入混合酶溶液后,准确计时,分别于0、20、120 min取消化液0.2 mL,用1.8 mL的无水乙醇进行灭酶处理。取上清液,在5 000 r/min的转速下,离心10 min。
测定方法:消化液510 nm处的吸光度由D-葡萄糖试剂盒(GOPOD格式K-GLUK,Megazyme International Ireland Ltd,Wicklow,Ireland)测定。
1.3.7.2 水解原花青素-马铃薯淀粉混合物
消化液制备:将不同比例的原花青素-马铃薯淀粉复合样品分别加入到8 mL的磷酸盐缓冲剂(pH值5.2)中,在95 ℃的水浴中连续搅拌且糊化20 min,然后取出冷却至37 ℃,再加入5 mL的酶解液。加入混合酶溶液后,准确计时,分别于0、20、120 min取消化液0.2 mL,用1.8 mL的无水乙醇进行灭酶处理。取上清液,在5 000 r/min的转速下,离心10 min。
测定方法:消化液在510 nm处的吸光度由D-葡萄糖试剂盒(GOPOD格式K-GLUK,Megazyme International Ireland Ltd,Wicklow,Ireland)测定。同上。
1.3.8 淀粉含量的测定
马铃薯淀粉和不同比例的欧李原花青素-马铃薯淀粉复合物水解液分别在510 nm处的吸光度由D-葡萄糖试剂盒(GOPOD格式K-GLUK,Megazyme International Ireland Ltd,Wicklow,Ireland)测定。计算RDS、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)的含量,计算如公式(1)~公式(3)所示:
(1)
(2)
RS=(1-RDS-SDS)×100
(3)
式中:RDS为快消化淀粉含量,%;
SDS为慢消化淀粉含量,%;
RS为抗性淀粉含量,%;
0.9为从淀粉到葡萄糖的转化系数,G0酶解前游离葡萄糖的量,mg;
G20为酶解20 min时产生的葡萄糖的量,mg;
G120为酶解120 min后产生的葡萄糖的量,mg;
TS为样品中总淀粉含量,mg。
1.4 数据分析
所有数据平均测定3次,用M±SD表示,采用SPSS 20.0、AutoDock Vina软件进行数据分析,使用Origin、Py-Mol、Jade6、Excel进行绘图。
2.1 欧李原花青素-马铃薯淀粉复合物SEM分析
天然马铃薯淀粉和欧李原花青素-马铃薯淀粉复合物糊化后的SEM微观结构图如图1所示, 天然马铃薯淀粉在老化7 d后的微观结构呈“石头状”的硬块,表现出规则的多面体形态,结构完整且棱角分明,表面较平整光滑,在添加了欧李原花青素后,表面形态发生了显著的变化,其微观结构变得更加紧实,表面出现许多网状结构,并在一定程度上破坏淀粉凝胶的表面结构及表面完整性,这说明原花青素与马铃薯淀粉共同糊化时可能发生了相互作用[18]。

a-天然马铃薯淀粉;
b-欧李原花青素-马铃薯淀粉复合物图1 添加欧李原花青素对马铃薯淀粉微观结构的影响Fig.1 Effect of adding pomegranate proanthocyanidins on the microstructure of potato starch
2.2 欧李原花青素-马铃薯淀粉复合物的XRD图谱分析
由图2中曲线a可知,天然马铃薯淀粉呈现出典型的B型图案衍射峰,衍射角在5.6°、15°、17°和20°有单衍射峰,在21°和24°有一相连的双衍射峰。但是,当马铃薯淀粉添加了原花青素后,马铃薯淀粉的B-型结构特征峰消失,呈现出与天然马铃薯淀粉完全不同的衍射峰(曲线b~h),呈弥散型衍射特征,表明几乎没有结晶区域,可能是马铃薯淀粉的长距离晶体结构已经被破坏[19-20],会造成淀粉酶与淀粉作用受到阻碍。但是,在曲线e~h中,在大约衍射角度为34°和37.4°处发现2个微小的新峰,考虑到天然马铃薯在这2个位置没有显示峰,说明欧李原花青素与马铃薯淀粉之间的相互作用可能会形成新的晶体结构。
低添加量的原花青素(曲线b)可能主要与支链淀粉侧链相互作用,抑制了部分支链淀粉的重结晶。但当原花青素含量较高时(曲线h),可充分与支链淀粉和直链淀粉进行相互作用,这可能是其峰值强度和峰型变化的原因。原花青素的加入削弱了淀粉的吸收峰,降低了淀粉相对结晶度,意味着淀粉酶与其底物淀粉接触受到影响。
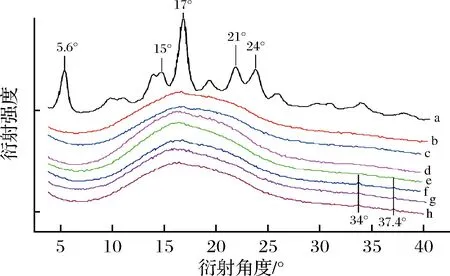
a-天然马铃薯淀粉;
b-马铃薯淀粉+1%原花青素;
c-马铃薯淀粉 +2.0%原花青素;
d-马铃薯淀粉+3.0%原花青素;
e-马铃薯淀粉 +4.0%原花青素;
f-马铃薯淀粉+4.5%原花青素;
g-马铃薯淀粉 +5.0%原花青素;
h-马铃薯淀粉+5.5%原花青素图2 不同添加量马铃薯淀粉-欧李原花青素复合体系XRD图谱Fig.2 XRD spectra of potato starch-oricidin compound system with different supplemental amounts
2.3 欧李原花青素-马铃薯淀粉复合物FT-IR分析
由图3曲线a~h可知,天然马铃薯淀粉和不同比例欧李原花青素-马铃薯淀粉复合物在3 500~3 100 cm-1的红外波段都显示了1个宽带,这可能是由于OH基团的拉伸振动和H键的吸收所致[21]。与天然马铃薯淀粉相比,欧李原花青素-马铃薯淀粉复合物表现出相同的特征峰,这表明马铃薯淀粉与欧李原花青素之间未形成共价键,即淀粉与原花青素是通过非共价相互作用而连接到一起。然而随着原花青素添加量的增加,3 500~3 100 cm-1的红外波段强度增加,表明原花青素可能通过H键增强吸收。这可能是由于原花青素中存在多个羟基,当马铃薯淀粉中加入原花青素后,其原花青素中的羟基和羰基通过氢键与淀粉的羟基结合,形成新的疏水结构区,形成抗酶解结构,进而抑制酶的水解,抑制消化,随着加入的原花青素越多,羟基越多、空间尺寸越大,其相互作用对消化性质的抑制效果越明显[22]。

图3 不同添加量马铃薯淀粉-欧李原花青素复合体系 FT-IR谱图Fig.3 FT-IR spectra of potato starch-oricidin complex system with different supplemental levels a-天然马铃薯淀粉;
b-马铃薯淀粉+1.0%原花青素;
c-马铃薯 淀粉+2.0%原花青素;
d-马铃薯淀粉+3.0%原花青素;
e-马铃薯淀粉+4.0%原花青素;
f-马铃薯淀粉+4.5%原花青素;
g-马铃薯淀粉+5.0%原花青素;
h-马铃薯淀粉+5.5%原花青素
2.4 欧李原花青素对α-淀粉酶作用影响
由图4结合文献[18]可知,欧李原花青素的对接位点位于淀粉酶蛋白结构的疏水空腔内。原花青素与α-淀粉酶相关活性位点发生了共价结合,与Glu233、Asp356、Arg195侧链形成氢键相互作用,与Hid305形成pi-pi堆积,与6个氨基酸有疏水相互作用,使酶结构上的自由氨基减少,使氨基酸的侧链封闭,阻碍与底物的结合。
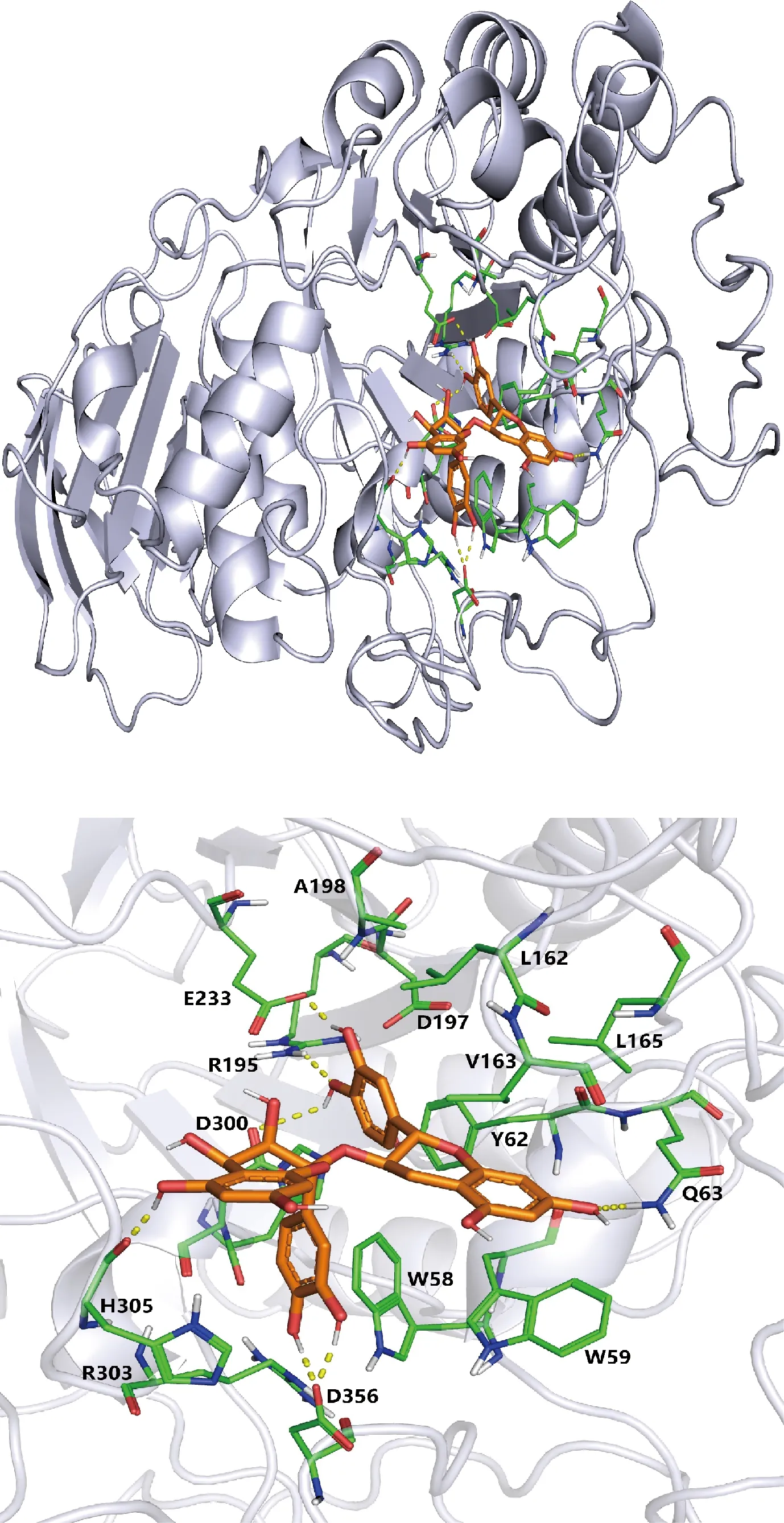
图4 欧李原花青素与α-淀粉酶分子对接图Fig.4 Docking diagram of proanthocyanidins and α-amylase
2.5 欧李原花青素对马铃薯淀粉消化性质的影响
如图5所示,天然马铃薯淀粉中RDS、SDS和RS的构成百分比为81.57%,15.69%和2.71%。通常认为RDS会导致血液中葡萄糖和胰岛素水平的快速升高。因此,马铃薯中RSD含量高可能会引起血糖急剧波动。由图5可以看出,在欧李原花青素-马铃薯淀粉复合体系中,随着欧李原花青素添加量的增加,RDS含量呈下降趋势,SDS和RS含量呈上升趋势,在添加量为1%时,显示RDS含量显著下降,RS含量显著上升,分别为73.24%和13.32%。但是SDS的含量没有受到显著影响,为15.73%。随着原花青素添加量的增加,RDS含量显著降低,从73.24%下降到43.37%,而SDS和RS含量显著升高,SDS从15.73%升高到35.18%,RS从13.32%升高到24.16%。

图5 马铃薯淀粉和欧李原花青素-马铃薯淀粉复合物消化性质Fig.5 Digestive properties of potato starch and oleum proanthocyanidin-potato starch complex
通过SEM观察发现,欧李原花青素-马铃薯淀粉复合物内部形成许多网状结构,其微观结构变得更加紧实,使马铃薯淀粉的结构发生了很大的变化;
通过XRD分析得出,欧李原花青可能改变了马铃薯淀粉的晶型结构。在欧李原花青素-马铃薯复合物中低添加量的原花青素抑制了部分支链淀粉的重结晶,在欧李原花青素-马铃薯复合物中,高添加量的欧李原花青素与马铃薯淀粉之间的相互作用可能会形成新的晶体结构;
通过FT-IR分析得出,在欧李原花青-马铃薯淀粉复合物中欧李原花青素可能通过非共价相互作用特别是氢键与马铃薯淀粉结合,且随着欧李原花青-马铃薯淀粉复合物中欧李原花青素增加其相互作用对消化性质的抑制效果越明显。欧李原花青素与α-淀粉酶相关活性位点发生了共价结合,与Glu233、Asp356、Arg195侧链形成氢键相互作用,与Hid形成pi-pi堆积,与6个氨基酸有疏水相互作用,使酶结构上的自由氨基减少,使氨基酸的侧链封闭,阻碍与底物的结合,抑制了酶活性。通过体外消化实验进行比较,在欧李原花青素-马铃薯淀粉复合体系中,随着欧李原花青素含量的增加,RDS含量显著降低,而SDS和RS含量显著升高。这是因为欧李原花青素会与马铃薯淀粉形成无定形复合物的无规则构型,增加了空间淀粉酶结合位阻,进而减缓而不是阻止马铃薯淀粉的水解。