甲型肝炎病毒SYX1株在人二倍体细胞MRC⁃5上的适应性及遗传稳定性
来源:优秀文章 发布时间:2023-03-26 点击:
李芳芳,廖辉,杨文腰,周荔葆
辽宁成大生物股份有限公司,辽宁 沈阳 110179
甲型肝炎(简称甲肝)是由甲型肝炎病毒(hepa⁃titis A virus,HAV)引起的以肝脏损害为主的肠道传染性疾病。HAV 属小RNA 病毒科,肝炎病毒属,为单链正义 RNA 病毒,基因组长约 7 500 bp[1⁃3]。HAV主要经由粪⁃口途径传播,6 个月以上的人群未接种疫苗且未感染HAV 者普遍易感,潜伏期15 ~ 50 d,平均持续 28~30 d[4⁃5]。甲肝为自限性疾病,治疗以一般及支持治疗为主,辅以适当药物,无慢性化,预后良好,接种甲肝疫苗是预防甲肝的有效手段[6⁃9]。
HAV 在多数组织培养系统中增殖缓慢,复制周期长、一般不引起细胞病变、病毒产量低[10⁃12],给甲肝疫苗的制备带来较大困难,因此,提高病毒产量、缩短病毒增殖周期成为甲肝疫苗生产的关键。本研究采用分离于甲肝患者粪便的HAV SYX1株感染人胚肺二倍体细胞MRC⁃5 株(简称MRC⁃5 细胞),经传代培养,适应为甲肝灭活疫苗毒种,建立三级病毒种子批,并按照《中国药典》三部(2020 版)要求对主种子批、工作种子批毒种进行全项检定[13],探讨HAV SYX1株在MRC⁃5 细胞上的传代适应性及遗传稳定性,评价该毒株用于甲肝灭活疫苗研究和生产的可行性。
1.1 细胞及毒株 MRC⁃5 细胞工作库由辽宁成大生物股份有限公司建立;
HAV SYX1株分离自沈阳市第六人民医院(沈阳市传染病医院)收治甲肝患者的粪便,经多次抽提获得上清液,通过离心和聚乙二醇(polyethylene glycol,PEG)沉淀等处理后分装,置-70 ℃保存。
1.2 主要试剂 L⁃15 培养基购自美国 Invitrogen 公司;
胎牛血清购自美国Hyclone 公司;
RNA 提取试剂盒购自宝生物工程(大连)有限公司;
HAV抗原ELISA检测试剂盒购自浙江省医学科学院;
HAV 特异性抗血清(豚鼠源)由辽宁成大生物股份有限公司制备;
盐酸及乙醚购自国药集团化学试剂有限公司。
1.3 HAV SYX1株在MRC⁃5 细胞上适应性的检测MRC⁃5细胞复苏后,采用含10%胎牛血清的L⁃15培养基于37 ℃培养至长满单层,将HAV SYX1株按MOI=0.05 ~ 1.0接种至MRC⁃5细胞,37 ℃培养至细胞长满单层,降温至35 ℃,培养4 ~5 d,更换含5%胎牛血清的L⁃15 培养液,继续培养至细胞出现老化脱落开始传代。传代时将细胞培养物反复冻融2~3次,3 000 ×g离心10 min,取上清,接种MRC⁃5 细胞,连续传代培养至第28代。随着传代代次的提高,培养时间逐渐缩短,1~8代培养35 d,9~12代培养28 d,13~17代培养21 d,18~28代培养10 d。
1.3.1 抗原含量测定 取1~8代培养35 d、9~12代培养28 d、13~17代培养21 d,18~26代培养10 d的病毒收获液各1 mL,用PBS进行2倍系列稀释(原倍~1∶32),采用 HAV 抗原 ELISA 检测试剂盒检测抗原含量。
1.3.2 病毒滴度测定 同1.3.1 项取各代病毒收获液各 1 mL,用 PBS 进行 10 倍系列稀释(10⁃3~ 10⁃8),加入 24 孔板,200 μL/孔,滴加 5 × 104个/mL 的MRC⁃5 细胞悬液,1 mL/孔,于37 ℃培养至细胞铺满孔底部,更换病毒培养液,降温至35 ℃继续培养,每隔4~5 d 更换1 次培养液,21 d 后收获。采用HAV 抗 原 ELISA 试 剂 盒 检 测 HAV 抗 原 的A450,用Reed⁃Muench法计算HAV滴度。
1.3.3 形态学观察 取第6 代培养35 d 的病毒收获液1 mL,加入等体积特异性HAV 抗血清,37 ℃中和1 h;
用2%磷钨酸负染,电镜下观察病毒形态,并拍照。
1.3.4 理化性质检测 取第6 代培养35 d 的病毒收获液1 mL,分别加入盐酸(调节至pH 3.0)和0.2 mL乙醚,均于4 ℃处理12~18 h;
对处理前后的样品按照1.3.2项方法测定病毒滴度。
1.4 病毒增殖动态评价 取第13~15代培养21 d的病毒收获液,按1.3 项方法分别再次接种至MRC⁃5细胞,并于接种后5、10、15、17、19、21、23、25、28 d 收获,分别按1.3.1 和1.3.2 项方法测定抗原含量及病毒滴度,确定病毒增殖高峰期。
1.5 HAV SYX1株在MRC⁃5细胞上遗传稳定性的检测分别取第 8、12、18、20、22、25、26、28 代病毒收获液(各代病毒培养时间同1.3.1 项),RNA 提取试剂盒提取病毒基因组RNA,委托宝生物工程(大连)有限公司进行RT⁃PCR 扩增及序列测定。根据HAV 基因分型特点,从GenBank中选取国内外共10个代表株:DL3ⅠA型(AF512536.1)、FH2ⅠA型(AB020568.1)、GBMⅠA型(X75215.1)、LU38ⅠA型(AF357222.1)、HM175ⅠB 型(M14707.1)、MBBⅠB 型(M20273.1)、CF53ⅡA型(AY644676.1)、SLF88ⅡB型(AY644670.1)、Kor⁃HAV⁃FⅢA 型(JQ655151.1)、HA⁃JNG06⁃90FⅢB型(AB258387.1),应用NCBI 在线序列分析软件进行序列分析和基因型BLAST 比对,评价HAV SYX1株与其他10 株HAV 基因序列的同源性及不同代次HAV SYX1株的核酸序列变异情况。根据结构⁃非结构蛋白VP1⁃2A连接处168核苷酸序列,应用DNAMAN 9.0软件建立不同型别HAV VP1⁃2A区基因系统进化树,确定HAV SYX1株基因型(同一基因型间核苷酸差异 ≤ 15%,同一基因亚型间核苷酸差异 ≤ 7.5%[14⁃16])。
1.6 HAV SYX1株主种子批及工作种子批的建立
1.6.1 主种子批 取第21 代毒种,接种至MRC⁃5 细胞,于37 ℃培养3 d,至长满单层;
更换含5%胎牛血清的L⁃15培养液,于35 ℃培养7 d;
反复冻融2次,收获病毒,3 000 ×g离心 10 min,去除细胞碎片,补加10%~15%胎牛血清,摇匀,分装,-60 ℃保存,以第22 代病毒作为主种子批。按照《中国药典》三部(2020 版)要求进行鉴别试验、病毒滴定、无菌检查、支原体检查、外源病毒因子检查及免疫原性检查[13]。
1.6.2 工作种子批 将主种子批病毒接种至MRC⁃5细胞,培养传代至25 代,收获液即为工作种子,接种、培养、收获方法同1.6.1 项。按照《中国药典》三部(2020 版)要求对工作种子批进行鉴别试验、病毒滴定、无菌检查及支原体检查[13]。
2.1 HAV SYX1株在MRC⁃5细胞上的适应性
2.1.1 抗原含量及病毒滴度 HAV SYX1株在体外增殖慢,盲传3 代未检测到HAV 抗原(图略)。第4代病毒收获液中检出HAV 抗原,且随代次的增加,抗原含量及病毒滴度均逐渐升高,于第8 代后,抗原含量稳定在160 ~ 320 EU/mL 之间,病毒滴度维持在7.3~8.3 lgCCID50/mL。见图1。

图1 各代HAV SYX1株收获液的抗原含量及病毒滴度Fig.1 Antigen content and virus titer of harvested solution of various passages of HAV SYX1 strains
2.1.2 形态学观察 第6 代病毒收获液经镜下观察,可见免疫凝集的HAV,病毒颗粒有空心和实心两种类型,与HAV 典型形态学描述相符;
病毒颗粒直径27~32 nm,呈球形,无包膜,表面无突起。见图2。
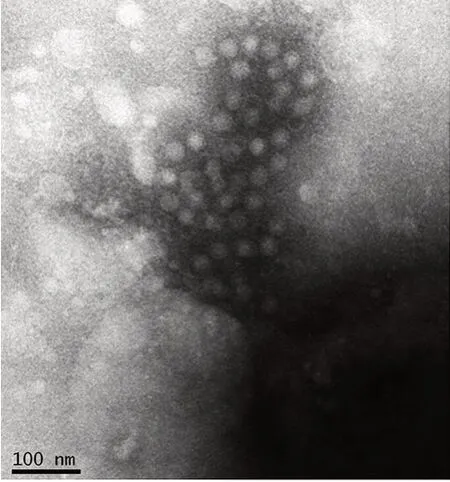
图2 HAV SYX1株形态的镜下观察Fig.2 Immune electronic micrograph(IEM)of morphology of HAV SYX1
2.1.3 理化性质 第6代病毒收获液经盐酸(pH 3.0)和乙醚处理后,滴度分别为4.03和3.93 lgCCID50/mL,与未经处理的收获液(4.20 lgCCID50/mL)比较,下降幅度均<1.0 lgCCID50/mL,表明HAV SYX1株具有耐受低pH及乙醚的特性。
2.2 病毒增殖动态评价 第13~15代的病毒培养液接种至MRC⁃5 细胞后,培养约5 d 时,各代病毒的抗原含量和滴度均较低;
培养10 d,各代病毒抗原含量和滴度上升,分别达160 EU/mL和7.0 lgCCID50/mL以上,且较稳定。见表1。确定病毒增殖高峰期为10 d。

表1 第13~15代病毒不同培养时间的抗原含量和病毒滴度Tab.1 Antigen content and virus titer of 13th ~ 15th passages at various culture durations
2.3 HAV SYX1株在MRC⁃5细胞上的遗传稳定性 HAV SYX1株cDNA 序列长为7 402 bp,涵盖部分5"非编码区和3"编码区及全部编码区,可编码2 225 个氨基酸。经BLAST 比对,HAV SYX1株与其他10 株HAV基因序列的同源性达90%以上,8 个代次HAV SYX1株间存在9 处核苷酸差异,差异点位于5"⁃NCR 及非结构蛋白2A、2B、3D的编码区;
整个结构蛋白区域的核苷酸未发生改变。HAV SYX1株属于ⅠB 亚型,与MBB株亲缘最近,HM175株次之,见图3。

图3 不同型别HAV VP1⁃2A区基因系统进化树Fig. 3 Phylogenetic tree of VP1⁃2A region genes of various types of HAV
2.4 HAV SYX1株主种子批及工作种子批的检定HAV SYX1株主种子批及工作种子批的病毒滴度分别为7.53 和7.70 lgCCID50/mL,鉴别试验、无菌试验、支原体检查结果均符合规定。HAV SYX1株主种子批外源病毒因子检查结果符合规定;
以主种子批制备甲肝灭活疫苗进行恒河猴免疫原性试验,接种疫苗的恒河猴甲肝抗体全部阳转,证明采用HAV SYX1株制备的甲肝灭活疫苗具有良好的免疫原性。
甲型肝炎灭活疫苗是将HAV 进行连续传代,增强其分裂繁殖能力,在细胞达到较强的繁殖能力后,经提纯并灭活等步骤制备而成[17],具有良好的安全性及稳定性。但HAV 体外组织培养增殖缓慢、产量较低,因此获得高产、稳定、增殖周期短的HAV 对甲型肝炎灭活疫苗研发具有重要意义。本研究将分离自甲肝患者粪便的HAV SYX1株在MRC⁃5 细胞上进行传代,获得的子代病毒呈HAV 的典型形态,具有耐受低pH 和乙醚溶剂的特性。HAV 主要抗原决定簇位于结构蛋白 VP1、VP3 及 VP2 区[18],本研究结果表明,在整个结构蛋白区域核苷酸序列均未发生变异,适应性传代对HAV SYX1株抗原性未产生影响,发生变异的位点均在5"⁃NCR 和非结构蛋白的编码区,推测可能与细胞培养适应性有关[19]。
本研究培养过程中,HAV悬浮吸附感染细胞,待细胞于37 ℃生长为单层后,降低培养温度、更换低血清含量的病毒培养液,防止细胞过度生长老化,给病毒增殖提供适宜条件,经多代次细胞适应性培养,HAV在感染10 d 后即可进入病毒增殖平台期,即达到病毒增殖高峰,缩短了生产周期。选择第22 代培养10 d 的毒种建立疫苗生产主种子批和工作种子批,并按《中国药典》三部(2020版)的要求进行检定[14],检测结果表明,病毒滴度分别为7.53 和7.70 lgCCID50/mL,符合疫苗制备需求;
其他项目检定均符合要求,其中免疫原性试验结果表明,用检定合格的HAV 培养液制备甲肝灭活疫苗,免疫恒河猴,恒河猴体内HAV抗体全部阳转,证明HAV SYX1株制备灭活疫苗具有良好的免疫原性,有望用于后续疫苗研究及生产,今后还将对疫苗生产过程中病毒培养的各种条件进行进一步优化和验证。