环境雌激素壬基酚通过SRXN1促进结直肠癌细胞增殖、侵袭和迁移的作用研究
来源:优秀文章 发布时间:2023-04-18 点击:
黎凯恺张远威张念杰尹 硕何 念万 磊陈 旭杨雪峰
(遵义医科大学第二附属医院,贵州 遵义 563006)
结直肠癌(colorectal cancer, CRC)是世界范围内最常见的恶性肿瘤之一,也是导致癌症死亡的重要原因,结直肠癌确诊时已经处于中晚期,转移及复发是导致其死亡的重要原因[1-3]。深入研究结直肠癌的发生及进展的分子机制,筛选结直肠癌早期诊断的候选靶点,是结直肠癌防治的关键。课题组前期研究发现,血清壬基酚(nonylphenol, NP)浓度在结直肠癌组显著高于正常组[4];体内、体外研究均发现NP可激活ERK通路,促进结直肠癌细胞增殖[5-7]。NP是环境内分泌干扰物(endocrine disrupting compounds, EDCs)典型代表,主要是由烷基酚聚氧乙醚(alkylphenol ethoxylates,APE)分解产生,APE广泛应用于塑料制品、纺织品、农药以及洗涤剂、油漆等家庭用品,生活中随处可见。由于NP具有亲脂性,导致其极易在组织和器官中聚集,造成内分泌紊乱、免疫异常、生殖功能障碍和肿瘤的发生[8-9]。上皮-间质转化(epithelial-mesenchymal transition, EMT)是肿瘤侵袭和迁移的重要原因[10]。NP促进vimentin及抑制E-cadherin的表达而促进卵巢癌的侵袭及迁移[11]。NP是否影响结直肠癌的侵袭及迁移,目前还未见报道。课题组通过转录组测序分析发现,SRXN1(sulfiredoxin-1)在NP干预后的人结直肠癌细胞COLO205中被显著上调。SRXN1属于保守的内源性sulfiredoxin抗氧化家族的成员之一,具有调节氧化应激反应、发挥神经保护作用[12]。最近研究发现,SRXN1的异常表达可促进卵巢癌及肝癌细胞的增殖、侵袭和迁移[13-14]。本文通过临床及细胞水平,观察NP与结直肠癌增殖、侵袭及迁移的关系及与SRXN1相关性,初步阐明NP通过SRXN1促进结直肠癌增殖、侵袭和迁移作用。
1.1 实验材料
1.1.1 细胞
结直肠癌COLO205细胞购自中国科学院典型培养物保藏委员会细胞库,由本实验室保存。
1.1.2 结直肠癌临床样本
30对结直肠癌患者肿瘤及配对的癌旁组织均为2020年1月~2020年12月在我院胃肠外科住院,经肠镜病理检查明确诊断为结直肠癌患者。患者年龄54~77岁,平均年龄60.00岁,其中男、女各15例。肿瘤及其配对的癌旁样本,取材后,等分成两份,一份置于4%多聚甲醛固定,经梯度乙醇脱水后,石蜡包埋;一份置于液氮保存。每位患者均签署知情同意书,协议由遵义医科大学第二附属医院伦理委员会审查批准(遵医伦审[2019]H-008号)。
1.2 主要试剂与仪器
壬基酚购自中国Aladdin公司(货号:84852-15-3);CCK-8(货号:CA1210)及免疫组化(货号:SP0041)检测试剂盒购自于北京索莱宝科技有限公司;qRT-PCR检测试剂盒购自于美国Thermofisher公司(货号:4472903);Anti-ERK1+ERK2 antibody(货号:ab109282)、Anti-ERK1+ERK2 (phospho T202 + Y204) antibody(货 号:ab201015)、Anti-PI 3 Kinase p85αantibody(货号:ab191606)、Anti-PI 3 Kinase p85α (phospho Y607) antibody(货 号:ab182651)购自于英国 abcam 公司;Anti-Akt antibody(货号:60203-2-Ig)、Anti-SRXN1 antibody(货号:14273-1-AP)、Anti-Phospho-AKT (Ser473) antibody(货号:80455-1-RR)、Anti-Wnt3a antibody(货号:26744-1-AP)、Anti-β-catenin antibody(货号:51067-2-AP)及Anti-GAPDH antibody(货号:60004-1-Ig)购自于武汉三鹰生物技术有限公司。si-SRXN1(si-SRXN1-1: 5’-GCCGGCUCCAAAUUCCC AATT-3’;si-SRXN1-2:5’-GGACUACAUUCAGCUG CAATT-3’)及 si-NC(negative control)(5’-TAATTGAUUGGGTTAAAGGCC-3’)购自上海吉玛制药技术有限公司。qRT-PCR引物SRXN1(Forward:5’-CAGGGAGGTGACTACTTCTACTC-3’;Reverse:5’-CAGGTACACCCTTAGGTCTGA-3’)及GAPDH引物(Forward:5’-GGAGCGAGATCCC TCCAAAAT-3’;Reverse:5’-GGCTGTTGTCATAC TTCTCATGG-3’)由生工生物工程(上海)股份有限公司合成。
HERAcell 150i1型CO2培养箱购自于美国Thermo公司;Lightcycler480型qRT-PCR仪购自于美国Roche公司;NIKON DS-U3正置荧光显微镜购自于日本尼康;Multiskan Sky全波长酶标仪购自于美国Thermo公司;FACS Calibur 流式细胞仪购自于美国BD公司;PowerPace Basic型电泳仪购自美国Bio-rad公司。
1.3 实验方法
1.3.1 细胞培养
COLO205细胞复苏后,分别置于RPMI-1640+10%胎牛血清的培养基中,37℃、5% CO2培养箱中培养,待细胞联合度达到80%~90%时,按照1∶2~1∶3的比例传代,备用。
1.3.2 RNA-seq分析
将COLO205细胞随机分成空白对照组(Control)、壬基酚(10-6mol/L)组(NP),处理24 h(NP浓度及作用时间参考[5-7])。收集细胞,样品经过RNA抽提、纯化、建库之后,采用第二代测序技术(next-generation sequencing,NGS),基于Illumina测序平台,对这些文库进行双末端(Paired-end,PE)测序;筛选差异表达基因(筛选标准:|log2FoldChange|>1,P<0.05)。测序及初步分析委托上海派森诺生物科技股份有限公司协助完成。
1.3.3 TCGA分析肠癌中SRXN1表达
UALCAN(http://ualcan.path.uab.edu/index.html)是基于癌症基因组图谱(the cancer genome atlas, TCGA)数据库构建的在线分析平台。通过UALCAN数据库分析SRXN1在肠癌中的表达情况,其中包括肿瘤样本241个,正常样本41个。
1.3.4 qRT-PCR检测SRXN1表达
将COLO205细胞随机分成空白对照组(Control)、壬基酚(10-7mol/L、10-6mol/L、10-5mol/L)组(NP),干预24 h后,收集细胞,提取RNA,逆转录成cDNA,qRT-PCR检测SRXN1的表达。同时提取结直肠癌患者肿瘤及其配对的癌旁组织RNA,逆转录成cDNA后,qRT-PCR检测SRXN1的表达变化。数据以2-△△CT表示;△CT=目的基因Ct值-内参基因Ct值,△△CT=实验组(Ct(目的基因)- Ct(GAPDH))-对照组(Ct(目的基因)- Ct(GAPDH))。
1.3.5 免疫组化检测结直肠癌组织SRXN1表达
结直肠癌患者肿瘤及其配对的癌旁组织利用4%多聚甲醛固定,石蜡包埋切片,脱蜡、水化及抗原修复后,5%BSA抗原阻断,滴加SRXN1抗体(1∶200),4℃孵育过夜;PBS清洗3次,每次5 min,滴加HRP标记的二抗,37℃孵育30 min,PBS清洗3次,每次5 min;DAB显色,苏木素复染3 min,1%盐酸乙醇分化。利用徕卡显微镜(DM1000)采集照片。利用Image-pro plus 6.0分析软件计算每个样本中SRXN1表达的平均光密度值(IOD)。
1.3.6 细胞分组及转染
取对数生长期的COLO205细胞,1×104cells/mL的细胞量传于6孔板,将COLO205细胞随机分成:空白对照组(Control)、SRXN1干扰对照组(si-NC)、壬基酚(10-6mol/L)组(NP)、SRXN1干扰组(si-SRXN1)、壬基酚+SRXN1干扰组(NP+si-SRXN1)。si-NC及si-SRXN1按照Lipofectamine 2000脂质体转染试剂盒说明书转染入COLO205细胞12 h后,再利用NP干预24 h。
1.3.7 CCK-8检测
按照CCK-8试剂盒操作说明,每孔加入10 μL CCK-8溶液,在细胞培养箱内继续孵育4 h,用酶标仪(450 nm)检测各组细胞的吸光值(OD值)。
1.3.8 克隆形成实验检测
以每皿200个COLO205细胞分别接种于37℃预温10 mL培养液的皿中,并轻轻转动,使细胞分散均匀,置37℃,5% CO2的细胞培养箱中培养14 d。弃去上清液,用PBS小心清洗2次。4%多聚甲醛固定15 min,弃去固定液,加适量吉姆萨染色液(GIMSA)染色30 min,然后洗去染色液。Nikon显微镜(TS100-F)拍照后,计算克隆形成数量。
1.3.9 Transwell检测
COLO205细胞血清饥饿24 h后,将细胞按照5×104接种到Transwell小室上层内,下层的24孔板中加入含10% FBS的RPMI-1640培养基,置于37℃、5% CO2培养箱中培养24 h后;每孔加入1 mL 4%多聚甲醛溶液,室温固定10 min;吸去固定液,用1×PBS清洗,加入1 mL 0.5%结晶紫溶液染色30 min,1×PBS洗3次,每次3~5 min;用棉签小心擦去Transwell小室内没有迁移的细胞,置于200×显微镜下观察,计数每个视野中的细胞数。
1.3.10 Western blot检测
收集细胞,利用RIPA裂解,冰上孵育20 mim后,4℃,10 000~14 000 r/min离心3~5 min,取上清,BCA定量,每孔按照20 μg蛋白量上样,SDSPAGE电泳后,转膜,分别以兔抗SRXN1(1∶800)、ERK1/2(1∶800)、p-EKR1/2(1∶800)、PI3K(1∶1000)、p-PI3K(1∶800)、Akt(1∶1000)、p-Akt(1∶800)、Wnt3a(1∶1000)、β-catenin(1∶1000)及GAPDH(1∶10000),4℃、孵育过夜后,TBST漂洗3次,加入HRP酶标抗兔二抗。加入ECL发光液膜置于全自动化学发光分析仪中扫描,通过TANON GIS软件读取相关条带灰度值。
1.4 统计学方法
所有实验均重复3次,数据以平均数±标准差(±s)表示。实验数据采用GraphPad Prism 6.0分析及绘图。多组间数据的比较采用单因素方差分析,组内两两比较采用LSD-t检验,组织标本中SRXN1表达采用配对t检验,P<0.05为差异有统计学意义。
2.1 NP对结直肠癌COLO205细胞中SRXN1表达的影响
RNA-seq分析发现,NP引起COLO205细胞中154个基因表达异常,上调基因107个,下调基因57个,其中SRXN1的log2FoldChange为2.17倍(图1A)。与空白对照组(Control)比较,不同浓度NP(10-7、10-6、10-5mol/L)分别作用COLO205细胞后,SRXN1 mRNA及SRXN1蛋白表达均显著升高(均P<0.05)(图1B、图1C)。与Control组比较,SRXN1特异性si-SRXN1-1、si-SRXN1-2均显著抑制SRXN1表达(t=7.23、5.14,均P<0.01),si-SRXN1-1的抑制效果最明显,后续实验均使用si-SRXN1-1特异性抑制SRXN1(图1D~图1F)。与si-SRXN1-1组比较,不同浓度的NP(10-7、10-6、10-5mol/L)分别作用COLO205细胞后,SRXN1 mRNA及SRXN1蛋白表达均显著升高(P<0.01)(图1G~图1I)。以上结果说明NP能够促进结直肠癌COLO205细胞中SRXN1的表达。

图1 SRXN1在COLO205细胞中的表达Figure 1 Expression of SRXN1 in COLO205 cells
2.2 SRXN1在结直肠癌中的表达分析
TCGA分析发现,在肿瘤样本中,SRXN1的表达显著高于正常肠组织(P<0.01)(图2A)。qRT-PCR检测收集的结直肠癌肿瘤组织样本中SRXN1 mRNA表达量显著高于癌旁组织(t=10.23,P<0.01)(图2B);IHC检测分析发现,结直肠癌肿瘤组织样本中SRXN1的表达显著高于癌旁组织(t=6.64,P<0.01)(图2C、图2D)。以上结果说明,在结直肠癌中,SRXN1的表达显著升高。
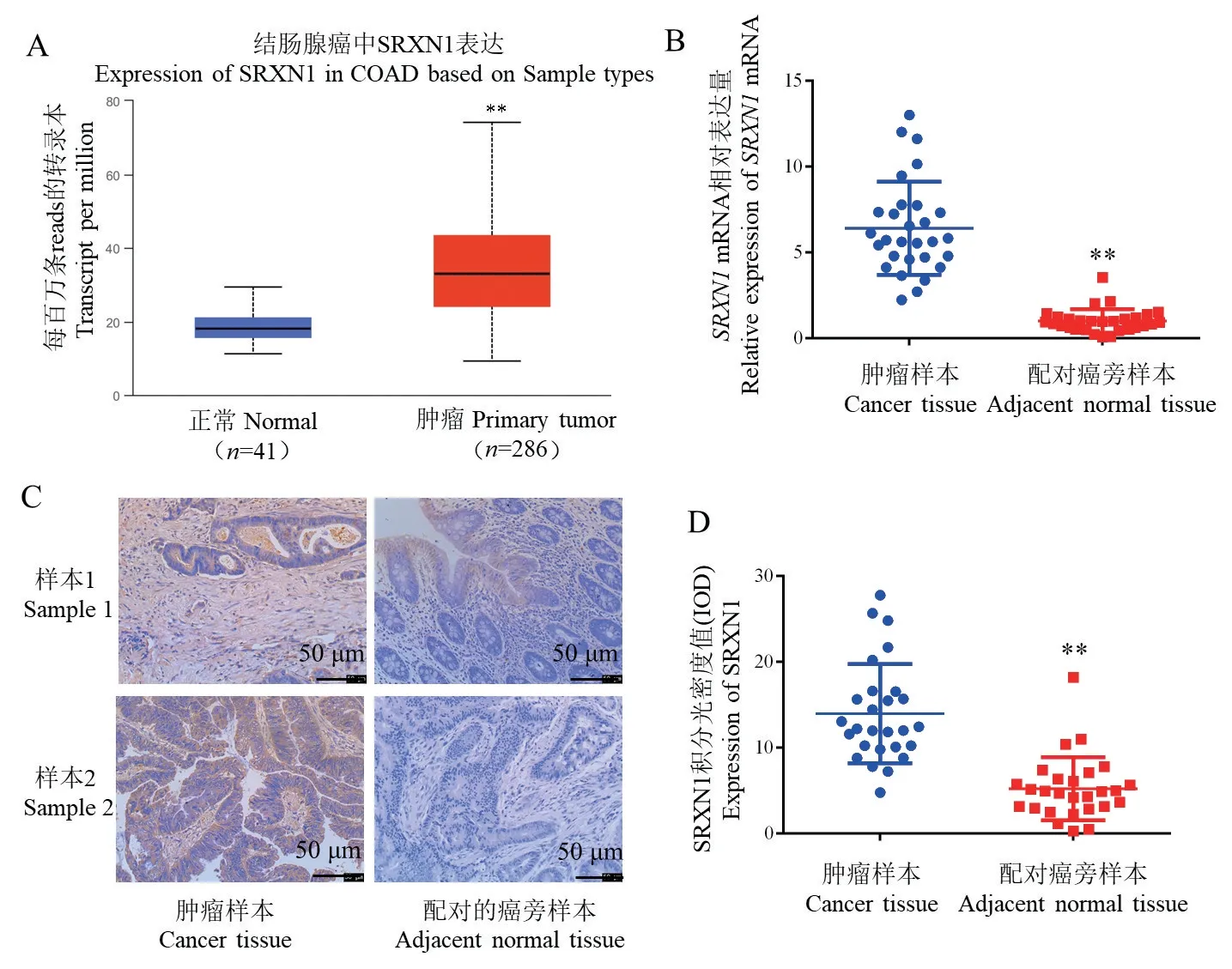
图2 SRXN1在结直肠癌中的表达Figure 2 Expression of SRXN1 in colorectal cancer
2.3 SRXN1抑制后,NP对结直肠癌细胞增殖影响
CCK-8检测发现,与Control组比较,NP组细胞活力显著高于Control组(t=4.64,P<0.01),而si-SRXN1组细胞活力显著低于Control组;与si-SRXN1组比较,NP+si-SRXN1组细胞活力显著增加(t=5.72,P<0.01)(图3A)。与Control组比较,NP组克隆数显著高于Control组(t=5.64,P<0.01),si-SRXN1组显著低于Control组(t=10.76,P<0.01);与si-SRXN1组比较,NP+si-SRXN1克隆数显著增多(t=4.24,P<0.05)(图3B、图3C)。

图3 COLO205 细胞增殖能力检测Figure 3 COLO205 cell proliferation capacity assay
2.4 SRXN1抑制后,NP对结直肠癌细胞侵袭及迁移能力的影响
NP组细胞侵袭数著高于Control组(t=2.31,P<0.01);si-SRXN1组COLO205细胞侵袭数显著低于Control组(t=4.99,P<0.01)。与si-SRXN1组比较,NP+si-SRXN1能够促进细胞的侵袭(t=2.97,P<0.01)(图4A~图4C)。NP组COLO205细胞迁移数显著高于Control组(t=2.45,P<0.01);si-SRXN1组COLO205细胞迁移数显著低于Control组(t=4.19,P<0.01)。与si-SRXN1组比较,NP+si-SRXN1能够促进细胞的迁移(t=2.07,P<0.01)(图4A~图4C)。
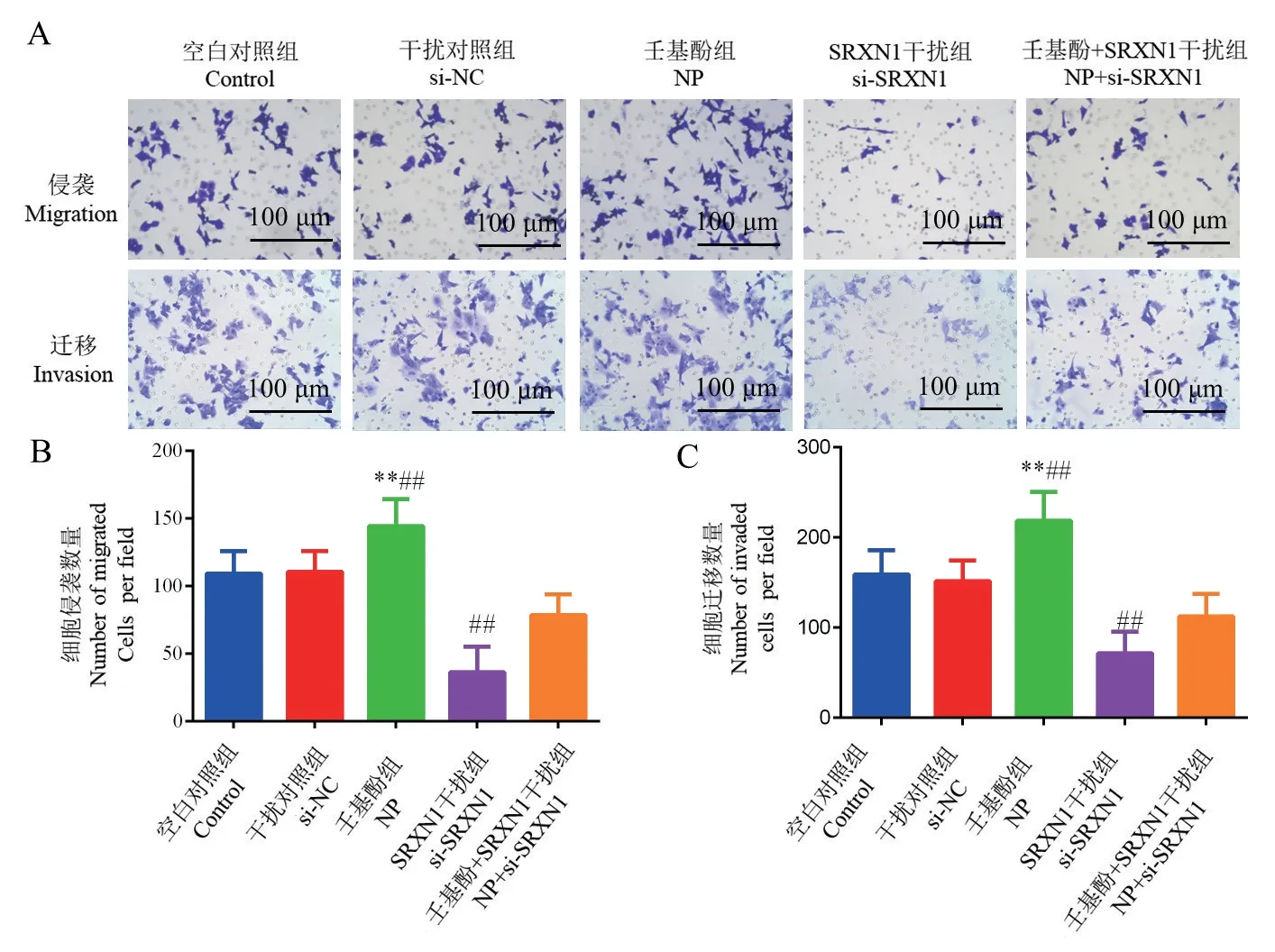
图4 COLO205细胞侵袭及迁移能力变化Figure 4 Changes in invasion and migration ability of COLO205 cells
2.5 SRXN1抑制后,NP对增殖、侵袭相关通路激活的影响
课题组前期研究发现NP可通过激活ERK1/2促进结直肠癌细胞增殖[5-7]。PI3K/Akt、Wnt/βcatenin在多种肿瘤中异常激活,调节肿瘤的增殖及EMT。Western blot检测发现:与Control组比较,NP显 著 促 进p-ERK1/2、p-PI3K、p-Akt、Wnt3a、βcatenin的表达(t=3.34、3.04、4.80、6.81、5.71,均P<0.01),而si-SRXN1组抑制p-ERK1/2、p-PI3K、p-Akt、Wnt3a、β-catenin的 表 达(t=13.34、8.75、11.74、8.65、12.47,均P<0.01);与si-SRXN1组比较,NP+si-SRXN1组中p-ERK1/2(t=4.80,P<0.01)、p-PI3K(t=3.82,P<0.01)、p-Akt(t=3.78,P<0.05)、Wnt3a(t=4.48,P<0.05)、β-catenin(t=6.90,P<0.05)的表达显著升高。以上结果说明NP能够促进ERK1/2、PI3K/Akt、Wnt/β-catenin通路的激活,而SRXN1显著抑制上述通路的激活影响COLO205细胞的增殖及侵袭能力(图5)。

图5 Western blot检测PI3K/Akt、ERK、Wnt3a/β-catenin通路表达Figure 5 Expression of PI3K/Akt, ERK1/2 and Wnt3a/β-catenin pathways detected by Western blot
随着现代工业的发展,大量化学物质释放到自然环境中,造成极大的环境污染,其中一类外源性化学物质可模仿或部分模仿性激素,并通过与性激素受体结合或影响细胞信号途径等方式发挥毒性作用,这类物质被称为环境内分泌干扰物(EDCs)亦称环境雌激素[15]。研究发现EDCs能够引起人类生育能力降低和诱发多种疾病,如肥胖症、糖尿病和癌症[16]。NP是EDCs的典型代表,由于NP具有亲脂性,导致其极易在组织和器官中聚集,与肿瘤的发生密切相关[8-9]。深入阐明NP与肿瘤的发生、进展的关系,对肿瘤的防治具有重要的意义。
肿瘤的发生及进展受氧化应激水平调节,活性氧通过调节炎症、线粒体功能、激活MAPK及AMPK等通路促进肿瘤的发生及进展[17-18]。NP能够引起机体氧化应激水平的失衡,促进ROS及炎症因子的释放促进心脏毒性、胃粘膜炎症、卵巢颗粒细胞的凋亡和自噬[19-20]。RNA-seq及qRT-PCR检测发现,NP引起SRXN1表达显著上调。SRXN1属于保守的内源性Sulfiredoxin 抗氧化家族的成员之一,可通过调节活性氧的释放,发挥神经保护作用[12]。最近研究发现,SRXN1 在多种恶性肿瘤中具有促进增殖及转移的能力[21-22],SRXN1通过影响过氧化物酶活性,调节ROS水平,以使组织免受氧化应激损伤,进而促进肿瘤细胞增殖及EMT的发生[23-24]。本文研究发现,抑制SRXN1 的表达后,结直肠癌COLO205细胞的增殖、侵袭及迁移能力显著降低,而NP则得到相反的结果。暗示NP促进结直肠癌细胞增殖、侵袭及迁移可能与SRXN1表达相关,但NP如何影响SRXN1表达以及与氧化应激的关系,还需通过实验进一步研究。
调节细胞增殖及转移的主要通路为ERK1/2、PI3K/Akt及Wnt/β-catenin等,ERK1/2、PI3K/Akt在多种肿瘤中异常激活,调节肿瘤的增殖、分化及EMT[25]。ERK1/2的异常激活,促进增殖相关蛋白(CyclinD1、C-myC、PCNA)的表达,促进结直肠癌细胞增殖[7],抑制PI3K/Akt通路后,显著抑制卵巢癌细胞EMT及增殖[26]。SRXN1可通过激活Wnt/βcatenin[27]、ERK1/2[28]及PI3K/Akt[29]通路。通过Western blot检测发现,NP显著促进p-ERK1/2、p-Akt及Wnt3a、β-catenin的表达,暗示NP能够显著激活ERK1/2、PI3K/Akt及Wnt/β-catenin通路;SRXN1抑制后,NP对ERK1/2、PI3K/Akt及Wnt/βcatenin通路的激活作用被减弱,暗示NP激活ERK1/2、PI3K/Akt及Wnt/β-catenin通路与SRXN1表达相关。
综上所述,NP可促进SRXN1的表达,调节结直肠癌细胞的增殖、侵袭及转移,其分子机制与ERK1/2、PI3K/Akt及Wnt/β-catenin等通路激活有关;但NP与SRXN1具体调控机制,还有待进一步研究。
猜你喜欢壬基货号直肠癌鞋品牌新品爆单“故事汇”服饰导报·鞋世界(2021年4期)2021-05-17壬基酚对Lix984N溶剂萃取铜的影响试验研究湿法冶金(2020年6期)2020-12-21作者更正致歉说明中国药理学通报(2019年5期)2019-01-11腹腔镜下直肠癌前侧切除术治疗直肠癌的效果观察中国医药指南(2017年3期)2017-11-13直肠癌术前放疗的研究进展西南军医(2016年3期)2016-01-23抗氧剂壬基二苯胺的合成及其热稳定性合成化学(2015年9期)2016-01-17COXⅠ和COX Ⅲ在结直肠癌组织中的表达及其临床意义中国继续医学教育(2015年6期)2016-01-07壬基酚聚氧乙烯醚在反相液相色谱上的保留行为浙江理工大学学报(自然科学版)(2015年5期)2015-03-01GRP及GRPR在结直肠癌中的表达及意义中国当代医药(2015年30期)2015-03-01欧盟将在可洗涤纺织品中限制使用壬基酚聚氧乙烯醚中国洗涤用品工业(2015年9期)2015-02-28推荐访问:雌激素 增殖 侵袭