从Janus激酶2/信号转导和转录激活因子3信号通路探讨牛磺酸对Aβ25-35所致神经干细胞损伤的保护作用
来源:优秀文章 发布时间:2023-02-16 点击:
李婷君,王晶
阿尔茨海默病(Alzheimer"s disease,AD)是一种表现为认知与记忆功能减退的神经系统退行性疾病,β-淀粉样蛋白(β-amyloidpeptide,Aβ)异常沉积形成老年斑(senile plaque,SP)沉积、神经元纤维缠结(neurofibrillary tangles,NFT)和神经元丢失等是其主要病理表现[1]。AD发病机制目前主要认为与Aβ沉积、tau过度磷酸化、神经炎症及氧化应激等有关。其中Aβ沉积被认为是AD发病的始动因素与重要环节,认为Aβ异常沉积形成的老年斑可诱发tau蛋白异常磷酸化,并造成神经元纤维缠结与突触丢失等级联反应,最终导致神经元凋亡及突出丢失引发临床症状[2-3]。成体哺乳动物脑内被证实存在神经干细胞(neural stem cells,NSCs),促进其增殖、迁移,并且向神经元分化产生神经功能,被认为是修复神经功能损伤的有效途径。然而由于AD病人脑内Aβ的异常沉积造成了大量神经元凋亡及突触丢失,该途径被抑制,因此寻找有效手段促进NSCs增殖并向神经元分化,补充丢失的神经元并恢复神经功能被认为是治疗AD的新希望[4]。NSCs的增殖、分化受机体多条信号转导通路共同调控,其中Janus激酶2∕信号转导和转录激活因子3(JAK2∕STAT3)信号通路在NSCs增殖与分化过程中发挥了重要作用[5]。
牛磺酸是一种游离氨基酸之一,具有保护视力、调节免疫功能、抗氧化、调节糖脂代谢等多种生理作用。此外牛磺酸还具有神经递质、神经营养因子的作用,具有一定的神经保护作用[6]。有研究表明,牛磺酸可促进缺氧缺糖诱导的NSCs向神经元分化[7]。但是其对AD模型NSCs的增殖与分化的影响尚未见报道。因此本研究以Aβ25-35诱导NSCs损伤复制AD-NSCs模型,观察牛磺酸对AD-NSCs的增殖、分化及凋亡的影响,并通过AK2∕STAT3信号通路分析探讨分子机制。
本研究自2019年3月至2019年11月通过Aβ25-35损伤从新生小鼠脑内提取的神经干细胞,建立AD体外模型,探讨牛磺酸和JAK2∕STAT3的作用关系。
1.1 动物C57BL∕6小鼠,SPF级,雌雄各半,体质量范围22~27 g,8~10周龄,购买于辽宁长生生物技术有限公司,许可证号SCXK(辽)2019-0001。每只鼠笼内放置1只雄鼠和1只雌鼠,使其自然繁殖。动物实验在辽宁中医药大学实验动物中心实验室饲养,满足实验动物3R原则。本研究符合一般动物实验伦理学原则。小鼠饲养于屏障环境动物设施内饲养,恒温20~25℃,恒湿55%~65%,自由饮用食水。
1.2 实验试剂牛磺酸(美国Sigma公司,批号6730-83-2),NSCs专用培养基(广州赛业生物科技有限公司,批号T202026D501);
Aβ25-35多肽(北京博奥森生物科技有限公司,货号Y-0044);
CCK-8试剂盒(北京碧云天生物有限公司,货号C0037);
EDU试剂盒(Invitrogen公司,货号A10044);
B细胞淋巴瘤∕白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶-3(caspase-3)及β-肌动蛋白(β-actin)引物购于北京赛诺科为生物科技有限公司;
巢蛋白(Nestin)、胚胎干细胞关键蛋白(Sox-2)、胶质纤维酸性蛋白(GFAP)、神经元核抗原(NeuN)、少突胶质细胞转录因子2(OLIG-2)、总Janus激酶2(t-JAK2)、总信号转导和转录激活因子3(t-STAT3)、磷酸化JAK2(p-JAK2)、p-STAT3及甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Cell Signaling Technology公司,批号33475S、2748S、80788T、24307S、52635S、3230S、66245S、12640T、9145S、5174S);
Cy3、FITC标记二抗(美国Jackson公司,货号147259、147301);
辣根过氧化物酶(HRP)标记二抗(北京中杉金桥生物公司,批号201902433);
RevertAidTM cDNA合成试剂盒、TRIzolTM试剂(美国Thermo Fisher Scientific公司,批 号20180914、20170621);
TransStart®Top Green qPCR SuperMix(北京全式金生物技术有限公司,批号2019010123);
二辛可宁酸(BCA)蛋白定量试剂盒、增强化学发光(ECL)发光试剂盒(碧云天生物技术有限公司,批号P0012S、P0018FS),其他试剂均为国产分析纯。
1.3 仪器HCP-168型细胞培养箱(青岛海尔);
Ti-S型荧光显微镜(日本尼康);
7500型Real-time PCR仪(美国ABI);
MR96型酶标仪(深圳迈瑞);
1645050水平核酸电泳仪、1658001蛋白转膜仪、ChemiDoc XRS+凝胶成像系统(美国Bio-Rad)。
1.4 实验方法
1.4.1 神经干细胞的分离、培养与鉴定取新生48 h内乳鼠的脑室下区和海马区组织,剪碎、0.25%胰酶消化20 min,加入含10%FBS的培养基终止消化,除去大细胞团,得到细胞悬液,过200目细胞筛网,并接种于24孔板中(接种密度5×109个∕L),置于37℃、5%二氧化碳-95%空气的细胞恒温培养箱中培养。第3天时进行半量换液,细胞逐渐以悬浮的NSCs球形式进行生长。细胞传代至第三代时,利用免疫荧光染色进行鉴定[观察神经巢蛋白(Nestin)、胚胎干细胞关键蛋白(Sox-2)阳性表达情况]。
1.4.2 Aβ23-35寡聚体的制备取Aβ23-351.0 mg溶于六氟异丙醇(HF1P),涡旋后室温下静置直至液体澄清。放入冷冻干燥机内冷冻干燥,得到无色透明的Aβ肽膜。向Aβ肽膜内加入适量DMSO,得到Aβ-DMSO溶液,加入PBS溶液涡旋混匀后置于4℃内孵育24 h,既得到1 mol∕L Aβ23-35寡聚体母液。取适量母液用培养液稀释至25 μmol∕L,备用。
1.4.3 分组与给药实验组分为对照组、模型组(25 μmol∕L Aβ23-35)、Aβ25-35+牛 磺 酸5 mmol组、Aβ25-35+牛磺酸10 mmol组、Aβ25-35+牛磺酸15 mmol组及Aβ25-35+牛磺酸20 mmol组,共六组[7]。药物于Aβ25-35孵育12 h后加入,共同孵育48 h后进行以下指标检测。
1.4.4 CCK-8检测细胞活力将神经球打散,接种于96孔板中,每孔4×105个细胞,继续培养,检测时每孔加入20 μL CCK-8染色液继续培养2 h后,置于酶标仪中,450 nm处测定吸光度(OD)。细胞活力%=(OD实验组∕OD正常组)×100%,实验重复3次。
1.4.5 NSCs增殖能力检测
1.4.5.1 NSCs球半径的测量分别于给药后第3、5、7天,将培养板置于显微镜下,观察NSCs球生长情况,Image J分析软件测量各组神经球的半径,并绘制生长曲线,实验重复3次。
1.4.5.2 EDU增殖检测根据Invitrogen公司ClickiT EDU试剂盒说明书步骤进行荧光染色,荧光显微镜下观察并拍照,利用Image J软件计量增殖阳性细胞数量并计算各组NSCs增殖比率,实验重复3次。
1.4.6 免疫荧光染色检测NSCs分化能力将96孔板中的各组细胞增殖培养液吸出,加入200 μL含有10%FBS和1%P∕S的DMEM∕F12培养液中培养,并相应分为对照组、模型组(25 μmol∕L Aβ23-35)、Aβ25-35+牛磺酸5 mmol组、Aβ25-35+牛磺酸10 mmol组、Aβ25-35+牛磺酸15 mmol组及Aβ25-35+牛磺酸20 mmol组。7 d后,利用免疫荧光细胞化学染色法观察神经元标记物神经元核抗原(NeuN)、星形胶质细胞标志物胶质纤维酸性蛋白(GFAP)与少突胶质细胞标志物少突胶质细胞转录因子2(OLIG-2)阳性表达,实验重复3次。
1.4.7 Real-time PCR检测凋亡相关基因的表达将打散的单个神经球按每孔5×106∕mL接种于6孔板中,牛磺酸孵育48 h后利用Trizol试剂提取RNA。按照cDNA合成试剂盒说明书反转录得到cDNA。以cDNA为模板,按TransStart Top Green qPCR SuperMix说明书进行体外扩增,各基因引物序列见表1。反应体系(共20 μL):cDNA 2 μL、Forward Primer(10 μmol)0.4 μL、Reverse Primer(10 μmol)0.4 μL、2×TransStart Top Green qPCR SuperMix 10 μL、双蒸水7.8 μL。反应条件:95℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸60 s,循环35次;
72℃再延伸1 min。以β-actin作为内参,使用2-ΔΔCt法计算各基因的相对表达量。

表1 基因引物序列
1.4.8 蛋白质印迹法检测JAK2∕STAT3信号通路相关蛋白提取各组细胞总蛋白,BCA法测定蛋白浓度,加入4倍上样缓冲液,加热变性蛋白,随后进行SDS-PAGE电泳、转膜、封闭后,加入1∶1 000稀释的t-JAK2、t-STAT3、p-JAK2、p-STAT3及GAPDH工作液,4℃过夜;
加入HRP标记二抗工作液(1∶1 000),孵育1 h,采用ECL发光后显影定影。Image J分析软件被用来进行灰度值分析,结果利用目的蛋白比内参蛋白GAPDH的灰度值表示。
1.5 统计学方法利用SPSS 18.0软件对数据进行统计分析。所有数据以xˉ±s表示,多组之间差异比较采用单因素方差分析,两组间差异比较采用LSDt检验。P<0.05为差异有统计学意义。
2.1 NSCs的鉴定第3代NSCs生长成细胞球状,并且经过多次传代后形成的NSCs球差异无统计学意义,NSCs球表达神经干细胞标志物Nestin与Sox-2,可用于后续实验。
2.2 牛磺酸对AD-NSCs的活力及增殖能力的影响与对照组相比,模型组NSCs活力降低(P<0.05);
而经过不同浓度的牛磺酸孵育后,NSCs活力均有不同程度的升高,其中10 mmol牛磺酸组细胞活力与模型组相比升高最为明显(P<0.05);
5 mmol、15 mmol与20 mmol组细胞活力与模型组相比虽显著升高(P<0.05),但是不及10 mmol牛磺酸明显。通过测量NSCs球半径观察不同浓度牛磺酸对其增殖能力的影响所示,在增殖培养基中加入不同浓度的牛磺酸(5、10、15和20 mmol)后NSCs球半径均有不同程度的增加,各浓度牛磺酸组NSCs球半径从大到小依次为10 mmol>15 mmol>5 mmol>20 mmol。其中,从第5天开始,10 mmol与15 mmol组NSCs球半径与模型组相比,差异有统计学意义(P<0.05);
而5 mmol与20 mmol组NSCs球半径与模型组相比,差异无统计学意义(P>0.05)。结果见图1,表2。
表2 牛磺酸对AD-NSCs活力及半径的影响

表2 牛磺酸对AD-NSCs活力及半径的影响
注:①与对照组比较,P<0.05。②与模型组比较,P<0.05。
组别对照组模型组5 mmol牛磺酸组10 mmol牛磺酸组15 mmol牛磺酸组20 mmol牛磺酸组F值P值细胞数∕个9 9 9 9 9 9半径∕μm 3 d 70.26±7.11 42.70±3.48①45.28±2.69 43.53±3.79 43.38±3.68 42.65±3.13 70.78 0.068 5 d 86.92±4.21 46.70±2.84 49.73±5.50 53.85±3.31②52.27±3.65②49.09±4.32 125.20 0.003 7 d 111.37±11.98 50.03±5.52 56.73±5.04 67.19±6.34②61.16±5.58②59.09±5.52 87.98 0.003活力∕%100.00 61.25±6.36①74.82±5.14②81.58±7.03②74.32±8.27②69.33±4.36②18.65 0.012

图1 牛磺酸对AD-NSCs半径的影响(×20)
我们进一步利用EDU染色观察了不同浓度牛磺酸对AD-NSCs增殖能力的影响,结果10 mmol与15 mmol牛磺酸组增殖NSCs数量显著增加,与模型组相比较,差异有统计学意义(P<0.05)。而5 mmol与20 mmol组增殖NSCs数量与模型组相比较,差异无统计学意义(P>0.05)。结果见表3。
表3 牛磺酸对AD-NSCs增殖能力的影响∕(%

表3 牛磺酸对AD-NSCs增殖能力的影响∕(%
注:①与对照组比较,P<0.05。②与模型组比较,P<0.05。
组别对照组模型组5 mmol牛磺酸组10 mmol牛磺酸组15 mmol牛磺酸组20 mmol牛磺酸组F值P值细胞数∕个9 9 9 9 9 9增殖细胞比例78.36±6.72 43.19±3.06①46.95±6.42 56.57±8.11②52.74±7.15②48.57±8.23 10.20 0.005
2.3 牛磺酸促进AD-NSCs向神经元分化NSCs球打散后培养于分化培养基中,并加入不同浓度的牛磺酸(5、10、15和20 mmol)培养7 d后,NSCs分化为不同的神经细胞类型。NSCs分化为3种神经细胞表型,分别为神经元(NeuN+),星形胶质细胞(GFAP+)和少突胶质细胞(OLIG-2+)。经Image J定量分析发现不同浓度的牛磺酸均具有诱导NSCs向神经元分化的能力,其中10 mmol组神经元细胞数量最多,与模型组相比,差异有统计学意义(P<0.05);
其次为15 mmol组,神经元数量与模型组相比,差异有统计学意义(P<0.05)。其余两组神经元数量与模型组相比,差异无统计学意义(P>0.05)。并且牛磺酸10 mmol与15 mmol能显著抑制NSCs向星形胶质细胞分化,星形胶质细胞数量与模型组相比,差异有统计学意义(P<0.05)。各组少突胶质细胞数量差异无统计学意义(P>0.05)。见表4。
表4 牛磺酸对AD-NSCs分化能力的影响∕(%
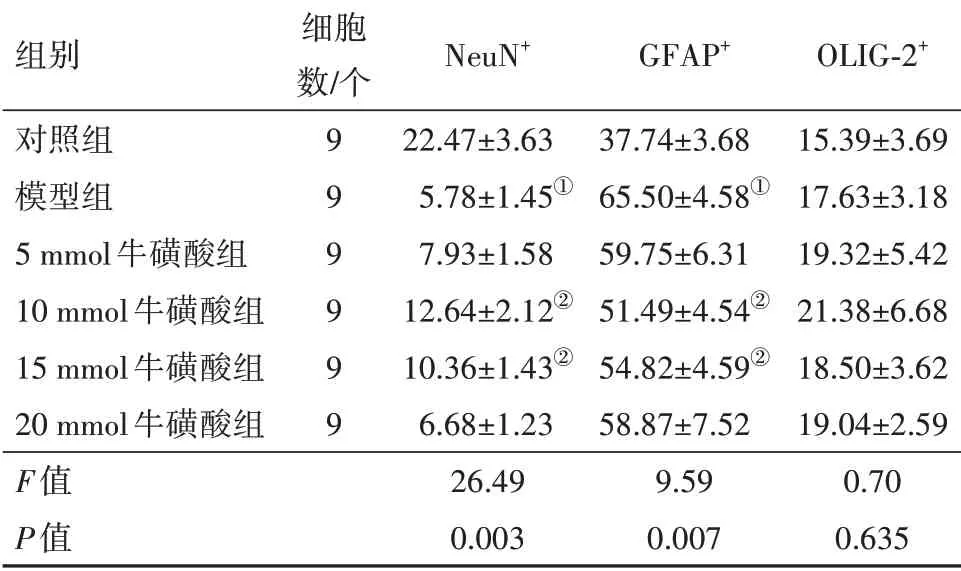
表4 牛磺酸对AD-NSCs分化能力的影响∕(%
注:NeuN为神经元核抗原,GFAP为胶质纤维酸性蛋白,OLIG-2为少突胶质细胞转录因子2。①与对照组比较,P<0.05。②与模型组比较,P<0.05。
组别对照组模型组5 mmol牛磺酸组10 mmol牛磺酸组15 mmol牛磺酸组20 mmol牛磺酸组F值P值细胞数∕个9 9 9 9 9 9 NeuN+22.47±3.63 5.78±1.45①7.93±1.58 12.64±2.12②10.36±1.43②6.68±1.23 26.49 0.003 GFAP+37.74±3.68 65.50±4.58①59.75±6.31 51.49±4.54②54.82±4.59②58.87±7.52 9.59 0.007 OLIG-2+15.39±3.69 17.63±3.18 19.32±5.42 21.38±6.68 18.50±3.62 19.04±2.59 0.70 0.635
2.4 牛磺酸抑制AD-NSCs凋亡相关基因表达与对照组相比,模型组NSCs Bax∕Bcl-2比值显著升高,caspase-3 mRNA表达也显著升高,差异有统计学意义(P<0.05);
而给予不同浓度的牛磺酸共同孵育后,Bax∕Bcl-2比值降低,caspase-3 mRNA表达也降低;
5 mmol、10 mmol和15 mmol牛磺酸组与模型组比较,差异有统计学意义(P<0.05);
而20 mmol牛磺酸组与模型组比较,差异无统计学意义(P>0.05)。结合以上实验结果,我们可以初步推测在5~20 mmol范围内,10 mmol牛磺酸对AD-NSCs的保护作用最显著,因此后续机制研究选用10 mmol牛磺酸组作为研究对象。见表5。
表5 牛磺酸对AD-NSCs凋亡相关基因表达的影响∕

表5 牛磺酸对AD-NSCs凋亡相关基因表达的影响∕
注:Bax为B细胞淋巴瘤-2相关X蛋白,Bcl-2为B细胞淋巴瘤∕白血病-2,caspase-3为胱天蛋白酶-3。①与对照组比较,P<0.05。②与模型组比较,P<0.05。
组别对照组模型组5 mmol牛磺酸组10 mmol牛磺酸组15 mmol牛磺酸组20 mmol牛磺酸组F值P值细胞数∕个9 9 9 9 9 9 Bax∕Bcl-2 0.58±0.09 1.35±0.11①0.85±0.05②0.77±0.06②0.81±0.12②1.13±0.08 29.44 0.001 caspase-3 1.04±0.09 1.81±0.12①1.68±0.16②1.49±0.09②1.54±0.06②1.72±0.14 17.10 0.001
2.5 牛磺酸抑制JAK2/STAT3信号通路与对照组相比,模型组NSCs中p-JAK2∕t-JAK2、p-STAT3∕t-STAT3蛋白表达显著升高,差异有统计学意义(P<0.05);
而给予10 mmol牛磺酸孵育后,NSCs中p-JAK2∕t-JAK2、p-STAT3∕t-STAT3蛋 白 表 达 显 著 降低,与模型组相比较,差异有统计学意义(P<0.05)。见图2,表6。
表6 牛磺酸对AD-NSCs中JAK2∕STAT3信号通路活性的影响

表6 牛磺酸对AD-NSCs中JAK2∕STAT3信号通路活性的影响
注:t-JAK2为总Janus激酶2,t-STAT3为总信号转导和转录激活因子3,p-JAK2为磷酸化JAK2,p-STAT3为磷酸化STAT3,GAPDH为甘油醛-3-磷酸脱氢酶。①与对照组比较,P<0.05。②与模型组比较,P<0.05。
组别对照组模型组10 mmol牛磺酸组F值P值细胞数∕个3 3 3 p-JAK2∕t-JAK2 0.79±0.12 1.71±0.09①1.24±0.14②45.24 0.002 p-STAT3∕t-STAT3 1.12±0.10 1.79±0.13①1.36±0.11②20.93 0.003

图2 JAK2∕STAT3信号通路相关蛋白的电泳图
Aβ来自于21号染色体前体APP蛋白,Aβ由APP蛋白经过α-水解酶、β-水解酶和γ-水解酶水解,依次释放Aβ肽和胞内小肽,能引发神经元退变、丢失凋亡等损伤作用。其决定毒性的主要部位在第25-35氨基酸序列,即Aβ25-35,其可通过在神经细胞外蓄积,诱导细胞骨架改变,造成神经损伤。有研究表明,Aβ25-35会导致突触可塑性障碍,从而损伤学习记忆能力[8]。因此Aβ25-35与NSCs共同孵育来建立体外NSCs的AD模型被广泛认可[9]。神经元不具有增殖分裂能力,因此其在发育时期主要由静息的NSCs分化而来[10]。成年哺乳动物NSCs在脑内分布是存在局限的,主要分布于海马齿状回颗粒层下区(subgranular,SGZ)和侧脑室周边的室管膜下区(subventricular zone,SVZ)这两个区域[11-12]。生理状态下,它们处于静息状态,但是在AD等中枢神经系统退行性疾病中它们会代偿性地被激活,并促进其向神经元分化以促进内源性神经再生,弥补缺损的神经组织[13]。然而,由于Aβ沉积可引起线粒体功能障碍而诱导氧化应激,还可触发小胶质细胞活化,诱导神经炎症,导致NSCs向胶质细胞分化,最终导致神经元数量减少[14]。因此寻求一种能够促进NSCs向神经元分化的手段至关重要。
牛磺酸是一种体内含量丰富的非必需氨基酸,在新生哺乳动物中枢神经系统中主要分布于大脑皮层、海马及小脑等区域,且含量较为丰富,但在成年哺乳动物神经系统中牛磺酸的水平非常低[15]。在突触前膜神经元,牛磺酸与牛磺酸受体结合,引起神经元超极化,从而发挥类神经递质样作用。牛磺酸还能够通过抑制神经炎症反应、氧化应激及内质网应激,发挥神经保护的作用。另有研究证明,牛磺酸可减轻神经元损伤,并且能够促进NSCs增殖[16-17]。此外,还有研究表明,牛磺酸可促进脑缺血大鼠NSCs增殖,并促进其向神经元分化[18],但是对AD模型NSCs的影响,未见报道。本研究结果显示,牛磺酸能够增加AD-NSCs的活力、增强NSCs增殖能力并促进其向神经元分化、还可以死抑制ADNSCs促凋亡基因的表达并增加抗凋亡基因的表达,发挥抗凋亡作用。以上结果说明了牛磺酸可通过促进NSCs增殖、抑制其凋亡,并促进NSCs向神经元分化,促进内源神经再生治疗AD。此外,从本研究实验结果可以看出5 mmol、15 mmol牛磺酸对AD-NSCs的保护作用均弱于10 mmol,且20 mmol牛磺酸显示出了部分细胞毒性。牛磺酸不是蛋白分子,不能通过代谢排出细胞外且降解速率很慢,这可能会造成牛磺酸在细胞内积蓄过多,产生一系列毒性作用,从而导致出现随着浓度的增加,保护作用减弱的现象,但是具体作用机制仍需进一步去验证。
JAK2∕STAT3信号通路在NSCs的增殖与分化过程中起到至关重要的作用,AD状态下释放的炎症因子、神经营养因子会激活JAK2,进而激活STAT3使其发生磷酸化并移位至核内与星形胶质细胞特异性基因GFAP启动子结合,促进NSCs向星形胶质细胞分化[19]。而在机体发育时期,脑内JAK2∕STAT3信号通路活性处于抑制状态,STAT3磷酸化水平低,可促进NSCs向神经元的分化[20]。Wu等[21]发现清脑益智汤可通过抑制JAK2∕STAT3信号通路活性,抑制NSCs向星形胶质细胞的分化。Chen等[22]发现JAK2∕STAT3信号通路参与了妊娠期甲状腺功能亢进症对胚胎NSCs增殖和维持的过程,并且利用超生理剂量的3,5,3"-L-三碘甲状腺原氨酸(T3)可通过抑制JAK2∕STAT3信号通路活性,增强了乳鼠脑内NSCs的维持与向神经元分化的能力。本研究结果发现,AD-NSCs中JAK2∕STAT3信 号 通路 被 激活,JAK2、STAT3磷酸化水平显著升高;
而给予牛磺酸后NSCs中JAK2、STAT3磷酸化水平显著降低,JAK2∕STAT3信号通路被抑制,说明了牛磺酸可通过抑制STAT3磷酸化,继而影响了其与GFAP启动子结合,从而抑制了NSCs向星形胶质细胞的分化,同时促使其向神经元分化。
综上所述,牛磺酸可通过促进AD-NSCs增殖及其向神经元分化,并减少NSCs凋亡,发挥神经保护作用,这种作用在一定程度上可能是通过抑制JAK2∕STAT3信号通路实现的,但是具体作用机制仍需进一步的验证。
猜你喜欢 牛磺酸胶质分化 牛磺酸真有用吗?电脑报(2022年25期)2022-07-05两次中美货币政策分化的比较及启示清华金融评论(2022年4期)2022-04-13牛磺酸的生物学功能及其在动物生产中的应用饲料工业(2021年6期)2021-04-16分化型甲状腺癌切除术后多发骨转移一例国际放射医学核医学杂志(2021年10期)2021-02-28研究神经胶质细胞的新兴技术神经损伤与功能重建(2020年10期)2020-12-23人类星形胶质细胞和NG2胶质细胞的特性神经损伤与功能重建(2020年11期)2020-12-01鲁政委:房地产同城市场初现分化房地产导刊(2020年7期)2020-08-24牛磺酸, 猫和人都需要的营养素食品与健康(2020年7期)2020-07-09NGF steersm icroglia toward a neu rop rotective phenotype神经损伤与功能重建(2018年2期)2018-02-01GSK-3β活性与小胶质细胞TLR4受体在POCD发生中的作用机制中国生化药物杂志(2015年4期)2015-07-07推荐访问:转导 信号 牛磺酸