CYP19A1调控内源性雌激素合成促进牦牛COCs细胞自噬和早期发育能力
来源:优秀文章 发布时间:2023-01-23 点击:
王立斌,王 萌,孙 莹,陈 睿,张甜甜,黄振华,张 倩,余四九,潘阳阳*
(1.甘肃农业大学动物医学院,兰州 730070;
2.甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
雌激素(17β-estradiol, E2)作为雌性动物主要类固醇类激素,由胆固醇产生,性腺分泌[1],在动物卵母细胞成熟、排卵、胚胎发育等生理过程中的生物效应因动物种类不同存在一定差异[2]。在水牛[3]、山羊[4]和猪卵母细胞成熟过程加入外源E2或促进内源E2合成与分泌,能够改善卵母细胞成熟,增加卵丘细胞扩散。研究发现,动物机体中E2可激活机体多种细胞雌激素受体(estrogen receptor, ESR),调控细胞自噬相关蛋白,改变细胞和组织形态[5-6]。E2调控细胞自噬分子机制存在多样性,如增加细胞溶酶体数量、抑制自噬相关micRNA、影响细胞组蛋白修饰等,且作用靶基因较多,如自噬相关基因5(autophagyrelated gene 5, ATG5)、微管相关蛋白轻链3(microtubule associated protein light chain 3, LC3)和Bcl-2同源结构域蛋白(Bcl-2 homologous domain protein, BECLIN1)[7]。
细胞自噬作为一种基本且相对保守的细胞分解代谢程序,在细胞生长过程中不断变化,参与细胞成份降解与再利用[7],同时参与机体众多发育和生理生物学事件,如细胞存活与死亡、新陈代谢和天然免疫等。自噬可维持细胞在不同应激条件下的存活,提高其对饥饿、低氧、生长信号阻断等应激的适应,降低应激条件下机体疾病发生率、缓解发育障碍[8-9]。哺乳动物卵母细胞成熟过程中细胞自噬可改变胞内线粒体分布和Ca2+含量,提高卵母细胞对氧化应激的适应能力,并通过恢复线粒体功能、降低卵母细胞凋亡相关蛋白酶延缓细胞凋亡启动[10]。牦牛作为长期生活在青藏高原地区的典型家畜,其生殖生理具备适应高寒、低氧等特性[11],分析牦牛卵泡发育和卵母细胞成熟过程中生殖激素调控细胞自噬对提升牦牛繁殖水平具有重要意义。
细胞色素P450芳香化酶(cytochrome P450arom, CYP19A1)作为大多数动物性腺激素合成关键酶[12],主要分布于动物性腺、肝、脂肪和脑等组织[13]。降低人和其他动物颗粒细胞CYP19A1表达水平,导致E2分泌减少[14-15],机体内CYP19A1表达量与类固醇类激素水平及生殖疾病紧密相关[15]。动物颗粒细胞中CYP19A1表达受其他激素影响,如促卵泡生成素(follicle-stimulating hormone, FSH)可调控CYP19A1转录诱导E2合成,同时促进颗粒细胞增殖[16]。本试验在牦牛卵母细胞体外成熟过程调控COCs中CYP19A1表达,分析其对内源性E2合成和细胞自噬的影响,并与外源性E2调控牦牛卵母细胞自噬与发育能力的效果进行比较,为进一步探索细胞色素酶介导生殖激素调控家畜卵母细胞发育的分子机制奠定基础。
1.1 主要材料
牦牛卵巢采自青海互助县牦牛屠宰场,M199家畜卵母细胞成熟培养液、E2、FSH与促黄体生成素(luteinizing hormone, LH)、胚胎培养用G1液均购自瑞典Vitrolife生物公司。透明质酸酶、去离子霉素、二甲基氨基嘌呤等孤雌激活胚胎生产试剂、CYP19A1一抗(SAB4500606)购自美国Sigma公司。微量细胞RNA提取试剂盒、两步法反转录试剂盒购自美国公司Omega生物公司,SYBR Green II荧光定量PCR试剂盒购自宝生物(大连)公司,牛E2ELISA检测试剂盒购自上海仁捷生物科技有限公司,细胞自噬相关因子一抗ATG5(bs-25013R)、BECLIN1 (bsm-33315M)、β-actin(bsm-33036M, 42 ku)购自北京博奥森生物技术有限公司、LC3(ab51520)抗体购自abcam生物公司,Western blot和免疫荧光技术检测用的二抗均购自北京博奥森生物技术有限公司,其中bs-0295D用于Western blot检测CYP19A1、ATG5、LC3,bs-0297R用于Western blot检测BECLIN1,bs-0295D-AF488用于免疫荧光检测CYP19A1、ATG5,bs-0297R-FITC用于免疫荧光检测BECLIN1,试验所用其他试剂均购买碧云天(南京)生物公司。
1.2 牦牛COCs采集与体外成熟培养
从屠宰牦牛体内立刻采集卵巢,用含有1%双抗(青链霉素)的生理盐水约30 ℃洗涤3次,置于32~35 ℃无菌保温壶,6 h内带回细胞实验室,用细胞培养箱内平衡的生理盐水洗涤卵巢3次,采用携带12~18 G针头注射器从直径为5~10 mm卵泡中抽吸牦牛卵丘卵母细胞复合体(cumulus-oocyte complexes, COCs),体视显微镜下挑选形态完整,至少包裹3层颗粒细胞的未成熟COCs(图1A)。用预热洗卵液(M199+5%血清)在显微镜下轻微吹打洗涤3次,置于4孔板(Nunclon,176740),每400 μL M199卵母细胞成熟培养液(M199基础液+5% FBS+50 μg·mL-1LH +100 μg·mL-1FSH 100 μg·mL-1链霉素+ 100 μg·mL-1青霉素)含50枚COCs,用200 μL矿物油覆盖,放入37.5 ℃,5% CO2细胞培养箱中培养24 h,收集成熟COCs。根据试验设计所需,参照团队前期研究成果和相关文献报道,在卵母细胞成熟培养液分别加入10-7mol·L-1E2[17]、10-6mol·L-1黄曲霉毒素B1(aflatoxin B1, AFB1)诱导CYP19A1表达[18]和10-5mol·L-1双酚A(bisphenol A, BPA)抑制CYP19A1表达[19],并设对照组(加入等体积生理盐水)。
培养24 h后,收集成熟COCs(图1B),每个处理组3个重复,每个重复300枚COCs,其中230枚用DPBS清洗3次后置于-70 ℃保存,用于后续CYP19A1和细胞自噬相关因子mRNA和蛋白Western blot检测,分别为30枚和200枚,20枚用DPBS清洗3次后置于免疫荧光固定液,用于后续CYP19A1和自噬相关蛋白免疫荧光检测。剩余COCs用DPBS清洗3次,每次5 min,用0.1%的透明质酸酶进行吹打清洗,直到完全去除卵丘细胞,获得裸卵,将其置入DPBS清洗3次,用吸卵针轻微吹打旋转卵母细胞,根据第一极体排出确定卵母细胞成熟(图1C),统计卵母细胞成熟率,并将成熟卵母细胞收集生产孤雌激活胚胎。
1.3 CYP19A1与细胞自噬相关因子mRNA和蛋白表达检测
1.3.1CYP19A1与细胞自噬相关因子mRNA表达检测 在不同处理组收集30枚牦牛COCs,DPBS清洗3次,参照微量细胞RNA提取试剂盒操作程序提取RNA,按照反转录试剂盒程序合成cDNA,实验室冷冻保存备用。根据GenBank储存的牛CYP19A1、ATG5、BECLIN1、LC3 mRNA序列,在保守区设计特异性引物,具体信息见表1。反应管中加入2.00 μL cDNA,正义链和反义链引物各0.50 μL,使其工作浓度为0.20 μmol·mL-1,qRT-PCR mix SYBR GreenⅡ(2×) 10 μL,最后加入7.00 μL灭菌水至终体积20.00 μL。采用Roche 480实时荧光定量RCR仪扩增检测不同处理组COCs中CYP19A1、ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ mRNA水平,条件为96 ℃预变性1 min,PCR反应循环数为38,包括变性(96 ℃, 20 s)、退火(59.5 ℃, 15 s)、延伸(72 ℃, 20 s),β-actin作为内参基因,等体积生理盐水处理组为对照组,不同处理组mRNA水平采用相对模板量算法分析,用2-ΔΔct表示[20]。

表1 Real-time PCR所用引物信息表
1.3.2 CYP19A1与细胞自噬相关因子蛋白表达Western blot检测 参照英文特(SD-001)动物细胞蛋白提取试剂盒,从每个处理组中选取200枚牦牛COCs提取总蛋白,100 ℃水浴10 min进行蛋白SDS变性,等量上样至10%凝胶,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamidegel electrophoresis,SDS-PAGE)分离蛋白。220 mA冰浴电转1 h,将目标蛋白转移至0.45 μm聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),5%脱脂奶粉溶解于TBST溶液常温封闭2 h,CYP19A1、ATG5、BECLIN1、LC3蛋白一抗4 ℃孵育至少10 h,TBST溶液清洗3次,每次10 min,生物素标记的二抗37 ℃孵育1 h,TBST溶液清洗5次,每次5 min,采用ECL试剂发光显色,用化学发光仪进行拍照。通过灰度值分析,以β-actin蛋白作为参照,采用相对定量方法比较不同处理组CYP19A1、ATG5、BECLIN1、LC3蛋白表达水平。
1.3.3 CYP19A1与细胞自噬相关因子蛋白表达免疫荧光技术检测 每个处理组选取40枚COCs,DPBS清洗3次,每次5 min,用免疫染色液进行固定,4 ℃保存备用。挑选15枚用于CYP19A1与细胞自噬相关因子蛋白表达定位检测,因LC3含有两个亚型,无法用免疫荧光抗体进行区分,细胞自噬相关因子只检测ATG5、BECLIN1蛋白荧光。从固定液取出,DPBS清洗3次,每次5 min,用含有0.25% TritonX-100封闭液室温作用1 h,进行透化、封闭,DPBS清洗3次,每次5 min,加入一抗室温孵育2 h,DPBS清洗3次,每次5 min,加入对应的荧光二抗室温孵育1 h,DPBS清洗3次,加入2.5 ng·mL-1DAPI 避光室温孵育3~5 min,清洗3次,每次5 min,将染色COCs转移至载玻片,加入5 μL DPBS,盖玻片封片,其中COCs中CYP19A1蛋白荧光单独检测,ATG5、BECLIN1蛋白荧光进行双染检测。荧光显微镜检测不同处理组COCs中CYP19A1、ATG5、BECLIN1蛋白荧光。
1.4 AFB1和BPA影响COCs分泌E2的检测
牦牛COCs成熟培养24 h后,收集不同处理组M199培养液,10倍稀释后置于-20 ℃冷冻保存,用于E2检测。参照试剂盒说明采用酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)检测E2浓度,标准品分别为0、7.5、15、30、60、120 pg·mL-1,检测灵敏度小于1.0 pg·mL-1。
1.5 孤雌激活胚胎发育能力统计
统计不同处理组卵母细胞成熟率后,将成熟裸卵置入含有5 μmol·L-1(Micromolar)去离子霉素的mSOF液,在细胞培养箱避光作用5~10 min,用mSOF液于37 ℃吹打清洗3次,每次不少于5 min,然后将其放入含有2 mmol·L-1二甲基氨基嘌呤mSOF液内,置入细胞培养箱,37 ℃、5% CO2、饱和湿度条件下培养5 h,用预热DPBS清洗3次,每次5 min,再转移至G1胚胎培养液,清洗3次,每次1 min,然后转移到预平衡的G1微滴培养液,每个微滴100 μL含有20枚胚胎,用矿物油覆盖置入38 ℃、饱和湿度、5.5% CO2条件培养,分别在48 和192 h观察卵裂胚胎(图1D)和囊胚数量(图1E),以成熟卵母细胞数为基数统计卵裂率,以卵裂胚胎数为基数统计囊胚率。
1.6 数据统计分析
数据分析软件为SPSS16.0,进行单因素方差试验数据分析,每个处理设计3个重复。P<0.05 表示差异具有显著性,所有数据以重复组之间“平均值±标准差(Mean±SD)”表示。
2.1 外源E2、AFB1和BPA调控COCs中CYP19A1表达
收集不同处理组牦牛COCs,qRT-PCR检测CYP19A1 mRNA相对表达水平,结果如图2A所示,在AFB1处理组,CYP19A1 mRNA表达水平显著增加(P<0.05),为对照组的(10.45±0.39)倍,在10-7mol·L-1E2和BPA处理组CYP19A1 mRNA表达水平显著降低(P<0.05),分别为对照组的(0.56±0.42)倍和(0.32±0.06)倍。
Western blot检测不同处理组CYP19A1蛋白表达水平结果如图2B所示,根据灰度值分析不同处理组蛋白相对表达水平如图2C所示,AFB1处理组CYP19A1蛋白水平显著高于对照组(P<0.05),为对照组的(8.23±0.68)倍,10-7mol·L-1E2和BPA处理组CYP19A1蛋白表达水平显著降低(P<0.05),分别为对照组的(0.42±0.08)和(0.39±0.06)倍。
不同处理组COCs中CYP19A1蛋白免疫荧光检测结果如图3所示,对照组COCs中卵丘细胞和卵母细胞均可检测到CYP19A1蛋白荧光。AFB1处理组CYP19A1蛋白荧光在卵丘细胞和卵母细胞强度高于对照组和其他处理组。10-7mol·L-1E2处理组卵丘细胞和卵母细胞中CYP19A1蛋白荧光强度低于对照组和AFB1处理组,BPA处理组中仅可在扩散卵丘细胞和卵母细胞局部位置检测到微弱CYP19A1蛋白荧光。

A. CYP19A1 mRNA相对表达水平;
B. CYP19A1 蛋白表达检测;
C. CYP19A1蛋白相对表达水平。柱上不同字母表示差异显著(P < 0.05),下同A. Relative levels of CYP19A1 mRNA; B. The detection of CYP19A1 protein; C. Relative levels of CYP19A1 protein. Bars with different superscripts are significantly different (P<0.05), the same as below图2 不同处理组牦牛成熟COCs中CYP19A1表达的检测Fig.2 Detection for CYP19A1 in yak mature COCs from different groups
2.2 AFB1和BPA对COCs成熟过程中E2合成的影响
为确定AFB1和BPA在上调或下调CYP19A1时对E2合成的影响,采用ELISA技术检测比较AFB1和BPA处理组与对照组E2的表达水平与变化,结果如图4所示,与对照组中E2含量(334.27±12.90) pg·mL-1相比,AFB1处理组E2含量显著增加(P<0.05),为(426.54±14.26) pg·mL-1,BPA处理组E2水平显著下降(P<0.05),为(214.52±10.68) pg·mL-1。
2.3 外源E2和CYP19A1调控影响细胞自噬相关因子表达
qRT-PCR检测不同处理组细胞自噬相关因子ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ mRNA水平结果如图5A所示,在10-7mol·L-1E2和AFB1处理组,ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ mRNA表达水平均显著增加(P<0.05),其中LC3-Ⅰ在10-7mol·L-1E2处理组表达水平最高,与AFB1处理组差异显著(P<0.05)。LC3-Ⅱ在AFB1处理组最高,与对照组差异显著。ATG5、BECLIN1 mRNA水平在10-7mol·L-1E2和AFB1处理组差异均不显著(P>0.05),增加幅度也低于LC3-Ⅰ、LC3-Ⅱ幅度。与对照组相比,BPA处理组ATG5、BECLIN1、LC3-Ⅰ mRNA表达水平均显著下降(P<0.05),而LC3-Ⅱ mRNA表达水平与对照组差异不显著(P>0.05)。
不同处理组细胞自噬相关因子ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ蛋白表达相对水平如图5B、5C所示,ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ蛋白相对水平均显著增加(P<0.05),其中LC3-Ⅱ和ATG5在10-7mol·L-1E2处理组表达水平最高,与AFB1处理组差异显著(P<0.05),LC3-Ⅰ和BECLIN1在两组差异不显著(P>0.05)。BPA处理组ATG5、LC3-Ⅰ和LC3-Ⅱ蛋白水平均显著下降(P<0.05),而BECLIN1表达水平与对照组差异不显著(P>0.05)。比较不同处理组LC3-Ⅱ与LC3-Ⅰ比率相对量,结果如图6所示,其在10-7mol·L-1E2和AFB1处理组显著上升(P<0.05),其中10-7mol·L-1E2最高,为对照组的(2.02±0.32)倍,AFB1处理组为对照组(1.96±0.15)倍。BPA处理组LC3-Ⅱ与LC3-Ⅰ的比率相对量显著降低(P<0.05),为对照组的(0.82±0.25)倍。

A. 对照组COCs中CYP19A1蛋白检测; B. AFB1处理组中COCs中CYP19A1蛋白检测;
C. 10-7mol·L-1 E2处理组COCs中CYP19A1蛋白检测; D. BPA处理组中COCs中CYP19A1蛋白检测。标尺=100 μmA. Fluorescence of CYP19A1 in COCs from control group; B. Fluorescence of CYP191 in COCs from AFB1 group; C. Fluorescence of CYP19A1 in COCs from 10-7 mol·L-1 E2 group; D. Fluorescence of CYP19A1 in COCs from BPA group. Bar=100 μm图3 不同处理组牦牛成熟COCs中CYP19A1蛋白免疫荧光标记Fig.3 Staining of CYP19A1 protien in yak mature COCs from different groups
免疫荧光技术检测不同处理组COCs细胞自噬相关因子ATG5、BECLIN1蛋白如图7所示,对照组COCs中卵母细胞和周围卵丘细胞均可观察到ATG5蛋白荧光,BECLIN1仅在扩散卵丘细胞和局部卵母细胞弱表达。10-7mol·L-1E2和AFB1处理组ATG5和BECLIN1蛋白荧光强度显著增强,卵母细胞和扩散卵丘细胞均可检测到ATG5和BECLIN1蛋白,BECLIN1在10-7mol·L-1E2处理组荧光分布更广,强度高于AFB1处理组。BPA处理组仅可检测到微弱ATG5和BECLIN1蛋白荧光,且卵丘细胞未发生充分扩散。

图4 不同处理组E2的表达水平Fig.4 Levels of E2 in different groups
2.4 外源E2和CYP19A1调控影响牦牛卵母细胞发育能力
统计不同处理组牦牛卵母细胞成熟率、孤雌激活胚胎卵裂率和囊胚率,结果如表2所示,10-7mol·L-1E2和AFB1处理组卵母细胞成熟率和胚胎卵裂率显著高于对照组(P<0.05),其中10-7mol·L-1E2和AFB1处理组卵母细胞成熟率差异显著(P<0.05),以成熟卵母细胞为基数,10-7mol·L-1E2和AFB1处理组胚胎卵裂率差异不显著(P>0.05)。BPA处理组中,卵母细胞成熟率、卵裂率与对照组相比,显著降低(P<0.05)。以卵裂胚胎为基数统计囊胚率,结果显示4个处理组囊胚率差异不显著(P>0.05)。

A. ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ mRNA相对表达水平;
B. ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ蛋白表达检测;
C. ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ蛋白相对表达水平A. Relative levels of ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ mRNA; B. The detection of ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ protein; C. Relative levels of ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ protein图5 不同处理组牦牛成熟COCs中ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ 表达的检测Fig.5 Detection for ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ in yak mature COCs from different groups
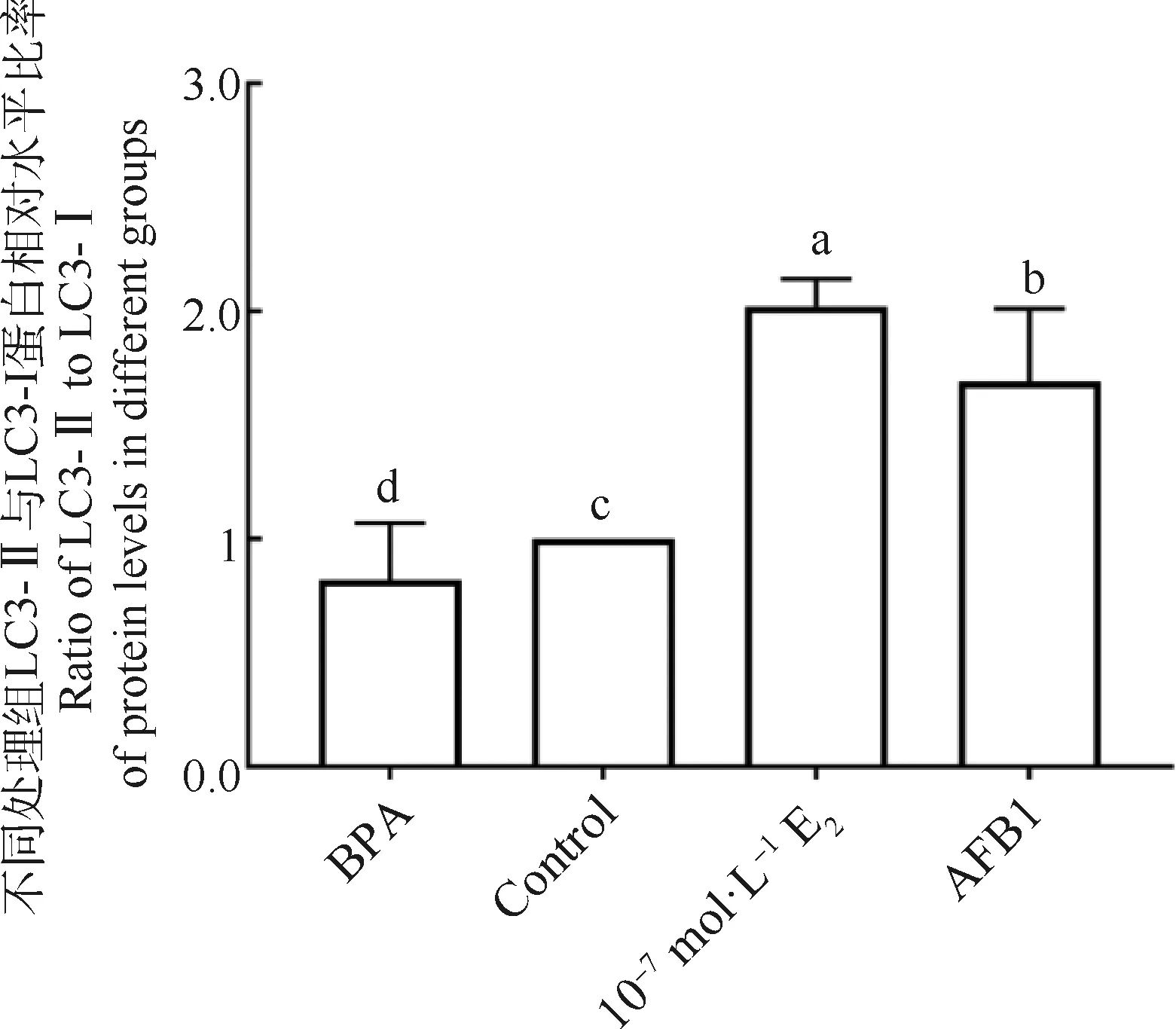
图6 不同处理组LC3-Ⅱ与LC3-Ⅰ比率的变化Fig.6 Changes of ratio of LC3-Ⅱ to LC3-Ⅰ in different groups
细胞色素家族成员参与动物下丘脑-垂体-性腺轴调控[21-22],CYP19A1作为细胞色素家族核心成员,牛颗粒细胞中miR-326和CYP19A1的表达水平呈负相关,调控miR-326可通过环腺苷酸反应元件结合蛋白(cAMP-response element binding protein, CREB)下调CYP19A1转录,导致靶细胞E2分泌减少[13-14]。除CYP19A1对激素调控外,卵巢中激素水平在一定程度也可以影响CYP19A1表达,如FSH可激活CYP19A1基因启动子而改变其表达水平,诱导E2合成,进而影响卵丘细胞质量[16]。本研究参照前人研究成果,在牦牛COCs成熟过程中加入AFB1或BPA[18-19]均可调控CYP19A1表达,证实AFB1或BPA在生殖细胞作用效果与人绒毛膜癌细胞作用效果具有相似性,并影响生殖细胞E2合成,造成卵母细胞成熟率和早期胚胎发育能力发生改变。牦牛COCs成熟过程中加入10-7mol·L-1外源E2,CYP19A1表达水平下降,证实高浓度外源E2负反馈调节CYP19A1表达,表明动物卵母细胞成熟过程中CYP19A1与E2之间存在相互调控关系。

A. 对照组COCs中ATG5、BECLIN1蛋白检测; B. 10-7mol·L-1 E2处理组COCs中ATG5、BECLIN1蛋白检测; C. AFB1处理组中COCs中ATG5、BECLIN1蛋白检测;
D. BPA处理组中COCs中ATG5、BECLIN1蛋白检测。标尺=100 μmA. Fluorescence of ATG5、BECLIN1 in COCs from control group; B. Fluorescence of ATG5、BECLIN1 in COCs from 10-7mol·L-1 E2 group; C. Fluorescence of ATG5、BECLIN1 in COCs from AFB1 group; D. Fluorescence of ATG5、BECLIN1 in COCs from BPA group. Bar=100 μm图7 不同处理组牦牛成熟COCs中ATG5和BECLIN1蛋白免疫荧光标记Fig.7 Immunofluorescence staining of ATG5 and BECLIN1 protein in yak mature COCs from different groups
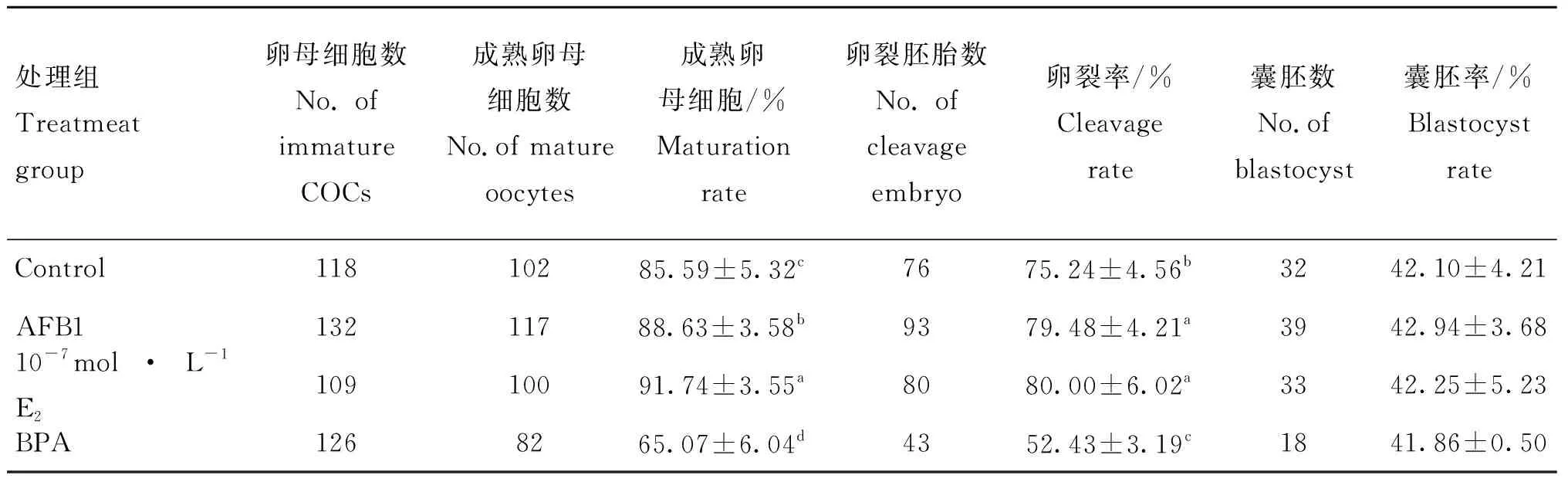
表2 不同处理组卵母细胞成熟率与胚胎发育能力统计
为模拟牦牛COCs体内生长条件,研究中并未采用基因干扰技术精确调控卵丘细胞CYP19A1表达,而利用安全生理浓度AFB1或BPA改变牦牛COCs中CYP19A1表达,在有效避免AFB1或BPA细胞毒性效应的基础上,探索其对卵母细胞成熟的影响。相关研究证实在体细胞中,BPA除调控CYP19A1外,还可调控CYP1A1表达[19],表明AFB1和BPA对细胞色素酶家族成员的调控具有多样性和复杂性,提示后续建立卵丘-卵母细胞共培养体系实现CYP19A1基因精确调控技术,对于探索CYP19A1调控COCs发育分子机制至关重要。除CYP19A1外,CYP2C8、CYP17A1、CYP11A1也参与动物生理调控,且多数参与细胞自噬调控[23-25],而其是否参与牦牛生殖调控仍需结合牦牛自身生殖特性进一步探索。
E2作为内源性激素可调控多种动物卵母细胞成熟和卵泡发育等生物学事件,如E2刺激猪卵母细胞成熟过程中Ca2+离子释放[26],维持动物COCs活力,促进卵子发育[27-28]。团队前期研究发现,10-7mol·L-1E2调控牦牛卵母细胞成熟过程中卵丘扩散相关因子前列腺素内过氧化物合酶2 (prostaglandin endoperoxide synthase 2, PTGS2)、透明质酸合成酶2(hyaluronan synthase 2, HAS2)、肿瘤坏死因子α诱导蛋白6(tumour necrosis factor alpha-induced protein 6, TNFAIP6)表达,利于卵丘细胞扩散[29]。本研究用外源性E2作用牦牛COCs,在证实其可调控卵母细胞自噬水平,并影响其早期发育能力的基础上,发现CYP19A1调控的内源性E2也具有相似生物学功能,如BPA抑制CYP19A1表达下调内源性E2合成(图4),进而影响卵丘细胞扩散程度(图7),进一步表明E2促进动物卵丘细胞扩散的生理功能。猪卵母细胞体外成熟过程中高浓度外源E2降低卵母细胞成熟率,但可抑制细胞凋亡水平[26],表明E2生理功能具有物种差异性。除此之外,卵母细胞成熟过程中E2分子机制存在复杂性,如本研究证实外源性和内源性E2均可调控牦牛卵母细胞自噬,该发现与相关研究证实E2可激活其受体ESR调控细胞自噬具有相似性[26]。E2调控自噬的效果受低氧、温度应激等因素影响,如温度应激时,热休克蛋白(heat shock proteins, HSPs)作为分子伴侣导致ESRs构象改变,影响自噬相关基因表达[26],提高卵母细胞对热休克等生理应激的适应性[26],使家畜性腺细胞中其他激素合成发生改变[30-31]。
虽然不同物种间生殖激素调节自噬机制不同,但启动细胞自噬调节因子存在相似性[32-33]。本研究通过改变CYP19A1水平,影响了E2合成,或加入外源性E2,发现采用两种不同方法调控E2水平均可改变自噬相关因子ATG5、BECLIN1、LC3表达(图5)。ATG5、BECLIN1、LC3表达水平在促进内源E2表达和加入外源E2的两个处理组之间存在差异,抑制内源E2,ATG5、BECLIN1、LC3-Ⅰ、LC3-Ⅱ 降低幅度也存在差异,表明内源E2和外源E2调控细胞自噬的分子机制及其主要作用靶标基因存在一定差异。细胞或机体内LC3-II/LC3-I比率差异提示LC3核心因子转化发生改变,且LC3-II水平与自噬小体的数量相关[34-36]。本研究中加入外源E2和促进内源E2表达均可提高LC3-II/LC3-I比率相对水平,抑制内源E2降低两者比率相对水平,提示LC3在E2调控哺乳动物卵母细胞自噬中的生物学作用不能忽视。
为探索COCs成熟过程中调控CYP19A1对牦牛卵母细胞发育能力影响,研究分别以未成熟卵母细胞数量、成熟卵母细胞数量和卵裂胚胎为基数比较各处理组成熟率、卵裂率和囊胚率差异,发现CYP19A1主要影响早期卵母细胞成熟和胚胎卵裂,在卵裂胚胎发育至囊胚阶段影响并不显著,而胚胎早期发育卵裂之前主要生物事件为胚源基因激活[37-38],可见CYP19A调控雌激素合成主要影响卵母细胞的早期发育能力。猪早期胚胎发育研究表明,氧化应激诱导卵母细胞自噬可改变囊胚细胞凋亡水平,并通过细胞命运改变囊胚细胞数、ICM和TE分布,影响囊胚质量[39]。因此,后续仍需通过检测囊胚相关分子变化,从囊胚质量、胚胎附植潜能、细胞分化等角度深入探索CYP19A1促进E2调控细胞自噬,影响卵母细胞后续发育能力的分子机制。
牦牛长期生活在高原环境,为季节性发情家畜,其生殖能力相对同种属其他家畜处于较低水平[40-41]。改善牦牛繁殖调控技术已成为牦牛高效繁育的核心问题,而提高生殖激素的作用效果对牦牛繁殖调控技术的提升至关重要。本研究发现利用小分子药物调控CYP19A1水平影响牦牛COCs激素合成,进一步影响卵母细胞成熟和胚源基因激活前的发育潜能,揭示牦牛繁殖调控过程中CYP19A1可作为标靶分子改善生殖激素作用效果,提示筛选相关药物或靶标信号分子调控CYP19A1表达水平,有助于协同生殖激素调控牦牛繁殖状态,促进牦牛辅助繁殖技术发展。
牦牛COCs成熟过程中CYP19A1上调内源性E2水平,其上调的E2与外源性E2生理功能具有相似性,均可诱导细胞自噬发生,提升早期卵母细胞的发育能力。研究结果为深入探索生殖激素调控哺乳动物卵母细胞成熟的分子机制提供了理论依据。
猜你喜欢 卵母细胞牦牛胚胎 牦牛场的雪组诗滇池(2022年5期)2022-04-30外源褪黑素对猪卵母细胞体外成熟及多精受精的影响中国畜牧杂志(2022年4期)2022-04-15YAK OF ALL TRADES TEXT AND PHOTOGRAPHY BY汉语世界(2022年1期)2022-03-01美仁大草原的牦牛(外一章)散文诗(2021年22期)2022-01-12cAMP 调节剂对卵母细胞体外成熟效果的调节机制研究进展中国畜牧杂志(2021年5期)2021-12-05纷纭旋转之间:新兴技术回应型立法的舆论引导——以胚胎嵌合体为例科学与社会(2021年3期)2021-12-02Nurr1基因修饰胚胎中脑神经干细胞移植治疗帕金森病昆明医科大学学报(2021年8期)2021-08-13跟着牦牛去巡山小哥白尼(野生动物)(2020年9期)2021-01-18植入前胚胎研究取得新进展中国生殖健康(2020年7期)2021-01-18母亲肥胖竟然能导致胚胎缺陷中国生殖健康(2020年5期)2021-01-18推荐访问:雌激素 牦牛 发育