乙酸钠对油酸诱导的BRL-3A细胞脂肪变性的影响及机制分析
来源:优秀文章 发布时间:2023-01-23 点击:
李 林,宫彬彬,王广力,赵 梅,张源淑
(1.邢台学院生物科学与工程学院,邢台 054001;
2.河北医科大学附属邢台人民医院病理科,邢台 054031;
3. 南京农业大学动物医学院农业部动物生理生化重点开放实验室,南京 210095)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种以三酰甘油(triglyceride,TG)在肝蓄积为特征的疾病,近年来,由于脂肪和高糖等摄入增加、激素食品泛滥等因素,使NAFLD发病率逐年增高。NAFLD在鸡、狗、猪、牛、羊以及鱼等动物也可发生,是各种动物的原发或者继发性疾病,在鸡、鸭的发病率较高,该病不仅影响着养殖业的发展,也会带来一定的食品安全问题,给禽类养殖业造成严重的经济损失[1]。近年来,NAFLD越来越受到关注,因其发病机制复杂、诊断困难,已成为世界上最常见的慢性肝病。NAFLD通常与高血压、血脂异常、肥胖、胰岛素抵抗、代谢综合征、2型糖尿病和心血管疾病密切相关[2]。目前,NAFLD没有有效的治疗方案,主要以改变动物的饮食方式为主。
乙酸是一种短链脂肪酸(SCFA),它是由摄入的膳食纤维刺激,经动物盲肠和结肠发酵产生[3-4]。据报道,膳食纤维可以降低餐后血糖反应、血浆胆固醇和三酰甘油浓度以及脂肪储存[5]。并且,Hara等[6]研究发现含有SCFA的无纤维饮食也能降低血清胆固醇。乙酸除了由结肠细菌发酵产生外,许多食物中均含有乙酸的成分。
肝是动物调节脂质代谢和维持脂质稳态的重要器官,通过肝切片发现,肝含有多种细胞类型,如肝细胞、库普弗细胞、内皮细胞和成纤维细胞[7]。研究表明,乙酸可以使小鼠肝TG含量降低,脂质氧化基因表达增加[8]。此外,乙酸可激活糖尿病KK-A(y)小鼠肝腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)蛋白,而AMPK作为能量的“传感器”和“调节器”,对肝的脂质代谢的调节具有重要作用[9]。目前,乙酸在调控肝代谢方面的研究较少,且不深入。因此,本试验通过油酸诱导BRL-3A细胞建立脂肪变性模型,分析乙酸钠是否对BRL-3A细胞脂肪变性模型具有调控作用,为乙酸钠对动物摄食调控及改善肥胖、健康方面的研究提供理论依据。
1.1 细胞来源
大鼠肝成纤维细胞(BRL-3A)购自中国科学院昆明细胞库,本实验室冻存。
1.2 主要试剂
乙酸钠、油酸购自美国Sigma公司;
TG试剂盒、油红O染色试剂盒、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶试剂盒均购自南京建成生物技术有限公司;
P-AMPK-兔/AMPK-兔抗体均购自艾博抗上海贸易有限公司;
山羊抗兔IgG购自上海生物工程有限公司;
BCA蛋白定量试剂盒购自上海碧云天生物技术公司;
DMEM培养基、胎牛血清和青霉素/链霉素购自南京泽优生物科技有限公司。
1.3 BRL-3A细胞脂肪变性模型建立
1.3.1 BRL-3A细胞的培养与处理 BRL-3A细胞在DMEM高糖培养基中进行培养,内含10%胎牛血清、100 U·mL-1青霉素/链霉素,置于含5% CO2的恒温培养箱(37 ℃)中培养,根据细胞生长状态,及时更换新鲜培养基,每隔2~3 d将细胞重新传代1次。当细胞融合度达到80%~90%时,贴壁细胞用含0.25%胰酶和0.02% EDTA胰酶消化液进行消化处理,将细胞接种于6孔板和96孔板中,加入新鲜培养基,置于恒温培养箱中培养。
1.3.2 不同浓度油酸处理BRL-3A细胞相对活力检测 接种于96孔板内的BRL-3A细胞融合度达到70%~80%时,弃去培养液。PBS洗涤后,分别加入含有不同浓度油酸(0.03、0.06、0.12、0.24、0.48 mmol·L-1)的无血清培养基;
在5% CO2的恒温培养箱(37 ℃)中培养24 h。随后每孔细胞加入含0.5 mg·mL-1MTT的无胎牛血清培养液20 μL,继续培养4 h 后,弃上清液,再加入150 μL DMSO 充分溶解,用酶标仪检测各孔的吸光值,检测其细胞相对活力。
1.3.3 不同浓度油酸处理BRL-3A细胞总脂滴面积、TG、AST和ALT指标检测 将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理后,加入含有不同浓度油酸(0.03、0.06、0.12、0.24 mmol·L-1)的无血清培养基,在37 ℃、5% CO2条件下培养24 h后,PBS冲洗3遍,10%福尔马林将细胞固定30 min,室温条件下,PBS冲洗3遍,用油红O染液染色10 min,PBS缓冲液洗2次;
倒置显微镜观察细胞内脂滴染色情况,并进行统计分析。另外,在37 ℃、5% CO2条件下培养24 h后收集细胞,弃上清进行TG含量、AST和ALT活性检测。
1.4 不同浓度乙酸钠处理BRL-3A细胞凋亡率指标检测
将细胞培养于6孔板中,当细胞融合度达到80%~90%时,用低(2 mmol·L-1)、中(4 mmol·L-1)、高(8 mmol·L-1)浓度的乙酸钠处理细胞24 h。收集细胞后加入200 μL的Annexin V-异硫氰酸荧光素(FITC)原液重悬细胞,4 ℃避光孵育30 min,再加入10 μL碘化丙啶(PI),避光孵育15 min,采用美国BD FACS Calibur型流式细胞术检测荧光强度,计算细胞凋亡率。
1.5 乙酸钠对油酸诱导的BRL-3A细胞脂肪变性模型的影响
1.5.1 不同浓度乙酸钠处理脂肪变性细胞模型胞内脂滴变化检测 将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理后,将细胞分为油酸处理组(加入含有终浓度为0.12 mmol·L-1油酸的无血清培养基),2 mmol·L-1乙酸钠+油酸处理组,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组。在2 mmol·L-1乙酸钠+油酸处理组、4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组中,均为2 h后加入乙酸钠。在37 ℃、5% CO2条件下培养24 h后, PBS冲洗3遍,10%福尔马林将细胞固定30 min,室温条件下,PBS冲洗3遍,用油红O染液染色10 min,PBS缓冲液洗2次;
倒置显微镜观察细胞内脂滴染色情况,并进行统计分析。
1.5.2 不同浓度乙酸钠处理脂肪变性细胞模型TG、AST和ALT指标检测 接种于6孔板的细胞经过上述同样处理后,在37 ℃、5% CO2条件下培养24 h后,收集细胞,弃上清,进行TG含量、AST和ALT活性检测,操作步骤按照说明书进行。提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定并计算出蛋白浓度。
1.5.3 不同浓度乙酸钠处理脂肪变性细胞模型AMPK通路蛋白检测 Western blot检测各处理细胞中P-AMPK/AMPK蛋白的表达变化,参照李林等[10]的方法进行操作。用ECL发光液进行Western blot图像处理。用Image Lab 6.0分析条带灰度值。
1.5.4 不同浓度乙酸钠处理脂肪变性细胞模型脂代谢相关关键基因检测 将收集的细胞采用TRIzol法直接提取总RNA,利用BioPhotometer测定样品总RNA浓度,分析OD260 nm/OD280 nm值,判断提取总RNA的纯度,OD260 nm/OD280 nm需要为1.8~2.0。取1 μg总RNA进行反转录得到cDNA,详细操作步骤参照说明书进行。
参照GenBank序列,用Primer Premier 5软件自行设计,设计完成后送上海Sangon公司合成,引物序列见表1。

表1 目的基因及β-Actin引物序列
1.6 数据统计与分析
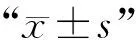
2.1 不同浓度油酸对BRL-3A细胞相对活力的影响
图1所示,向细胞中添加不同浓度(0.03、0.06、0.12、0.24、0.48 mmol·L-1)的油酸后,发现与对照组(0 mmol·L-1油酸)相比,0.48 mmol·L-1油酸对细胞有明显的抑制作用,且差异显著(P<0.05)。其他浓度的油酸处理细胞后与对照组相比,均无差异。结果提示:0.03~0.24 mmol·L-1的油酸对BRL-3A细胞无毒副作用。
2.2 不同浓度油酸对BRL-3A细胞总脂滴的影响
图2所示,与对照组相比,0.12和0.24 mmol·L-1油酸处理后细胞总脂滴面积均极显著上升(P<0.01)。
2.3 不同浓度油酸对BRL-3A细胞三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)的影响
表2所示,向细胞中添加不同浓度(0.03、0.06、0.12、0.24 mmol·L-1)的油酸。发现与对照组相比,0.06 mmol·L-1油酸处理后,TG含量显著上升(P<0.05);
并且在0.12和0.24 mmol·L-1油酸处理后,TG含量极显著上升(P<0.01),提示造成了BRL-3A细胞的脂质蓄积。与对照组相比,0.12和0.24 mmol·L-1油酸处理后,BRL-3A细胞AST和ALT活性显著上升(P<0.05);
其他浓度的油酸处理细胞后,AST和ALT活性均无显著差异。
综合以上细胞活力、细胞总脂滴面积、TG含量和AST、ALT活性测定结果,本试验用不同浓度油酸诱导建立BRL-3A细胞体外脂肪变性模型的条件: 0.12 mmol·L-1油酸,培养时间为24 h。因此,后续选取0.12 mmol·L-1油酸进行诱导脂肪变性细胞模型处理试验。

与对照组(0 mmol·L-1)相比,*. P<0.05Compared with control group(0 mmol·L-1),*. P<0.05图1 油酸对BRL-3A细胞相对活力分析Fig.1 Analysis of the relative activity of oleic acid on BRL-3A cells

与对照组相比,**表示差异极显著(P<0.01)Compared with control group,**.P<0.01图2 油酸处理BRL-3A细胞总脂滴面积结果分析Fig.2 Analysis of total lipid droplet area of BRL-3A cells treated with oleic acid

表2 油酸对BRL-3A细胞三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)的影响分析
2.4 不同浓度乙酸钠对脂肪变性细胞模型总凋亡率的影响
分别用低(2 mmol·L-1)、中(4 mmol·L-1)、高(8 mmol·L-1)浓度的乙酸钠作用BRL-3A细胞24 h后,通过流式细胞术检测细胞凋亡率,发现不同浓度的乙酸钠对细胞凋亡率均无影响(图3),证明乙酸钠对细胞无毒害作用,可以进行下一步试验。

图3 乙酸钠对BRL-3A细胞总凋亡率分析Fig.3 Analysis of sodium acetate on total apoptosis rate of BRL-3A cells
2.5 不同浓度乙酸钠对脂肪变性细胞模型脂滴的影响
图4所示,用0.12 mmol·L-1油酸分别和2、4、8 mmol·L-1的乙酸钠共同孵育细胞24 h后,与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1+油酸处理组细胞总脂滴面积和每平方毫米脂滴数极显著下降(P<0.01)。提示,4和8 mmol·L-1的乙酸钠可以显著降低脂肪变性细胞模型的脂质堆积。
与油酸处理组相比,**. P<0.01Compared with oleic acid treatment group,**.P<0.01图4 乙酸钠对脂肪变性细胞模型脂滴影响分析Fig.4 Analysis of sodium acetate on lipid droplets in steatosis cell models
2.6 不同浓度乙酸钠对脂肪变性细胞模型三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)的影响
表3所示,向细胞中添加不同浓度的乙酸钠后,发现与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理后,TG含量、AST活性和ALT活性均显著下降(P<0.05);
并且在8 mmol·L-1乙酸钠+油酸处理后,与对照组相比,TG含量极显著下降(P<0.01),ALT、AST活性均显著下降(P<0.05)。

表3 乙酸钠对脂肪变性细胞模型三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)的影响分析
2.7 不同浓度乙酸钠对脂肪变性细胞模型AMPK信号蛋白的影响
进一步检测细胞AMPK相关信号通路,结果发现(图5),与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组P-AMPK表达水平显著上调(P<0.05);
8 mmol·L-1乙酸钠+油酸处理组P-AMPK表达水平极显著上调(P<0.01)。提示,乙酸钠激活了脂肪变性细胞模型的AMPK信号通路。
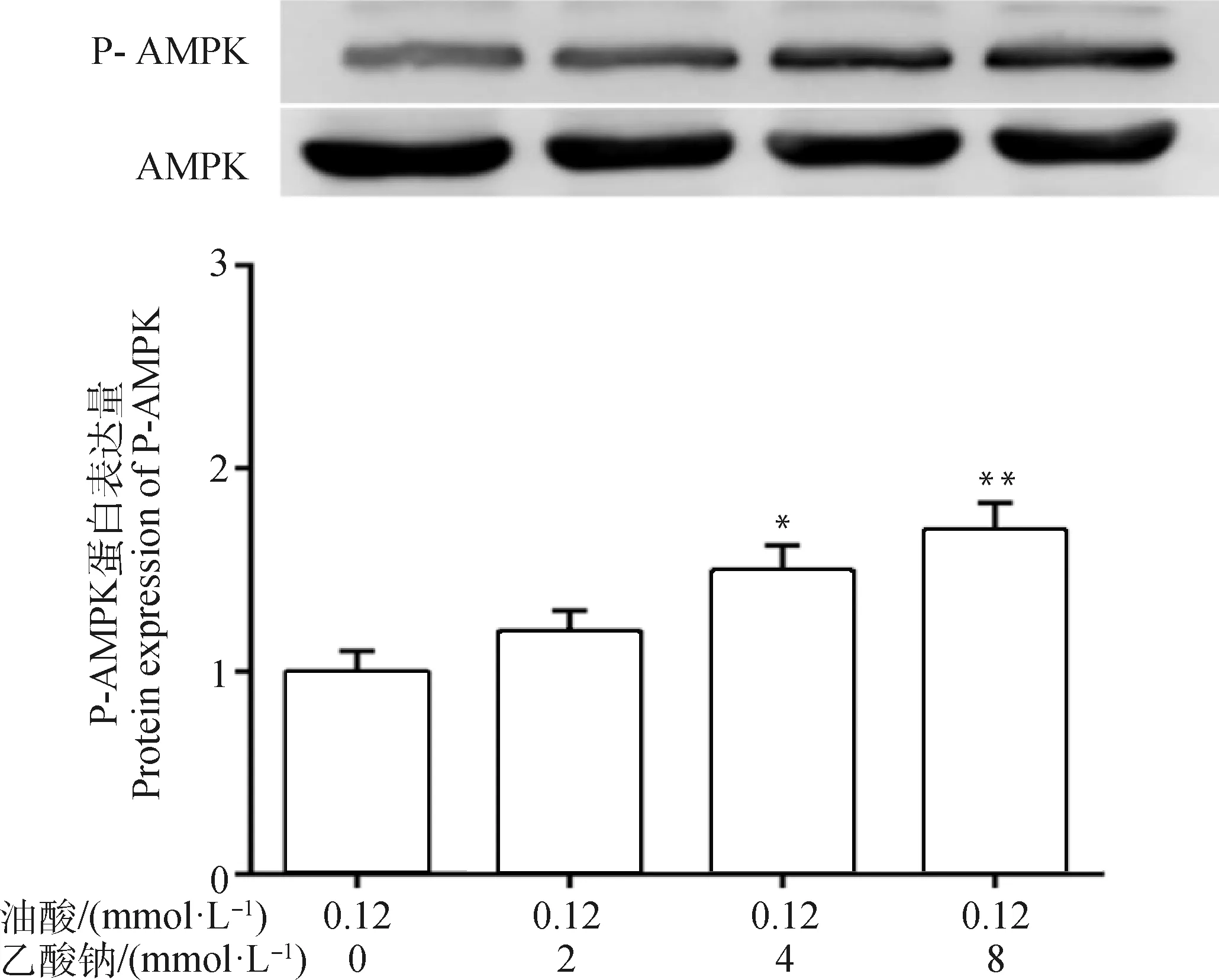
与油酸处理组相比,*.P<0.05, **.P<0.01Compared with oleic acid treatment group, *.P<0.05, **.P<0.01图5 脂肪变性细胞模型P-AMPK蛋白表达水平变化Fig.5 The P-AMPK protein expression level in steatosis cell models
2.8 不同浓度乙酸钠对脂肪变性细胞模型脂合成代谢关键基因的影响
通过检测与AMPK信号通路下游相关的关键脂合成代谢基因,图6A发现,与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组ACC mRNA表达含量均显著下降(P<0.05);
图6B发现,与油酸处理组相比,8 mmol·L-1乙酸钠+油酸处理组FAS mRNA表达含量显著下降(P<0.05),而其他乙酸钠+油酸处理组与油酸处理组相比,均无显著差异;
图6C发现与油酸处理组相比,2、4、8 mmol·L-1乙酸钠+油酸处理组SCD-1 mRNA表达含量均显著下降(P<0.05)。

与油酸处理组相比,*.P<0.05Compared with oleic acid treatment group,*.P<0.05图6 脂肪变性细胞模型脂合成代谢基因表达Fig.6 The expression levels of lipid anabolism genes in steatosis cell models
2.9 不同浓度乙酸钠对脂肪变性细胞模型脂分解代谢关键基因的影响
通过检测与AMPK信号通路下游相关的关键脂分解代谢基因,图7A发现与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组CPT-1 mRNA表达量均显著上升(P<0.05);
图7B发现,与油酸处理组相比,8 mmol·L-1乙酸钠+油酸处理组CPT-2 mRNA表达量显著上升(P<0.05);
而图7C发现,2、4、8 mmol·L-1乙酸钠+油酸处理组ACO mRNA表达量,与油酸处理组相比,均无显著差异。

与油酸处理组相比,*.P<0.05Compared with oleic acid treatment group,*.P<0.05图7 脂肪变性细胞模型脂分解代谢基因表达Fig.7 The expression levels of lipid catabolism genes in steatosis cell models
3.1 油酸诱导脂肪变性细胞模型的建立
脂肪肝的发生与动物肝脂质代谢的异常有关。NAFLD是一种以肝细胞内脂质过度积聚为特征的疾病。如果动物没有得到及时治疗,NAFLD就可能从单纯性肝脂肪变性发展为非酒精性脂肪性肝炎,或者发展为肝纤维化、肝硬化甚至肝细胞癌。动物超重、胰岛素抵抗、圈养、饮食模式改变、遗传因素以及肠道屏障功能的紊乱都有可能导致NAFLD[11]。
目前,脂肪肝动物模型的构建通常通过高脂、高糖、四环素等毒物或药物构建[12-13];
而体外脂肪变性模型的构建通常采用油酸、脂肪酸、棕榈酸等处理方法[14-15]。本试验首先用不同浓度的油酸诱导BRL-3A细胞,经细胞活力测定分析发现,向细胞中添加(0.03、0.06、0.12、0.24、0.48)mmol·L-1油酸后,与对照组相比,只有0.48 mmol·L-1油酸对细胞有明显的抑制作用,证明0.48 mmol·L-1油酸对BRL-3A细胞毒性较大,并且通过显微镜观察发现细胞出现受损死亡等情况,而其他浓度的油酸对BRL-3A细胞无毒副作用。通过油红O染色进一步检测细胞总脂滴面积,发现与对照组相比,0.12和0.24 mmol·L-1油酸处理后细胞总脂滴面积极显著上升。转氨酶是肝损伤的主要标志物,主要由AST和ALT组成。其中,AST主要分布于心肌、肝、肾等组织,而ALT则主要分布于肝组织中[16]。医学上当超过5%脂肪堆积在肝中时,就称为脂肪肝。本试验油酸浓度为0.06 mmol·L-1时,TG含量就增加了一倍;
并且在0.12和0.24 mmol·L-1油酸处理后,TG含量极显著上升,同时AST和ALT活性皆升高,提示肝细胞出现损伤。所以结合上述细胞总脂滴面积结果,当油酸浓度为0.12 mmol·L-1,刺激时间为24 h,即可成功构建脂肪变性细胞模型。
短链脂肪酸是肠道菌群膳食纤维的主要代谢产物。乙酸、丙酸和丁酸是人类肠道中最丰富的短链脂肪酸[17]。短链脂肪酸不仅是代谢底物,也是调节肝代谢的信号分子[18]。乙酸是动物机体内最主要的短链脂肪酸之一,占体循环内短链脂肪酸含量的一半以上。乙酸除了能作为能量底物和碳源参与机体内代谢活动外,还对机体脂肪代谢、食欲调节和胰岛素抵抗等方面具有重要作用[19-21]。白鸽等[22]研究发现,向牛肝细胞中添加乙酸钠,会加速肝脂肪酸的氧化。本试验通过流式细胞术检测细胞凋亡率,发现不同浓度的乙酸钠对正常的BRL-3A细胞凋亡率均无影响,证明乙酸钠对细胞无毒副作用,可用于后续研究。进一步用4和8 mmol·L-1乙酸钠处理脂肪变性细胞模型后,均使细胞总脂滴面积、每平方毫米脂滴数、TG含量下降,AST和ALT活性皆下调,这与前人的研究结果一致。提示乙酸钠可以显著降低脂肪变性细胞模型的脂质堆积,缓解肝细胞损伤,具体机制有待进一步研究证实。
肝是调节脂质代谢、维持脂质稳态的重要器官。AMPK是肝细胞中能量的“传感器”和“调节器”。AMPK可调控脂质代谢酶的表达来调节肝脂质代谢。因此,AMPK信号通路在肝脂质代谢中起中心作用[23]。研究表明,乙酸可激活AMPK,AMPK进而上调肝中脂质氧化基因的表达,减少脂肪堆积[9,24-25]。小鼠肝特异性AMPK缺失导致血浆TG含量和肝脂肪生成增加[26]。AMPK还可以通过调控骨骼肌中葡萄糖摄取和游离脂肪酸氧化,抑制肝中的糖异生、糖酵解、脂肪生成和胆固醇形成[27]。本试验发现,用不同浓度乙酸钠处理脂肪变性细胞模型后,4和8 mmol·L-1乙酸钠均可激活AMPK信号通路关键蛋白。
TG是细胞内和血浆中脂肪酸储存和运输的主要形式。肝是脂肪酸代谢的中心器官,肝细胞通过从血浆中摄取和从头生物合成的方式在肝中积累脂肪酸[28]。脂肪酸的从头合成主要受相关关键酶所调控,其中,乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)可以将乙酰辅酶A羧化生成丙二酰辅酶A[29];
脂肪酸合成酶(fatty acid synthetase,FAS)是催化脂肪酸从头生成的最后一步[30];
SCD-1是单不饱和脂肪酸合成的关键调控因子[31]。而脂肪酸的分解代谢受CPT-1、CPT-2等酶的调控,主要是将脂肪酸转运到线粒体进行氧化分解,这是脂肪酸在β-氧化过程中的限速步骤[32]。本研究发现,用不同浓度的乙酸钠处理脂肪变性细胞模型后,4和8 mmol·L-1乙酸钠均会导致细胞ACC mRNA表达量显著下降;
8 mmol·L-1乙酸钠会导致FAS mRNA表达量显著下降;
而2、4、8 mmol·L-1乙酸钠均可使SCD-1 mRNA表达量显著下降。4和8 mmol·L-1乙酸钠会导致与脂肪酸分解代谢的相关酶CPT-1 mRNA表达量显著上调;
而8 mmol·L-1乙酸钠会导致CPT-2 mRNA表达量显著上调。提示,乙酸钠主要通过CPT-1促进了脂肪变性细胞模型胞液中脂肪酸转运到线粒体进行氧化分解,并且通过SCD-1进一步抑制了饱和脂肪酸催化合成单不饱和脂肪酸,进而降低了细胞中脂质的含量。以上结果表明,乙酸钠可通过AMPK信号通路调控脂肪变性细胞模型脂代谢关键酶的活性,促使脂肪酸的从头合成途径被抑制,激活脂肪酸的分解途径,进而减少BRL-3A细胞TG的合成。
油酸诱导的脂肪变性细胞模型,会造成肝细胞受到一定程度的损伤。而用不同浓度乙酸钠会通过AMPK信号通路促进脂肪酸的分解代谢,进而减少TG的合成,同时可以抑制肝细胞损伤,从而缓解脂肪变性所带来的负面影响,为今后NAFLD的治疗提供了新的理论依据和切入点。
猜你喜欢 乙酸钠基转移酶油酸 浅谈碳源投加位置对AAO工艺污水脱氮除磷效果的影响中国新技术新产品(2022年15期)2022-11-08高油酸油菜遗传育种研究进展生物技术进展(2022年5期)2022-10-11木薯UDP依赖型糖基转移酶14基因在木薯抗病性中的功能研究热带作物学报(2022年7期)2022-08-06葡萄醇酰基转移酶编码基因遗传变异研究中国农业科学(2022年14期)2022-07-26氨基转移酶升高真有这么可怕吗保健与生活(2022年11期)2022-06-09氨基转移酶升高代表肝脏受损吗保健与生活(2021年5期)2021-04-12花生中的翘楚――高油酸花生新农业(2020年18期)2021-01-07四种防霉剂及其复配对黄曲霉菌抑制效果的研究现代牧业(2020年4期)2020-12-31高油酸花生特征特性及栽培技术要点现代农村科技(2020年2期)2020-03-24高油酸食用油引领百姓餐桌健康升级环球时报(2018-03-01)2018-03-01推荐访问:乙酸 油酸 诱导