复方苦参注射液联合含奥沙利铂化疗方案治疗晚期结直肠癌临床疗效及安全性的Meta,分析
来源:优秀文章 发布时间:2022-12-06 点击:
周 彤,王 烁,胡帅航,李 铮,樊柄杰,李经蕾,侯 炜
(1.中国中医科学院广安门医院,北京 100053;
2.中国中医科学院,北京 100700)
结直肠癌(colorectal cancer,CRC)是目前世界范围内最常见的恶性肿瘤之一[1]。据统计,2020 年全球CRC 发病率和死亡率居全部恶性肿瘤的第三位,中国CRC 发病率及死亡率位居全部恶性肿瘤的第五位[2,3]。早期结直肠癌患者可选择治愈率较高的肠镜结合外科手术的治疗方式,但其中约30%~50%的患者在根治术后会出现复发转移[4],且大部分患者确诊即是晚期,这种情况下化疗成为首选治疗手段。含奥沙利铂化疗方案是目前晚期结直肠癌患者的标准化疗方案[5],常引发包括骨髓抑制、消化道反应、周围神经毒性在内多重不良反应,严重影响患者生活质量,许多患者被迫放弃化疗,临床疗效大大降低[6]。
以苦参和白土苓为主要有效成分的复方苦参注射液(compound kushen injection,CKI)近年在临床得到广泛应用,在诱导肿瘤细胞凋亡、促进宿主抗肿瘤免疫反应方面发挥了良好作用[7]。以往研究多是综合所有病理阶段结直肠癌患者进行系统评价,且未严格限制化疗方案,无法给晚期不可行手术或术后复发转移的结直肠癌患者临床治疗提供指导意义。本文旨在填补这一空白,对复方苦参注射液联合含奥沙利铂化疗方案治疗晚期结直肠癌的随机对照试验(randomized controlled trial,RCT)进行严谨的Meta 分析,以期评价其有效性与安全性,指导临床应用。
1.1 纳入与排除标准
1.1.1研究类型 复方苦参注射液联合含奥沙利铂化疗方案治疗晚期结直肠癌的RCT。
1.1.2研究对象 纳入患者均符合第8 版美国癌症联合会晚期结直肠癌诊断标准[8]或Dukes 分期,即病理学、细胞学、影像学诊断为不可行手术治疗或术后复发转移的Ⅲ~Ⅳ期患者。
1.1.3干预措施 对照组:含奥沙利铂化疗方案治疗组(包括FOLFOX 方案、XELOX 方案);
试验组:在对照组的基础上联合应用CKI。
1.1.4结局指标 (1)临床疗效:以客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)判断临床疗效:参照世界卫生组织(World Health Organization,WHO)实体瘤疗效评价标准[9]及RECIST 实体瘤疗效评价[10]标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),客 观 缓 解 率=(CR 例 数+PR 例 数)/总 例 数×100%,疾病控制率=(CR 例数+PR 例数+SD 例数)/总例数×100%。(2)生活质量:以Karnofsky(即KPS 评分)改善率评价生存质量,凡治疗后较治疗前KPS 评分提高≥10 分为提高,下降≥10 分为降低,变化<10 分为稳定,改善率=(提高例数+稳定例数)/总例数×100%。(3)安全性:以不良反应发生率作为安全性评价结局指标。参考1981 年WHO 制定的《化疗药物急性及亚急性毒性标准》[11],不良反应包括骨髓抑制反应(血红蛋白毒性、白细胞毒性、血小板毒性)、消化道反应(恶心呕吐、腹泻)、周围神经毒性、肝功能异常。(4)免疫功能:以治疗后免疫细胞各亚群比例作为免疫功能评价指标。包括CD3+、CD4+、CD8+、CD4+/CD8+、NK。
1.1.5排除标准 (1)使用放疗、靶向药等非化疗手段;
(2)使用除复方苦参注射液外的其他中药制剂;
(3)多次重复发表的文献(保留第一篇),或是不同文献研究数据存在重复者(保留数据最全的一篇);
(4)无法获得完整研究数据。
1.2 检索策略
中文文献数据库包括中国知网数据库(CNKI)、重庆维普中文科技期刊数据库(VIP)、万方数据库(WanFang)和中国生物医学文献服务系统(SinoMed)。英文数据库为PubMed、EMBASE、Cochrane Library。人工检索CLINICALTRIALS.GOV、WHO REGISTRY 等数据库以获取正在进行的临床试验或未发表的灰色文献数据。检索日期自建库至2020 年12 月31 日。将检索词按照Cochrane 系统评价手册所列出的RCT 检索策略分目标疾病和干预措施两大部分,采用主题词与自由词相结合的检索式组合方式。中文检索词为“结肠癌”、“直 肠 癌”、“结 直 肠 癌”、“结 直 肠 肿 瘤”、“复 方苦参注射液”、“复方苦参注射剂”、“复方苦参”、“岩舒注射液”、“岩舒”。英文检索词为“Colorectal Neoplasms”、“Colonic Neoplasms”、“Rectal Neoplasms”、“Compound Kushen Injection”、“Fufangkushen”、“yanshu”。
1.3 文献筛选与资料提取
通过阅读题目及摘要剔除明显不符合纳入标准的文献,分析全文以确定是否最终纳入。筛选工作由2 位研究人员独立进行并交叉核对,产生分歧则交由第3 位研究人员评价处理。如遇缺少资料的文献,通过邮箱、电话联系作者予以补充。提取资料主要内容包括:(1)基本信息;
(2)研究人群资料;
(3)干预措施;
(4)对照措施;
(5)结局指标。
1.4 文献质量评价
使用Cochrane 系统评价手册5.1.0 偏倚风险评估工具对纳入研究的方法学进行质量评价。评价内容包括:随机序列产生、随机隐藏、患者/研究者盲法、结局评价者盲法、结局数据完整性、选择性结局报告、其他偏倚来源7 方面。每个评价角度都依据偏倚风险评价标准判断所属风险类型[12]。
1.5 统计分析
采用RevWan 5.4 软件进行统计分析,临床疗效、生活质量、安全性结局指标为二分类资料,采用相对危险度(relative risk,RR)为效应指标;
免疫功能结局指标为连续变量资料,采用均数差(mean deviation,MD)为 效 应 指 标,计 算95% 的 可 信 区 间(confidence interval,CI)和P值。若P>0.1,I2≤50%,则提示无明显统计学异质性,采用固定效应模型分析;
若P≤0.1,I2>50%,提示研究间异质性显著,采用随机效应模型进行分析,并通过敏感性分析或亚组分析判断异质性来源。采用漏斗图分析纳入研究的发表偏倚。
2.1 文献检索结果
根据检索策略检索数据库,共获得文献810 篇,将所得文献题录导入NoteExpress 软件中,剔除重复文献503 篇。通过阅读标题及摘要,剔除不符合纳排标准文献247 篇,精读剩余60 篇文章全文剔除基线资料不一致或文献质量过低文献26 篇,最终纳入34 项RCT 研究,文献筛选流程见图1。
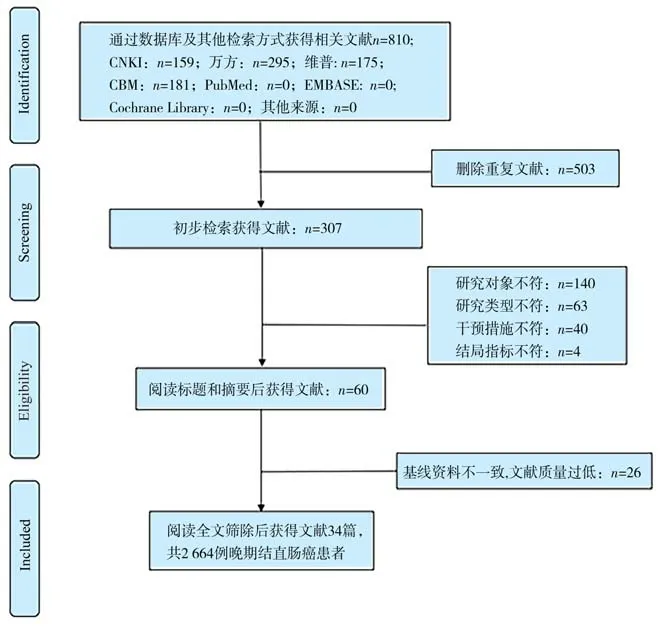
图1 文献筛选流程图Fig 1 Flowchart of literature screening
2.2 纳入文献基本特征
纳入34 项RCTs[13-46]总样本 量为2 664 例,其中实验组1 343 例,对照组1 321 例。样本量最小21例,最大125 例。对照组干预措施包括FOLFOX、XELOX 化疗方案,试验组均为CKI+FOLFOX/XELOX 化 疗 方 案。4 项 研 究[30,31,38,40]疗 程>4 周 期,23 项 研 究 疗 程 ≤4 周 期 。
16 项 研究[13,16,18,24,27,28,35,37-43,45,46]依 据KPS 评 分 对 生 存 质 量 改善 情 况 进 行 分 级 评 价,15 项 研 究[15,17,18,21,2428,34-38,41]对不良反应发生情况进行了描述,其中1 项研究[13]采用流式细胞仪检测血红蛋白、白细胞、血小板数量而未分级。具体文献特征见表1。
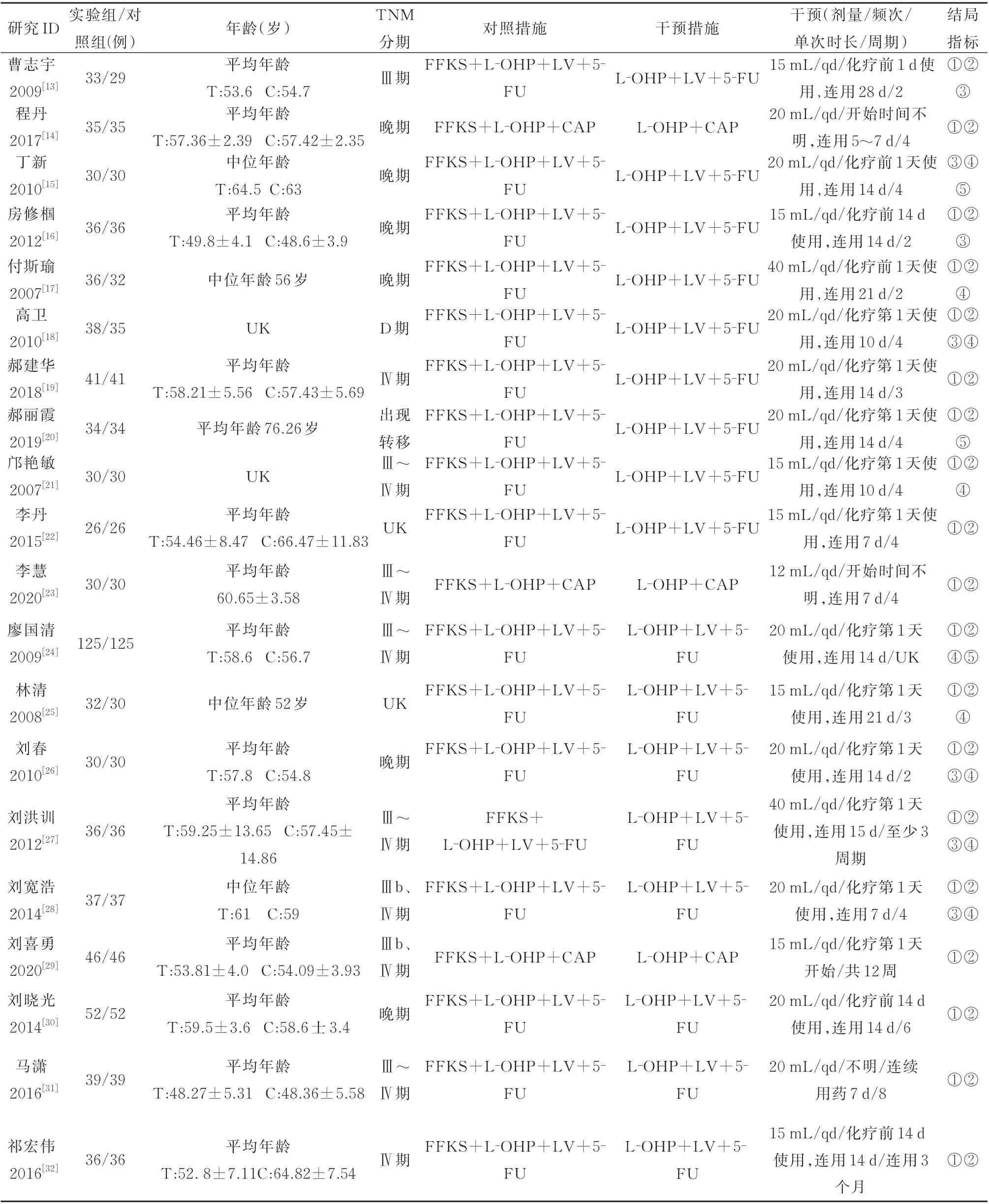
表1 文献特征信息表Tab 1 Document characteristic information table

续表
2.3 纳入研究的质量评价
纳入评价的34 项RCT[13-46]基线水平无统计学差异。9 项研究描述了随机方法,其中7 项研究[15,18-20,22,23,41]采用随机数字表法,1 项研究[37]采用分层随机均衡法,1 项研究[31]采用电脑随机盲法。若结局指标只包含ORR、DCR 等客观结局指标,则盲法是否实施对结果偏倚不会产生影响,因此评价为“低风险”;
若不含客观结局指标,则偏倚风险评价为“高风险”;
若结局指标包含生存质量、不良反应等主观结局指标,则偏倚风险评价为“不清楚”。34项RCT[13-46]均未提前终止,无不完整结局报告。见图2。

图2 纳入文献偏倚风险评估Fig 2 Assessment of risk of bias of the included studies
2.4 Meta 分析结果
2.4.1 客观缓解率
2.4.1.1 WHO 实体瘤疗效判定标准 24 项研究[14,1622,24-28,30-32,34,36,38,40,41,43,44,46]采 用WHO 实体 瘤 疗 效评价标准对客观缓解率进行统计,各项研究间统计学异质性较小(P=0.42,I²=3%),故采用固定效应模型合并效应量。Meta 分析结果显示:试验组可将ORR 提高至对照组的1.43 倍,差异有统计学意义[RR=1.43,95%CI(1.31,1.55),P<0.000 01]。见图3。
2.4.1.2 RECIST 实体瘤疗效评价标准 7 项研究[13,23,29,33,35,42,45]采 用RECIST 实 体 瘤 疗 效 评 价 标 准对客观缓解率进行统计,各项研究间统计学异质性较小(P=0.96,I²=0%),故采用固定效应模型合并效应量。Meta 分析结果显示:试验组ORR 优于对照组,差异有统计学意义[RR=1.27,95%CI(1.051,1.54),P=0.01)]。
综合数据分析可知,试验组客观缓解率优于对照组,差异有统计学意义(RR=1.40,95%CI(1.29,1.51),P<0.000 01]。见图3。

图3 客观缓解率森林图Fig 3 Forest plot of objective response rate
2.4.2 疾病控制率
2.4.2.1 WHO 实体瘤疗效判定标准 24 项研究[14,1622,24-28,30-32,34,36,38,40,41,43,44,46]采用WHO 实 体 瘤 疗效评价标准对疾病控制率进行统计,各项研究间统计学异质性较小(P=0.39,I²=5%),故采用固定效应模型合并效应量。Meta 分析结果显示:试验组DCR 优于对照组,差异有统计学意义[RR=1.11,95%CI(1.07,1.16),P<0.000 01)]。见图4。
2.4.2.2 RECIST 实体瘤疗效评价标准 7 项研究[13,23,29,33,35,42,45]采 用RECIST 实 体 瘤 疗 效 评 价 标 准对客观缓解率进行统计,各项研究间统计学异质性较小(P=0.79,I²=0%),故采用固定效应模型合并效应量。Meta 分析结果显示:试验组DCR 优于对照组,差异有统计学意义[RR=1.13,95%CI(1.03,1.24),P=0.01)]。
综合数据分析可知,试验组疾病控制率优于照组,差异有统计学意义[RR=1.12,95%CI(1.08,1.16),P<0.000 01)]。见图4。
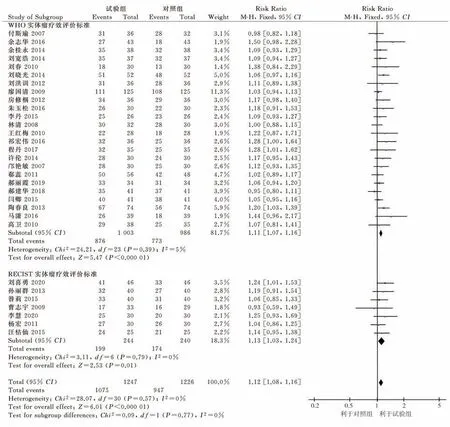
图4 疾病控制率森林图Fig 4 Forest map of disease control rate
2.4.3 生 活 质 量 评 价 16 项 研 究[13,16,18,24,27,28,35,37-43,45,46]原始数据均以Karnofsky 评分增长例数与稳定例数之和占总例数的比率为评价标准对生活质量改善情况进行统计,研究存在统计学异质性(P=0.006,I²=54%),故采用随机效应模型合并效应量。META 分析结果显示:试验组生活质量提高优于对照组,差异有统计学意义[RR=1.24,95%CI(1.14,1.36),P<0.000 01]。见图5。
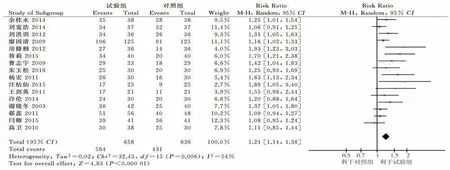
图5 生活质量森林图Fig 5 Forest plot of quality of life
因存在中度异质性,故逐一剔除文献进行分析,当剔除高卫等[18]的研究时,异质性降至23%,故说明此研究为异质性的主要来源,本研究化疗方案中奥沙利铂为130 mg/m2,其余研究多为85 mg/m2或100 mg/m2,故考虑异质性来源与此研究化疗药物剂量偏大有关。
2.4.4 不 良 反应 共有15 项研究[15,17,18,21,2428,34-38,41]报道了治疗后不良反应,具体分析结果见表2。与对照组相比,试验组血红蛋白减少发生率、白细胞减少发生率、血小板减少发生率、恶心呕吐发生率、腹泻发生率、周围神经毒性发生率、肝功能损害发生率均降低,研究结果显示复方苦参注射液在减轻白细胞减少及腹泻的不良反应发生率方面疗效显著,差异有统计学意义(P<0.05)。试验组血红蛋白减少率与对照组比较,差异无统计学意义(P>0.05)。因血红蛋白减少率、恶心呕吐发生率、周围神经毒性发生率均存在异质性,故对各项指标逐一剔除研究进行分析,后发现以上所有指标均包含郗蕊[38]这一研究,在剔除郗蕊研究后各指标异质性指标I²均降至0%。而逐一剔除其余文献,统计结果的合并效应量与总效应量均无显著性差异,且统计学异质性未发生明显改变,说明郗蕊的研究是异质性的主要来源,在对研究进行综合分析后可知,此项研究干预时长为6 个周期,为所纳入研究中周期较长者,因此考虑异质性大的主要原因是与治疗措施使用周期过长有关。

表2 复方苦参注射液联合含奥沙利铂化疗方案治疗结直肠癌不良反应Meta 分析Tab 2 Meta-analysis of adverse reactions of CKI combined with oxaliplatin chemotherapy in the treatment of colorectal cancer
2.4.5 免 疫 功 能 共 有3 项 研 究[15,20,24]对 患 者 的 免疫功能进行了评价,具体分析结果见表3。与对照组相比,治疗后试验组CD3+、CD4+、CD4+/CD8+、NK 细胞水平高于对照组,差异有统计学意义(P<0.05)。而试验组CD8+细胞水平低于对照组,差异有统计学意义(P<0.05)。其中CD4+、CD8+指标异质性显著,考虑与研究数量及样本数量偏少有关。见表3。

表3 复方苦参注射液联合含奥沙利铂化疗方案治疗结直肠癌免疫功能Meta 分析Tab 3 Meta-analysis of immunologic function of CKI combined with oxaliplatin chemotherapy in the treatment of colorectal cancer
2.5 发表偏倚
针对客观缓解率、疾病控制率这两个指标绘制漏斗图,通过图形发现研究分布相对对称,不存在明显的发表偏倚。见图6、7。

图6 客观缓解率倒漏斗图Fig 6 Funnel plot of objective response rate
以往针对CKI 治疗结直肠癌的系统评价虽有发表,但多是将早、中、晚期结直肠癌研究混杂在一起进行疗效评价,并未说明纳入研究对象的具体临床分期,导致临床疗效评价结论异质性较大,不能给晚期不可行手术或术后复发转移的CRC 临床治疗提供指导意义。且以往研究未对化疗干预方案进行限制,对实施FOLFOX、XELOX、FOLFIRL 以及化疗联合靶向、免疫治疗的研究混杂起来进行疗效评价,难以反映复方苦参注射液联合单纯含奥沙利铂的一线化疗方案的具体临床疗效。本研究从临床疗效、生活质量、不良反应及免疫功能四个方面,针对CKI 联合含奥沙利铂的一线化疗方案治疗晚期CRC 的疗效及安全性进行了系统评价。

图7 疾病控制率倒漏斗图Fig 7 Funnel plot of disease control rate
在我国,CRC 导致的死亡病例数为187 100 例,占全部恶性肿瘤死亡病例数的8.01%[47]。Ⅰ期结直肠癌5 年相对生存率可达90%,而发生远处转移的Ⅳ期结直肠癌5 年相对生存率仅为14%[48]。目前FOLFOX 方案及XELOX 化疗方案是临床最常应用的一线化疗方案[49]。奥沙利铂是第三代铂类广谱细胞毒药物,属于含有1,2-二氨环己烷基团的DNA 损伤类化疗药物,铂原子通过与DNA 交叉联结拮抗其复制和转录,抗癌活性效果明显[5]。如何联合用药以降低含奥沙利铂化疗方案的毒副作用,提高耐药患者的临床有效率,改善患者生存质量是目前亟待解决的临床问题。
CKI 是由苦参和白土苓两味药物有效成分提取而成的中药注射剂,具有清热凉血、解毒散结的功效,通过多靶点、多机制联合作用,在综合调控原癌基因与抑癌基因,诱导肿瘤细胞凋亡,促进宿主抗肿瘤免疫反应,抑制肿瘤新生血管的形成等方面具有良好效果[51]。分子生物学研究证实,CKI 通过影响BCL-2 原癌基因和端粒酶的表达,降低存活素的水平,诱导肿瘤细胞凋亡,从而实现抗肿瘤作用[52]。王洪倩等通过体外实验发现,CKI 组、奥沙利铂组、两药联用组对结肠癌SW620、HT29、LOVO 细胞株均有一定的体外杀伤作用,而联合用药组对细胞株增殖的抑制效果明显强于奥沙利铂组和CKI 组,抑制作用呈现剂量依赖效应[53]。
本 研 究 共 纳 入34 项 研 究[13-46],包 含 患 者2 664例,试验组1 343 例,对照组1 321 例。结果分析表明与含奥沙利铂化疗方案相比,CKI 联合含奥沙利铂化疗可提高晚期CRC 患者的客观缓解率约17%,疾病控制率约9%,差异有统计学意义(P<0.05)。同时可降低骨髓抑制、消化道反应、肝功能损伤、周围神经毒性等不良反应的发生,尤其是在减轻白细胞减少及腹泻的不良反应方面疗效更为突出。免疫功能方面,CD3+反映机体细胞免疫水平,CD4+主要是通过分泌淋巴因子扩大免疫应答,与其他免疫发挥协同作用。CD8+具有抑制CD4+细胞和B 细胞的功能[54]。CD4+/CD8+比值降低代表患者细胞免疫功能下降。NK 细胞作为机体抗肿瘤评价标准之一,在免疫监视、杀伤突变癌细胞方面具有重要作用[55]。纳入研究中试验组CD3+、CD4+、CD4+/CD8+、NK 水 平 均 高 于 对 照 组,而CD8+水平低于对照组,提示CKI 可能是通过增强CD3+、CD4+、CD4+/CD8+、NK 从而提高机体免疫功能。
本研究的不足及局限性:(1)纳入研究为单中心研究,因此检验效能不足;
(2)纳入研究方法学质量较差。多数研究没有提及随机方案的隐藏以及盲法实施程度的评估报告。对于肿瘤类疾病的研究,考虑到化疗副作用及治疗周期较长的因素,患者完全按照预定方案完成治疗存在一定难度,但34项研究[13-46]均未提及存在失访或是脱落的情况,因此选择性结局报告存在潜在偏倚;
(3)纳入研究长期结局指标欠缺:各研究的结局指标多是针对临床疗效及生存质量进行统计,例如无进展生存期、无病生存期、疾病进展时间等临床试验终点指标仅有一项研究进行了分析,可供分析数据过少,提示日后其他RCT 应对长期生存指标予以关注,为复方苦参注射液的长期临床获益提供研究数据;
(4)纳入的化疗方案药物疗程不同:虽对具体化疗方案的药物进行了严格限定,但不同研究之间存在着化疗周期的差异,会导致研究结论存在潜在偏倚,因此尚需要大样本、多中心的RCT 进一步验证。
作者贡献度说明:
周彤:负责论文设计和撰写,完成文献筛选和数据提取;
王烁、胡帅航:负责独立筛选文献及提取数据;
李铮、樊柄杰:进行核对协商并辅助对文章及相关图表格式修改;
李经蕾:负责论文修订;
侯炜:负责选题、设计和修订。
所有作者声明不存在利益冲突关系。
猜你喜欢 奥沙利苦参异质性 Meta分析中的异质性检验临床肝胆病杂志(2022年8期)2022-11-23长时间停用奥沙利铂再次使用致过敏性休克1例中南药学(2022年8期)2022-09-13城市规模与主观幸福感——基于认知主体异质性的视角社会科学战线(2022年5期)2022-07-23管理者能力与企业技术创新:异质性、机制识别与市场价值效应社会科学战线(2022年5期)2022-07-23以苦参为主治疗心律失常的疗效观察中国典型病例大全(2022年10期)2022-05-10苦参生品及其炮制品的2种不同提取方法的抗菌药效研究安徽农业科学(2022年6期)2022-04-11基于可持续发展的异质性债务治理与制度完善现代企业(2021年2期)2021-07-20丁俊晖与奥沙利文的亦敌亦友做人与处世(2020年6期)2020-04-19含漱苦参茶止牙痛文萃报·周二版(2018年36期)2018-07-13良药苦口话苦参家庭医学(2015年3期)2015-06-11推荐访问:苦参 注射液 复方