MicroRNA-155靶向SOCS1基因对冠心病内皮细胞炎症损伤的影响
来源:优秀文章 发布时间:2023-01-24 点击:
徐涛 王超
(1河北北方学院附属第一医院心血管内科,河北 张家石 075000;
2河北省人民医院代谢病重点实验室)
据现代研究表明,冠状动脉粥样硬化心脏病(CHD) 是由动脉内膜脂类物质的堆积引起的动脉粥样病变〔1~3〕。近几年来,CHD发病率逐年上升,发病年龄逐渐呈年轻化〔4〕。研究显示,炎症反应通过破坏动脉粥样硬化斑块的稳定性导致斑块破裂,进而导致CHD〔5~7〕。MicroRNA在CHD发病机制中起关键作用。研究〔8~10〕显示许多MicroRNA分子在调控糖脂代谢、促进血管炎症反应及平滑肌细胞增殖方面产生作用。MicroRNA-155作为一个典型多功能的MicroRNA,位于21号染色体上BIC基因的第三个外显子,此基因可以调控免疫细胞和造血细胞的发育分化,从而在炎症和抗体合成等免疫反应中发挥着重要作用〔11〕。研究发现,MicroRNA-155能够通过靶向调节细胞因子信号转导抑制因子(SOCS)1表达,进而产生免疫调节作用,此作用在巨噬细胞炎症反应中观察得到〔12,13〕。本实验通过研究MicroRNA-155靶向SOCS1基因对CHD内皮细胞炎症损伤的影响,探索CHD的治疗方法。
1.1动物模型 选取纯种SD雄性大鼠24只,鼠龄3~4个月,体重(240±60)g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXKC(湘)200900004,动物合格证编号:HNASLKJ20100330。饲养在塑料笼内,每笼6只。室内温度25℃,湿度65%,大鼠自行随意摄取饲料和自来水。饲养1 w适应环境,以降低应激反应。动物实验严格遵循《赫尔辛基宣言》。
1.2主要试剂 培养基DMEM购自美国Gibco公司,TRIzol组织提取试剂盒、转染试剂Lipofectamine 2000购自美国Invitrogen公司,质粒提取试剂盒购自美国Promega公司,二喹啉甲酸(BCA)蛋白浓度检测试剂盒购自碧云天,MicroRNA-155 mimics、阴性对照(miR-NC)购自吉玛公司,反转录试剂盒A5000购自Promega公司,兔抗SOCS1、GAPDH一抗购自美国Abcam公司,辣根过氧化物酶(HRP)标记羊抗兔二抗购自碧云天公司,AerosetTM生物化学分析仪购自美国亚培公司,Bio-rad Gel Dol EZ成像仪购自美国Bio-rad公司。
1.3病理模型的构建及分组 制备冠状动脉粥样硬化(AS)模型,分为正常组和AS组各12只。正常组喂养基础饲料,AS组喂养高脂饲料,并添加维生素D3粉剂。实验开始时,在大鼠右下肢肌肉注射维生素D3粉针剂,每隔30 d重复1次。
1.4血脂和血钙的检测 实验3个月后,采集各组大鼠动脉血,检测血脂和血钙。检测正常组和AS组血浆中三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和Ca2+的浓度。
1.5冠状动脉内皮细胞的分离、培养及鉴定 将动脉组织剪碎,先后加入Ⅱ型胶原酶和胰蛋白酶消化后,加入DMEM完全培养基培养于37℃、5%CO2细胞培养箱中,待细胞生长至80%融合,加入胰酶消化细胞,调整到适宜的密度后传代并培养。细胞使用PBS洗涤后,先后加入一抗和二抗,37℃孵育30 min,二氨基联苯胺(DAB)显色。37℃培养24 h后,使用倒置显微镜观察细胞形态,
1.6细胞转染 在大鼠冠状动脉内皮细胞中,加入同型半胱氨酸,共培养24 h,制造CHD模型。设计促MicroRNA-155表达的靶序列,合成DNA Oligo,制成双链DNA。与双酶切后的pGCSIL-GFP报告基因载体连接并转化,筛选阳性克隆细胞,提取质粒进行酶切测序。合成MicroRNA-155 mimics、MicroRNA-155 inhibitor及siSOCS1,并用脂质体包装;
将脂质体加入细胞培养基中共培养24 h,构成空白对照组、阴性对照组、MicroRNA-155过表达(MicroRNA-155 mimics)组、MicroRNA-155抑制(MicroRNA-155 inhibitor)组、SOCS1基因失活(MicroRNA-155 inhibitor+siSOCS1)组。
1.7双荧光素酶实验检测MicroRNA-155与SOCS1的靶向关系 通过软件http://www.microrna.org 预测MicroRNA-155与SOCS1的靶向关系。合成含MicroRNA-155结合位点的SOCS1 3′UTR启动子区序列,构建野生型质粒SOCS1 3′UTR-WT和突变型质粒SOCS1 3′UTR-MUT。使用Lipofectamine 2000试剂,将SOCS1-3′ UTR-WT和MicroRNA-155 mimic质粒共转染于293T细胞;
同时设野生型质粒转染阴性对照组(SOCS1-3′UTR-WT+NC)、突变型质粒转染阴性对照组(SOCS1-3′UTR MUT+NC)和突变型质粒转染MicroRNA-155 mimic质粒组(SOCS1-3′UTR-MUT+MicroRNA-155 mimic)。用荧光素酶报告基因检测试剂盒检测荧光强度。
1.8定量反转录聚合酶链反应(qRT-PCR)检测检测MicroRNA-155、SOCS1 mRNA的表达水平 TRIzol试剂盒提取组织和细胞总RNA进行,酶标仪检测RNA浓度。采用反转录试剂盒A5000合成cDNA,按照SYBR方法进行qRT-PCR。MicroRNA-155上游引物:5′-GGAGGTTAATGCTAATTGTGAT-3′,下游:5′-GTGCAGGGTCCGAGGT-3′;
SOCS1上游引物:5′-CCGCTCCCACTCCGATTACC-3′,下游:5′-CCGAA GCCATCTTCACGCTGA-3′,U6上游引物:5′-CTCGC TTCGGCAGCA CA-3′,下游:5′-AACGCTTCACGAAT TTGCGT-3′。
1.9Western印迹检测SOCS1蛋白表达 提取每组大鼠心肌组织和细胞蛋白,使用BCA试剂盒说明书检测蛋白浓度后进行电泳。转印到聚偏氟乙烯(PVDF)膜后加入5%牛血清白蛋白(BSA)室温封闭1 h。加入兔抗鼠SOCS1一抗,孵育4℃过夜;
再加羊抗兔二抗室温孵育2h,ECL液暗室发光显影。β-actin 作为内参,成像系统采集图像Image J软件分析。
1.10细胞活性检测 CMEC细胞悬液按接种于96孔板中,设6个平行孔/组。待细胞生长达80%融合后,按之前实验分组处理细胞。加入四甲基偶氮唑蓝(MTT)液20 μl,置于37℃、5% CO2环境中培养4 h,弃去MTT溶液,每孔加入二甲基亚砜150 μl,振荡10 min后,于490 nm波长处检测每孔细胞吸光度值。细胞存活率=(试验组吸光度值-空白组吸光度值) /空白组吸光度值×100%。
1.11细胞凋亡率检测 将细胞接种于24孔板中,37℃、5% CO2环境中培养。待细胞贴壁后,使用PBS清洗细胞,并用多聚甲醛固定。加入Hochest33258工作液染色。在倒置荧光显微镜下观察细胞形态:细胞固缩、浓集且细胞核变亮为凋亡细胞。凋亡率=凋亡细胞数/总细胞数×100%。
1.12白细胞介素(IL)-6、IL-10、IL-18和IL-1β水平 吸取细胞培养液,酶联免疫吸附试验(ELISA)法检测细胞培养液中IL-6、IL-10、IL-18和IL-1β浓度。
1.13统计学方法 采用SPSS19.0软件进行t检验、单因素方差分析。
2.1两组血清总胆固醇、血脂和血钙水平 与正常组比较,AS组TC、TG、LDL-C和Ca2+水平均有显著差异(P<0.05),而HDL-C水平无显著差异(P>0.05)。见表1。

表1 各组血清TC、TG、LDL-C、HDL-C、Ca2+水平
2.2两组心肌组织中MicroRNA-155和SOCS1 mRNA表达水平 与正常组比较,AS组心肌组织中MicroRNA-155 mRNA水平显著上升,而SOCS1 mRNA表达水平则显著下调(P<0.05)。见表2。
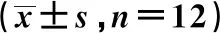
表2 两组MicroRNA-155与SOCS1 mRNA表达水平
2.3两组心肌组织中SOCS1蛋白表达水平 Western印迹法检测结果显示,与正常组(1.02±0.08)比较,AS组SOCS1蛋白表达(0.32±0.02)显著下降(P<0.05)。见图1。
图1 两组SOCS1蛋白表达水平
2.4双荧光素酶实验检测结果 生物信息网站http://www.microrna.org预测MicroRNA-155与SOCS1有靶向关系。见图2。293T细胞内共转染SOCS1-3′UTR-WT质粒和MicroRNA-155 mimics质粒。结果显示,野生型中,与SOCS1-3′UTR-WT + NC组(1.12±0.13)比较,SOCS1-3′UTR-WT + MicroRNA-155 mimics组荧光素酶活性(0.72±0.08)显著降低(P<0.05)。在突变型中,与SOCS1-3′UTR-MUT+NC组(1.13±0.15)比较,SOCS1-3′UTR-MUT+MicroRNA-155 mimics组荧光素酶活性(1.18±0.22)无显著差异(P>0.05)。

图2 MicroRNA-155靶向调控SOCS1表达
2.5冠状动脉内皮细胞形态观察及鉴定原代 冠状动脉内皮细胞培养1 d细胞形态呈鹅卵石状;
培养5~7 d时,形态呈多角形或梭形。见图3。
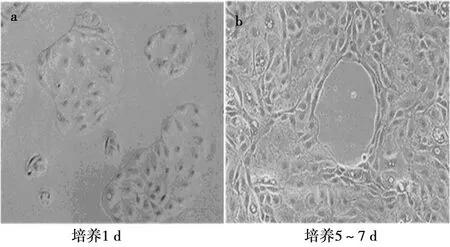
图3 冠状动脉内皮细胞形态(×400)
2.6各组细胞中MicroRNA-155和SOCS1 mRNA表达水平 qPCR结果显示:与空白对照组比较,MicroRNA-155 mimics组中MicroRNA-155表达水平显著上升,SOCS1 mRNA表达水平显著下降(P<0.05);
而MicroRNA-155 inhibitor组中MicroRNA-155表达水平显著下降,SOCS1 mRNA表达水平显著上升(P<0.05)。空白对照组、阴性对照组和MicroRNA-155 inhibitor+siSOCS1组各指标差异无统计学意义(P>0.05)。见表3。

表3 MicroRNA-155和SOCS1 mRNA表达水平
2.7各组细胞中SOCS1蛋白表达水平 Western印迹结果显示,与空白对照组(1.01±0.05)比较,MicroRNA-155 mimics组中SOCS1的蛋白表达水平(1.76±0.32)显著上升;
而MicroRNA-155 inhibitor组中SOCS1的蛋白表达水平(0.41±0.04)显著下降(P<0.05)。空白对照组、阴性对照组(1.06±0.03)和MicroRNA-155 inhibitor + siSOCS1组SOCS1蛋白水平(0.62±0.05)差异无统计学意义(P>0.05)。见图4。

1:空白对照组;
2:阴性对照组;
3:MicroRNA-155 mimics组;
4:MicroRNA-155 inhibitor组;
5:MicroRNA-155 inhibitor+siSOCS1组;
图5同
2.8各组细胞活性 MTT法检测结果显示,与空白对照组(0.62±0.04)比较,MicroRNA-155 mimics组细胞活性(0.38±0.02)显著下降(P<0.05);
MicroRNA-155 inhibitor组细胞活性(1.02±0.03)显著上升(P<0.05)。空白对照组、阴性对照组(0.65±0.06)和MicroRNA-155 inhibitor+siSOCS1组细胞活性(0.72±0.05)差异无统计学意义(P>0.05)。
2.9细胞凋亡率检测 细胞进行冠心病应激后,使用Hochest33258染色,出现细胞核残缺、核固缩、染色质浓集等凋亡特征。与空白对照组(15.32%±3.28%)比较,MicroRNA-155 mimics组细胞凋亡率(31.65%±4.12%)显著升高(P<0.05);
而MicroRNA-155 inhibitor组细胞凋亡率(8.19%±4.37%)显著降低(P<0.05)。MicroRNA-155 inhibitor+siSOCS1组的凋亡率(13.29%±2.34%)与空白对照组和阴性对照组(16.61%±3.87%)差异无统计学意义(P>0.05)。见图5。

图5 Hochest33258染色检测各组细胞凋亡(×400)
2.10各组细胞炎症因子表达水平 与空白对照组和阴性对照组比较,MicroRNA-155mimics组IL-1β、IL-6和IL-18含量显著上升,而IL-10含量显著下降(P<0.05);
而MicroRNA-155 inhibitor组中IL-1β、IL-6和IL-18含量显著下降,IL-10含量显著上升(P<0.05)。空白对照组、阴性对照组和MicroRNA-155 inhibitor+siSOCS1组IL-1β、IL-6、IL-10和IL-18含量无显著差异(P>0.05)。见表4。

表4 各组细胞炎症因子表达水平
现代社会,人们的生活水平逐渐升高,医疗卫生条件也持续改善,使得人口老龄化加剧,进而导致老年性疾病的发病率逐年上升,其中最严重的便是AS〔14〕。AS是许多重要血管事件的病理基础,其造成的心血管疾病在全球发病率和死亡率中居于首位〔15〕。因而对AS的发病机制及病理基础进行深入研究具有重大意义。现代研究表明,免疫炎症反应在AS的发生及发展过程中有重要作用。
MicroRNAs是近年来新发现的一类内源性非编码RNA分子,普遍存在于真核生物中,通过抑制其标靶分子的表达,进而发挥在肿瘤发生、免疫炎症等生命过程中重要的调节作用〔16,17〕。MicroRNA-155是与炎症关系最为密切的MicroRNAs之一,许多研究发现 MicroRNA-155 在AS病人中呈高表达〔18〕。并且,MicroRNA-155能通过调控不同的靶标分子来调节巨噬细胞炎症反应、脂质摄取,进而在AS中发挥重要的作用〔19〕。SOCS细胞产生,包括SOCS1~7,是一种反馈性的负性调节因子。通过阻断细胞因子信号传导,进而参与人体多种炎性疾病的发生发展〔20〕。包括SOCS1在AS的炎症机制中发挥着重要作用,研究表明SOCS1可负性调节免疫细胞中干扰素(IFN)和Toll样受体介导反应〔21〕:SOCS1缺陷小鼠成纤维细胞、DC细胞、巨噬细胞对脂多糖(LPS)和Toll样受体配体均高度敏感,促进动脉粥样硬化斑块形成〔22〕的炎性细胞因子,如IL-6、IL-12、肿瘤坏死因子(TNF)-α和IFN-γ的分泌量均增高。
现代研究证明,IL-1β通过结合IL-1受体1,是重要的炎症信号之一〔23,24〕。本实验结果显示,MicroRNA-155过表达可抑制冠心病大鼠心肌微血管内皮细胞活力,并使细胞凋亡率上升。因此,MicroRNA-155可靶向抑制SOCS1增加冠心病大鼠心肌微血管内皮细胞的凋亡率。MicroRNA-155通过抑制SOCS1表达,从而促进炎症因子的表达,使细胞产生炎症损伤。
综上,MicroRNA-155通过靶向抑制SOCS1基因,促进冠心病大鼠心肌微血管内皮细胞凋亡,提高促炎因子IL-1β、IL-6 和IL-18表达,从而大鼠心肌微血管内皮细胞炎症损伤。
猜你喜欢 空白对照内皮细胞质粒 小麦不同肥力下经济效益试验研究新农业(2022年21期)2022-11-18有氧运动和精氨酸补充对高血压的干预作用及其与内皮细胞功能的关系体育科技文献通报(2022年4期)2022-10-21外源性透明质酸对人牙周膜细胞增殖及成牙骨质、成纤维分化的影响中日友好医院学报(2022年4期)2022-10-15——一道江苏高考题的奥秘解读和拓展">农杆菌转化法中的“Ti质粒转化载体系统”的简介——一道江苏高考题的奥秘解读和拓展中学生物学(2022年7期)2022-09-07土槿皮乙酸对血管内皮细胞迁移和细胞骨架的影响世界科学技术-中医药现代化(2022年3期)2022-08-22全基因组测序后质粒的组装与鉴定研究进展*成都医学院学报(2022年4期)2022-08-19溶酶体组织蛋白酶B增加自噬保护缺氧诱导的心脏微血管内皮细胞损伤中国药理学通报(2022年1期)2022-01-14HMGB1基因对高糖诱导的血管内皮细胞损伤的影响现代临床医学(2021年5期)2021-11-02mcr-1阳性类噬菌体质粒与F33∶A-∶B-质粒共整合形成的融合质粒的生物学特性分析江西农业学报(2021年4期)2021-04-20例析阴性对照与阳性对照在高中生物实验教学中的应用看世界·学术下半月(2020年7期)2020-09-10推荐访问:靶向 内皮 冠心病