基于高通量测序筛选分枝(瓜)列当甜瓜寄生体系中的转移miRNA
来源:优秀文章 发布时间:2023-01-23 点击:
孙畅,姚兆群,曹小蕾,卞鹏轩,刘倩倩,赵思峰
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆 石河子 832003)
甜瓜(CucumismeloL.)是重要的园艺类水果作物,其果实深受各国消费者喜爱,是新疆特色优势产业之一,2019年种植面积57.76 khm2,总产量达215.6万t[1]。分枝(瓜)列当(PhelipancheaegyptiacaPers)是新疆部分甜瓜产区的主要威胁,轻者导致甜瓜大幅减产,严重时绝收[2-3]。瓜列当具有种子库庞大、种子微小、休眠时间长及植株通过吸器与寄主植物维管束连接等特点,导致难以防治[4]。吸器是寄生植物连接寄主的桥梁和通道,具有连接、侵入并从寄主获取各种物质的功能,同时也是寄生植物与寄主进行sRNAs、mRNAs、病毒、糖类、蛋白质等物质交流的场所[5-8]。目前对分枝(瓜)列当甜瓜寄生体系中miRNAs在吸器中的转移情况及转移miRNAs的功能了解较少。
microRNA(miRNA)是植物体内普遍存在的一类内源性单链20~40 nt非编码RNA,其在植物生长发育、激素信号转导及胁迫响应等方面的都发挥重要调控作用,甚至可跨界调控其他物种体内基因的表达[9-12]。Shahid等[6]报道菟丝子miRNA能通过吸器转移到与其联接的寄主的茎,并干扰寄主miRNA和phasiRNA表达。Betti等[9]发现施加外源miRNA可以引发靶基因的沉默和受体植物表型的改变。此外,在植物受病毒、真菌及昆虫危害时,植物miRNA表达量会显著改变,这些miRNA可能参与了植物免疫反应[13-15]。Zhang等[16]发现棉花miR159和miR166在感染黄萎病菌后转移至大丽轮枝菌(V.dahliaeKleb)中,通过结合和沉默与毒力相关的蛋白HIC-15(异毛菌素C-15羟化酶)和CLP-1(Ca2+半胱氨酸蛋白酶)增强棉花对大丽轮枝菌的抗性。Wang等[17]研究表明小麦条锈病菌(Pucciniastriiformisf. sp.tritici)的Pst-milR1在侵染小麦时转移至小麦体内,通过结合Pr2参与跨域RNA干扰,从而降低小麦抗性。列当在寄生寄主植物的过程中不仅从寄主中吸取营养物质同样也存在大分子物质和寄主基因的转移[5,18]。本试验以分枝(瓜)列当甜瓜寄生体系为研究对象,分别对寄生有瓜列当的甜瓜根部、瓜列当寄生于甜瓜的寄生部位和列当茎秆取样,以未接种列当的甜瓜根部为对照,进行sRNA测序,以期筛选出瓜列当在寄生甜瓜过程中的miRNA,为进一步揭示瓜列当的寄生分子机制、甜瓜抗性分子机制及甜瓜抗性遗传改良奠定基础。
1.1 材料
供试植株甜瓜品种“黄旦子”种子购买于新疆昌吉市益丰种苗有限责任公司,瓜列当植株及种子采集于塔城地区额敏县,已鉴定为分枝(瓜)列当。
1.2 植物处理和取样
在混有蛭石和沙子(1∶1)基质的花盆(口径:16 cm,高度:12.5 cm)中拌入瓜列当种子0.02 g,用水浸透,每盆播种1~2粒提前浸泡露白的甜瓜种子,以未拌入瓜列当种子处理作为对照,各10次重复。将播种好的各处理盆栽随机摆放,置于温室中培养(温度28 ℃,光照度为10 000 lx,光照时长16 h·d-1,黑暗8 h·d-1),正常浇水管理。于瓜列当刚出土时用蒸馏水迅速洗根进行取样,分别选取被寄生的甜瓜根系(MR)、瓜列当寄生部位(MC)、寄生点上方2~3 cm的列当茎秆(MP)和未接种的对照甜瓜根部(MK)4部分,取样时期与部位见图1,各样品3个重复,取样后将样品组织置于液氮中速冻后存于-80 ℃备用。
1.3 Small RNA文库构建和测序
用EasyPure®Plant RNA 提取试剂盒(全式金公司)提取样品总RNA,琼脂糖凝胶电泳检测RNA的纯度和完整性,并用超微量核酸蛋白分析仪定量检测RNA的浓度。采用Small RNA Sample Pre Kit试剂盒(武汉锦奥生物科技有限公司)构建文库,库检合格后交由北京诺禾致源科技股份有限公司使用Illumina SE50 进行sRNA测序。

A:生长45 d的对照甜瓜植株;
B:生长45 d接种列当的甜瓜植株;
C:A图洗根后的取样图示,MR:列当寄生甜瓜根;
MC:列当寄生点;
MP:列当茎秆。图1 样品取样时期与部位
1.4 测序数据统计分析
用Illumina Casava 1.8检查数据错误率,碱基位置测序错误率低于0.5%视为合格。用Cutadapt 1.9.1(https:∥cutadapt.readthedocs.io/en/stable/index.html)去除原始数据中含polyA/T/G/C、质量值sQ ≤20、未知碱基N的比例大于10%的低质量reads及接头(5’端接头5’-GTTCAGAGTTCTACAGTCCGACGATC-3’;3’端接头5’-AGATACGGAAGAGCACACGTCT-3’)序列,并对过滤后的clean reads进行18~22 nt长度筛选。采用bowtie 1.3.0(http:∥bowtie-bio.sourceforge.net/manual.shtml)将长度筛选后的miRNA定位到甜瓜基因组数据库(Melon v3.6.1 Genome)中进行比对,获取已知miRNA的二级结构,各样本中miRNA的序列、长度及表达量等信息。利用mirDeep2 2.0.0.2(https:∥github.com/rajewsky-lab/mirdeep2.gitmirdeep2.0.0.2)根据前体序列预测新miRNA并获取其二级结构等信息。
1.5 miRNA筛选
筛选寄生甜瓜根(MR)、寄生部位(MC)、瓜列当茎秆(MP)及未寄生甜瓜根(MK)测序结果中同时存在的miRNA,至甜瓜基因组(Melon v3.6.1 Genome)中比对,选取mapping成功且测序结果表达量>10的miRNA,用bowtie2 2.3.4.1(http:∥bowtie-bio.sourceforge.net/bowtie2/manual.shtml)将其映射至瓜列当基因组(本课题组前期测序)中,从中筛选unmapping的miRNA,即甜瓜转移至瓜列当的miRNA。此外筛选寄生甜瓜根(MR)、寄生部位(MC)、瓜列当茎秆(MP)及未寄生甜瓜根(MK)测序结果中同时存在,而寄生甜瓜根(MR)中没有的miRNA,将其在瓜列当基因组中进行比对,选取mapping成功且测序结果表达量>10的miRNA,利用bowtie2将其映射至甜瓜基因组(Melon v3.6.1 Genome)中,从中筛选unmapping的miRNA,即瓜列当转移至甜瓜的miRNA。
1.6 qRT-PCR验证
样品总RNA经DNase I处理后,利用RransScriptGreen miRNA Two-Step qRT-PCR SuperMix 试剂盒(全式金公司)合成cDNA,20 μL反应体系:Total RNA(100 ng·μL-1)2 μL;
TransScript miRNA RT Enzyme Mix 1 μL;
2×TS miRNA Reaction Mix 10 μL;
RNase-free Water 7 μL。反应条件:37 ℃孵育1 h,85 ℃处理5 s。随机选取差异miRNA,通过Primer 5.5.0(http:∥www.premierbiosoft.com/primerdesign/)软件设计引物,引物详情见表1。通过ABI Prism 7500定量PCR仪进行qRT-PCR,20 μL反应体系:cDNA 2 μL、2×PerfectStartTMGreen qPCR SuperMix 10 μL、特异性上游引物(10 μM)0.4 μL、Universal miRNA qPCR Primer(10 μM)0.4 μL、Passive Reference Dye(50×) 0.4 μL、Nuclease-free Water 6.8 μL。反应条件:94 ℃预变性30 s;
94 ℃扩增5 s,60 ℃退火15 s,72 ℃延伸10 s,40个循环;
95 ℃变性15 s,55 ℃复性15 s。以U6-3(LOC103502534)基因为内参[19],每个样品3个重复,采用 2-△△CT法[20]计算各样品中目标miRNA的相对表达量。

表1 qRT-PCR引物
2.1 sRNA测序结果与分析
经Illumina SE50平台测序共构建12个甜瓜sRNA文库,获得15 991 946条raw reads,经质控后共获得了156 832 594条clean reads,各样本的Q20>99%,Q30>96%,GC含量范围为48.93%~54.66%,测序错误率占比0.01%,低质量读数平均占比0.17%。长度筛选后各文库sRNA占比为63.89%,平均序列长度为22 nt(图2)。对sRNA进行注释后共获得495 255条已知miRNA和13 370条新的miRNA,总miRNA的占比8.2%,仍有22.01%的sRNA在甜瓜基因组中未注释,表明有大量sRNA有待挖掘(表2)。

MR:列当寄生甜瓜根;
MC:列当寄生点;
MP:列当茎秆。图2 样品sRNA长度分布频率
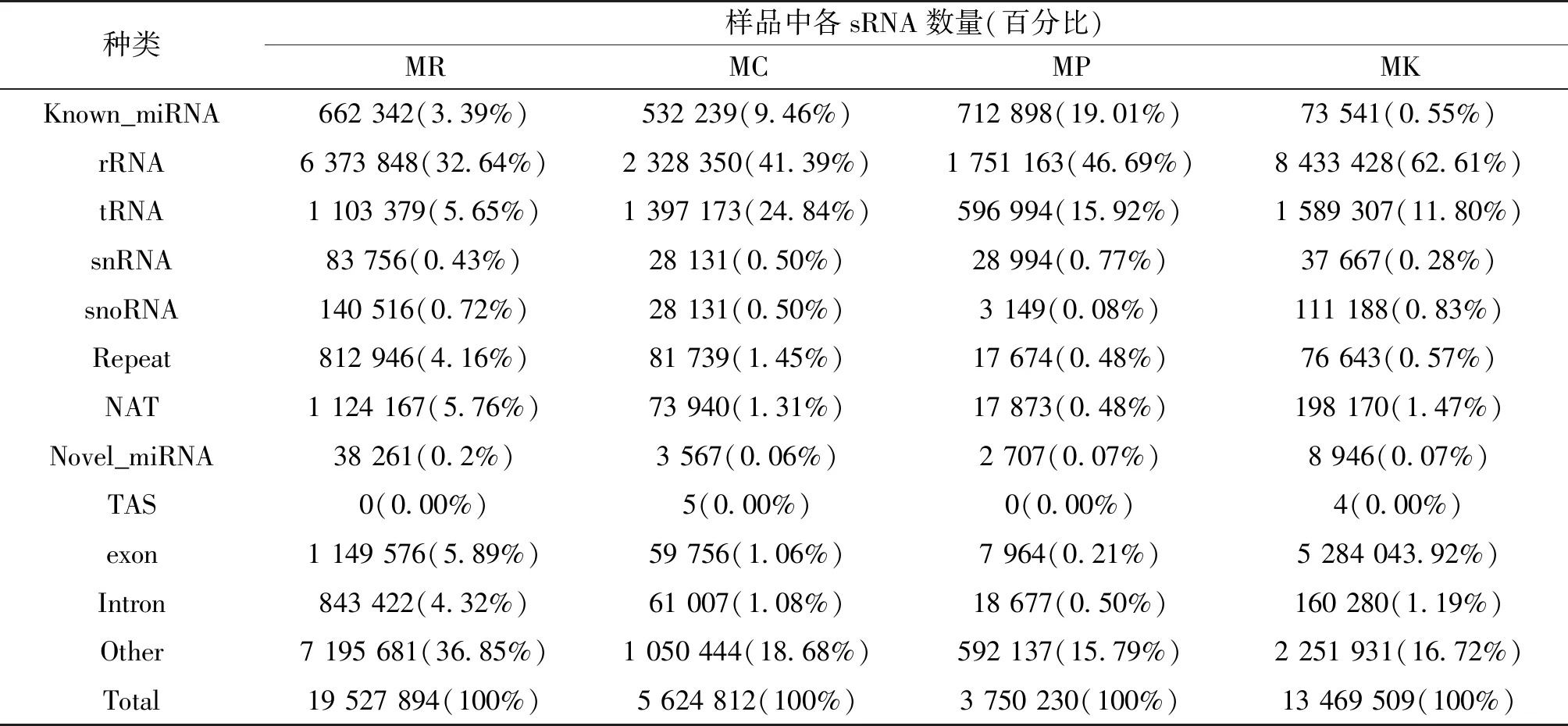
表2 sRNA注释数量统计及占比结果
2.2 miRNA的注释分析
以miRBase数据库对miRNA进行注释分析,显示12个文库中除MP外的9个文库新miRNA种类比已知miRNA更丰富(图3A),说明有待研究注释的miRNA较多。本研究共注释到216个miRNA,这些miRNA分别隶属于13个miRNA家族,内部成员包含1~6个不等,其中以MIR399家族成员最多,该家族主要与磷酸盐信号通路相关[21],包含cme-miR399a、cme-miR399b、cme-miR399c、cme-miR399d、cme-miR399e、cme-miR399f和cme-miR399g共6个成员(图3C)。对miRNA二级结构和miRNA的碱基偏好性进行预测和分析表明,miRNA前体具有茎环二级结构、3’端有2 nt的悬垂(图3B),且碱基1位对U有强偏好,10位对A有较强偏好(图3D),符合miRNA的碱基偏好性规律,说明测序得到的miRNA质量和可信度均较高,可用于后续实验分析。
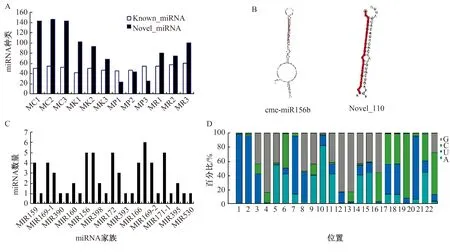
A:不同样品已知及新miRNA种类;
B:miRNA二级结构示意图,整个序列是miRNA前体,红色突出部分为成熟体序列;
C:样品中miRNA家族成员及其成员数;
D:miRNA碱基偏好性示意图。图3 miRNA注释结果分析
2.3 差异miRNA及靶基因富集分析
植物遭受生物胁迫时会启动自身的免疫防御系统,通过对病程相关蛋白(pathogenesis-related protein,PR蛋白)、和抗病基因(resistance gene,R基因)的调控阻止有害生物胁迫[22]。高通量测序筛选生物胁迫中产生的差异基因,并对其靶基因进行注释和分析,可以快速预测差异基因的生物学功能,从而进一步了解植物的抗生物胁迫的分子过程。对MR和MK的miRNA差异表达分析结果表明,与MK相比,MR共产生了35个差异miRNA,包括19个已知miRNA和16个新miRNA,其中17个基因显著下调表达,主要参与LRR受体样丝氨酸/苏氨酸蛋白激酶和谷胱氨态还原酶的产生;
18个基因显著上调表达(图4),主要参与介导脱落酸(ABA)与赤霉素(GA)信号、转录因子的产生和DCL酶的合成。表明甜瓜可能通过这些差异miRNA介导寄主的防御相关激素和相关基因的转录来抵御列当的寄生。

横坐标表示甜瓜被瓜列当寄生后的miRNA表达倍数变化(log2FoldChange,P<0.05);
纵坐标表示表达差异的显著性水平(log10 p-value,P<0.05);
表达上调miRNA用红色点表示,下调miRNA用蓝色点表示,灰色点为未发生显著变化。图4 甜瓜被瓜列当寄生后差异miRNA火山图
对瓜列当-甜瓜寄生系统中的差异基因的靶基因进行GO富集,显示这些靶基因参与了1 547个生物学功能条目,368个细胞组分条目和785个分子功能条目,离子结合(ion binding)、杂环化合物结合(heterocyclic compound binding)、结合(binding)、有机环化合物结合(organic cyclic compound binding)、铜离子结合(copper ion binding)5个分子功能条目显著富集,其中binding条目富集靶基因最多,有1 045个靶基因(图5),表明甜瓜在被瓜列当寄生后通过分子功能中涉及寄生和发育相关化合物基因的表达启动植物免疫反应调控通路。
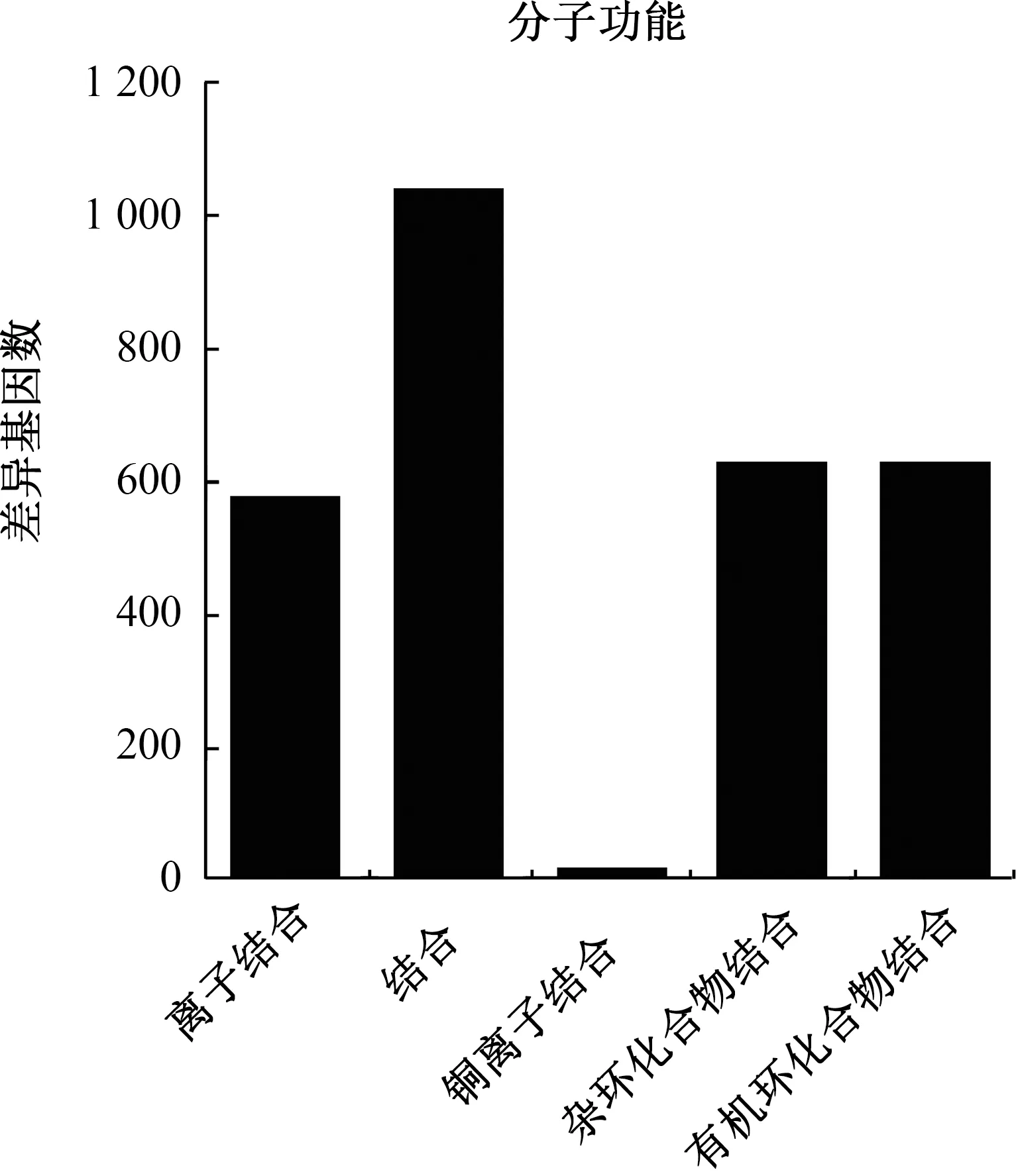
横坐标为GO功能条目,纵坐标为差异基因数量。图5 差异miRNA靶基因GO功能注释图
对差异基因的靶基因进行KEGG富集,显示相关靶基因在油菜素内酯的生物合成(Brassinosteroid biosynthesis)、丙酸代谢(Propanoate metabolism)、乙醚脂质代谢(Ether lipid metabolism)、mRNA监测途径(mRNA surveillance pathway)、丙酮酸代谢(Pyruvate metabolism)、脂肪酸代谢(Fatty acid metabolism)、磷酸肌醇代谢(Inositol phosphate metabolism)、昼夜节律-植物(Circadianrhythm-plant)中极显著富集,在胞吞作用(Endocytosis)、亚油酸代谢(Linoleic acid metabolism)、RNA转运(RNA transport)、α-亚麻酸代谢(alpha-Linolenic acid metabolism)、脂肪酸降解(Fatty acid degradation)、脂肪酸生物合成(Fatty acid biosynthesis)、剪切体(Spliceosome)和嘌呤代谢(Purine metabolism)中显著富集(图6)。其中油菜素内酯作为一种多羟基甾体植物激素,不仅在植物的生长、发育和对不同环境胁迫的反应中起着重要作用[23],还能够通过降低H2O2的积累和提高苯丙氨酸解氨酶(PAL)的活性来增强植物对病原菌的抗病性[24]。脂肪酸是植物表面蜡、角质及木栓质的重要组成部分,这些结构可以改变组织厚度和渗透性以保护植物免受环境胁迫和微生物的侵袭[25],已有研究表明[26]细胞外囊泡(Extracellular Vesicles, EVs)会装载特定的miRNA,为miRNA的长距离跨物种转移途径提供了有利证据,这些EVs是否通过胞吞作用进入另一生物细胞内尚不得而知,但本试验结果为这一猜想提供了一定可能。以上证据表明这些差异表达miRNA在甜瓜抵御列当入侵中发挥重要作用。
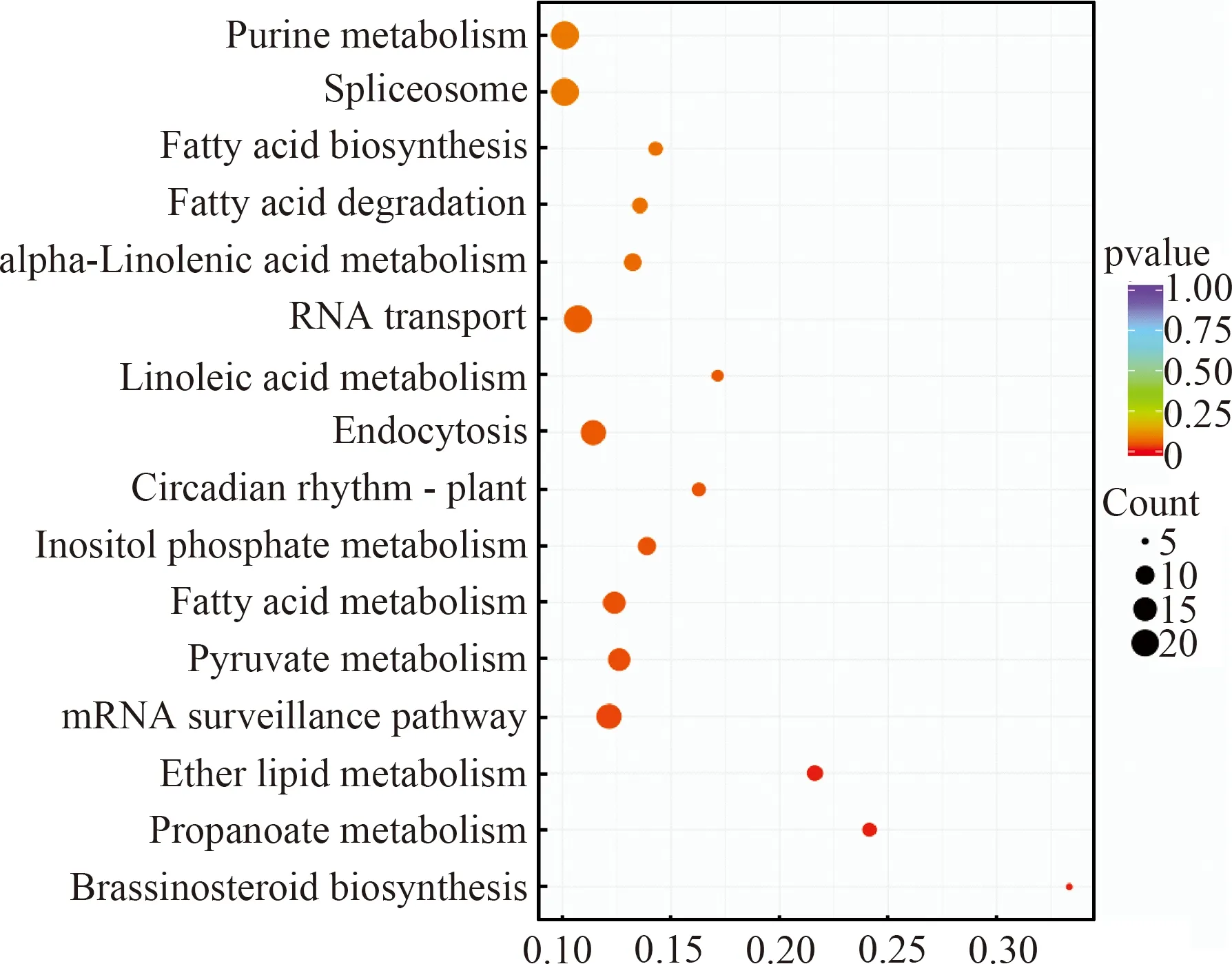
横坐标代表差异基因中与该Term相关的基因数与整个差异基因总数的比值,纵坐标为KEGG注释通路,圆点大小代表该通路基因数量,p-value ≤ 0.1。图6 差异miRNA靶基因KEGG功能注释图
2.4 转移miRNA筛选结果
通过对转移miRNA的筛选,共鉴定到3个从甜瓜转移至列当的已知miRNA和3个从列当转移至甜瓜新的miRNA(表3)。其中3个已知miRNA分别为cme-miR162、cme-miR398a和cme-miR169r,这些miRNA主要涉及DCL酶剪切体、RNA转运和胞吞作用;
3个新的miRNA分别为novel_2、novel_56和novel_8,其功能主要涉及甾醇生物合成、pre-mRNA剪切蛋白和LRR丝氨酸/苏氨酸受体样激酶的合成,LRR丝氨酸/苏氨酸受体样激酶可以将胞外信号传入胞内从而影响基因转录[27]。从这些转移miRNA的功能推测,由甜瓜转移至瓜列当的miRNA可能通过影响列当的miRNA的生物合成来抑制列当的生长,而瓜列当转移至甜瓜的miRNA则可能通过本身毒力因子和阻止甜瓜mRNA的合成来抑制甜瓜防御相关基因的表达。
2.5 差异基因及转移miRNA的qRT-PCR验证
随机选取了13个差异基因及转移miRNA对其相对表达量进行qRT-PCR验证,结果显示所选取基因的qRT-PCR结果与sRNA测序含量尽管存在差异,但其在各样品中的表达趋势具有一致性(图7),说明sRNA测序结果可靠,转移miRNA的筛选结果可信。

表3 转移miRNA及靶基因注释信息

图7 差异转移miRNA(A)及差异miRNA(B)相对表达量qRT-PCR验证
已有大量文献证实寄主和寄生物之间存在复杂的物质转移,这些物质在转移后会对双方产生重要影响。Jiang等[28]研究表明菟丝子通过从过表达磷脂酶乙酰转移酶(PAT)基因的转基因宿主获得对草甘膦的瞬时抗性,而大豆蚜虫(Aphisglycines)取食寄生大豆的菟丝子后诱导了寄主大豆的系统防御反应,从而增强了大豆植株对斜纹夜蛾(Spodopteralitura)和大豆蚜虫的抗性[29]。Zhang等[30]发现N系统信号可以通过菟丝子在缺N植株和N充足植株间双向转运,从而导致N充足植株对N的吸收增加,这些N系统信号还诱导了菟丝子和寄主之间许多远距离移动的mRNA转移。列当作为寄生在寄主根部的全寄生性植物,同样存在着大量转移物质,Kado等[31]研究检测了列当科的五种寄生植物,在Orobancheminor和Aeginetiaindica中共检测到了106个水平基因转移(HGT),HGT基因分别约占编码基因的0.1%和0.2%。Aly[5]发现当表达GFP的转基因番茄植株被瓜列当寄生时,大量的GFP从寄主韧皮部转移到列当韧皮部,并在列当根瘤和茎秆中积累。另外黄瓜花叶病毒(CMV)、番茄花叶病毒(ToMV)、马铃薯Y病毒(PVY)和黄曲叶病毒(TYLCV)也被证明可从受侵染的寄主植物转移到瓜列当上[32]。这些证据表明在寄生植物和寄主间双向交流的大分子物质在其寄生体系中具有重要作用,但目前对列当与寄主间其他物质转移仍有待研究。
miRNA可以通过宿主转移至寄生性生物体内,通过RNA干扰(RNAi)提高寄主对寄生生物的抗性[16]。Shahid等[6]研究表明菟丝子在寄生拟南芥和本氏烟时积累了大量新的miRNA,这些miRNAs作为寄主基因表达的跨物种调节因子,在寄生过程中可能发挥毒力因子的作用。但瓜列当在寄生甜瓜的过程中是否以miRNA复合体进行长距离移动尚有待研究[33]。本研究结果显示sRNA测序在列当与甜瓜根部寄生界面(MC)中显著富集为22 nt长度的miRNA,这与Shahid的研究结果相似[6]。筛选到的转移miRNA之一miR162在被寄生甜瓜根中显著上调表达并由甜瓜转移至列当体内,而miR162的过表达可以抑制DCL1的表达[34],Dicer-like(DCL)酶是miRNA生物合成的必备物质[35],能够参与发育调节[36]、表观遗传修饰[37]、以及在生物和非生物胁迫中发挥重要作用[38,39]。而DCL1的沉默不仅导致水稻苗期生长发育停滞,而且还能够诱导防御免疫反应,包括H2O2的积累和细胞的死亡从而抑制稻瘟病菌(Magnaportheoryzae)的扩展,增强水稻对稻瘟病的抗性[40]。因此推测甜瓜可能通过miR162的过表达以启动自身防御免疫的应答,并转移至列当,负调控列当miRNA的产生,从而影响列当的生长发育和寄生过程。而miR398a主要参与活性氧清除酶Cu/Zn超氧化物歧化酶基因的负调控,寄生体毒性与致病力越强,miR398a上调幅度越大,最终导致被寄生处宿主的细胞因ROS过多而死亡[41]。甜瓜在被列当寄生后导致根部miR398a的显著表达,表明miR398a可能通过抑制寄生根部细胞ROS酶的活性,增加了寄生部位细胞ROS含量,最终导致被寄生细胞因死亡限制列当的寄生,miR398a的转移也可能能够通过使列当细胞的坏死来限制列当的生长。
从瓜列当转移至甜瓜的novel_2主要靶向STABILIZED1蛋白,该蛋白是pre-mRNA的剪切和mRNA转录所必需的[42],novel_56则与钙离子合成蛋白PICBP有关,钙离子合成蛋白在Ca2+信号传导系统传导中具有重要作用,可以调控生理代谢及基因表达,控制细胞正常的生长和发育[43]。因此,瓜列当可能通过转移miRNA调控甜瓜mRNA的合成与转录及抑制防御相关信号的传导促进自身生长。
本研究结果表明瓜列当在寄生甜瓜的过程中确实存在miRNA转移的现象,且这一现象并不单一存在于寄主或寄生物一方,而是相互均有转移,共筛选到3个已知甜瓜miRNA转移至瓜列当(cme-miR162、cme-miR398a、cme-miR169r),3个新瓜列当miRNA转移至甜瓜(novel_2、novel_56、novel_8),甜瓜作为寄主可能通过miRNA的转移来抑制或限制列当的寄生,列当作为全寄生植物也可能会利用miRNA的转移来抑制寄主防御反应的信号应答。本试验从miRNA转移的角度,为进一步揭示瓜列当寄生甜瓜的分子机制提供了一定理论基础。
猜你喜欢 差异基因甜瓜测序 甜瓜的重量小猕猴智力画刊(2022年9期)2022-11-04两种高通量测序平台应用于不同SARS-CoV-2变异株的对比研究中国人兽共患病学报(2022年9期)2022-10-19生物测序走在前科学导报(2021年29期)2021-06-03外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2020年4期)2021-01-18基于RNA 测序研究人参二醇对大鼠心血管内皮细胞基因表达的影响 (正文见第26 页)心电与循环(2020年1期)2020-02-27基因测序技术研究进展科海故事博览·下旬刊(2019年6期)2019-04-16紫檀芪处理对酿酒酵母基因组表达变化的影响江苏农业科学(2017年5期)2017-04-15我喜欢吃甜瓜创新作文(1-2年级)(2014年11期)2014-11-25SSH技术在丝状真菌功能基因筛选中的应用湖北农业科学(2014年3期)2014-07-21肾阳虚证骨关节炎温针疗效的差异基因表达谱研究云南中医学院学报(2011年4期)2011-07-31推荐访问:分枝 甜瓜 寄生