STEAP3在脑缺血再灌注损伤沙鼠中的表达及意义
来源:优秀文章 发布时间:2023-04-28 点击:
李晓蕾,李忠华,王鹏
(1.贵州医科大学第三附属医院实验中心,贵州 都匀 558000;
2.贵州医科大学第三附属医院神经外科,贵州 都匀 558000;
3.哈尔滨医科大学大庆校区基础医学院生理学教研室,哈尔滨 大庆 163319)
脑缺血再灌注(ischemia-reperfusion,I/R)损伤是缺血性脑卒中后一定时间内恢复或重建血液再灌注,使原有的缺血性损伤进一步加重的现象,与缺血性脑卒中后的致残率和死亡率密切相关[1]。脑I/R损伤可发生于缺血后数小时至数天,最终导致神经元损伤,与氧化应激、炎症反应等相关[2]。进一步明确脑I/R损伤的发生机制,制定有效的防治措施,是脑卒中研究有待解决的重要问题。铁离子广泛存在于脑组织中,脑缺血时脑组织中铁离子含量增加,神经元脂质过氧化,细胞死亡增多。研究[3]表明,铁代谢和脂质代谢调控信号异常均能导致铁死亡的发生,说明铁死亡在脑I/R损伤中发挥关键作用。前列腺六跨膜上皮抗原3(six-transmembrane epithelial antigen of prostate 3,STEAP3)属 于STEAP家 族,是一种铁还原酶,在铁代谢过程中能够促进Fe3+还原成Fe2+,影响铁稳态、炎症、细胞增殖等过程[4]。研究[5]发现,敲除STEAP3表达通过抑制TAK1途径而减轻肝脏I/R损伤。然而,STEAP3在脑I/R损伤中的表达及其与铁死亡是否有关未见报道。本研究基于铁死亡,分析STEAP3在沙鼠脑I/R损伤中的表达及意义。
1.1 实验动物和分组
48只健康雄性蒙古沙鼠,体质量60~80 g,4~5月龄,由哈尔滨医科大学大庆校区机能实验室提供。动物饲养实验室温度(24±1)℃,湿度45%~70%。将48只沙鼠随机分为假手术组(Sham组)、I/R模型组(I/R组)、I/R模型+STEAP3小干扰RNA(small interfering RNA,siRNA)组(siRNA组)和I/R模型+scramble siRNA组(Control组),每组12只。
1.2 主要试剂
STEAP3和4-HNE购自英国Abcam公司;
H2AX购自美国Cell signaling公司;
谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)购自美国Santa Cruz公司;
GAPDH购自北京中杉金桥生物技术有限公司。Nissl、丙二醛(malondialdehyde,MDA)和Fe2+试剂盒购自南京建成生物工程研究所;
BCA试剂盒购自上海碧云天生物技术公司。STEAP3 siRNA和scramble siRNA购自上海吉玛制药技术有限公司,X-treme GENE siRNA转染试剂购自美国罗氏公司。
1.3 沙鼠脑I/R损伤模型的建立
沙鼠腹腔注射1%戊巴比妥钠(40 mg/kg)进行麻醉。麻醉后仰卧位固定,剪去颈部的毛,再剪开皮肤,分离皮下组织和肌肉,显示出两侧颈总动脉,使用无创微动脉夹夹闭双侧颈总动脉5 min。松开动脉夹,使脑血流恢复。Sham组不夹闭两侧颈总动脉,其他操作同I/R组。siRNA组和Control组沙鼠在手术前24 h分别尾静脉注射STEAP3 siRNA和scramble siRNA,其他操作同I/R组。
1.4 神经功能评分
建模后24 h,参考文献[6]进行神经功能评分:无症状,0分;
身体蜷缩或毛发凌乱,1分;
眼睑下垂,2分;
旋转行为,3分;
后肢外翻,4分;
痉挛,5分。分值越高,说明沙鼠神经功能损伤情况越严重。
1.5 Nissl染色
沙鼠腹腔注射1%戊巴比妥钠(40 mg/kg)进行麻醉,断头取脑,分离海马组织,用于后续实验。每组随机选取6只沙鼠的海马组织,制成石蜡切片。切片脱蜡至水后,滴加Nissl染色液,37 ℃孵育10 min,蒸馏水洗3次,梯度乙醇脱水,二甲苯透明2次,10 min/次,中性树脂胶封片。
1.6 Fe2+和MDA水平测定
每组随机选取6只沙鼠海马组织,称重后用生理盐水制成10%的匀浆,离心后取上清。根据试剂盒说明书检测Fe2+和MDA水平。
1.7 Western blotting检测STEAP3、H2AX、4-HNE、GPX4蛋白的表达
收集沙鼠的海马组织,提取总蛋白,测定浓度。经SDS-PAGE凝胶电泳、转膜、封闭后,分别用STEAP3(1∶100)、H2AX(1∶100)、4-HNE(1∶200)、GPX4(1∶500)抗体4 ℃孵育过夜,洗膜后二抗室温孵育,ECL显色成像。通过图像分析软件进行积分吸光度分析。
1.8 统计学分析
2.1 STEAP3在脑I/R沙鼠海马组织中的表达
采用Western blotting检测Sham组和I/R组沙鼠海马组织中STEAP3蛋白的表达。结果显示,I/R组STEAP3蛋白的表达高于Sham组(P< 0.05),见图1。提示STEAP3蛋白高表达可能与脑I/R损伤相关。

图1 Western blotting检测STEAP3蛋白的表达Fig.1 Expression of STEAP3 protein detected using Western blotting
2.2 STEAP3干扰后对脑I/R沙鼠神经功能评分的影响
脑I/R后24 h进行神经功能评分。Sham组沙鼠无神经功能缺损的症状,神经功能评分为0分;
I/R组沙鼠神经功能受到不同程度损伤,出现身体蜷缩、眼睑下垂、旋转行为、后肢外翻及痉挛等,神经功能评分为(3.58±1.24)分;
siRNA组沙鼠主要表现为身体蜷缩、毛发凌乱和眼睑下垂等,神经功能评分为(2.58±0.90)分;
Control组沙鼠表现与I/R组相同,神经功能评分为(3.50±1.09)分。I/R组神经功能评分明显高于Sham组(P< 0.01),与Control组比较无统计学差异(P> 0.05);
siRNA组神经功能评分低于I/R组(P< 0.01)和Control组(P< 0.05)。
2.3 STEAP3干扰后脑I/R沙鼠海马组织中STEAP3和H2AX的表达
Western blotting检测沙鼠海马组织中STEAP3蛋白和细胞DNA损伤指标H2AX蛋白的表达情况。结果显示,I/R组STEAP3蛋白和H2AX蛋白的表达明显高 于Sham组(P< 0.05,P< 0.01),siRNA组STEAP3蛋白和H2AX蛋白的表达明显低于I/R组(均P< 0.01)和Control组(P< 0.05,P< 0.01),I/R组 与Control组 比较差异无统计学意义(均P> 0.05)。见图2。

图2 Western blotting检测STEAP3蛋白和H2AX蛋白的表达水平Fig.2 Expression of STEAP3 and H2AX proteins detected using Western blotting
2.4 STEAP3干扰后对脑I/R沙鼠海马神经元损伤的影响
Nissl染色(图3A)显示各组沙鼠海马组织CA1区神经元损伤情况:Sham组神经元形态结构正常;
I/R组和Control组神经元轮廓模糊,部分神经元丢失;
siRNA组与I/R组比较,神经元数量增多,结构轮廓比较清晰。显微镜下计数各组海马组织CA1区神经元数量,结果(图3B)显示,I/R组神经元数量明显低于Sham组(P< 0.01),siRNA组神经元数量明显增多于I/R组和Control组(P< 0.01),Control组与I/R组比较差异无统计学意义(P> 0.05)。
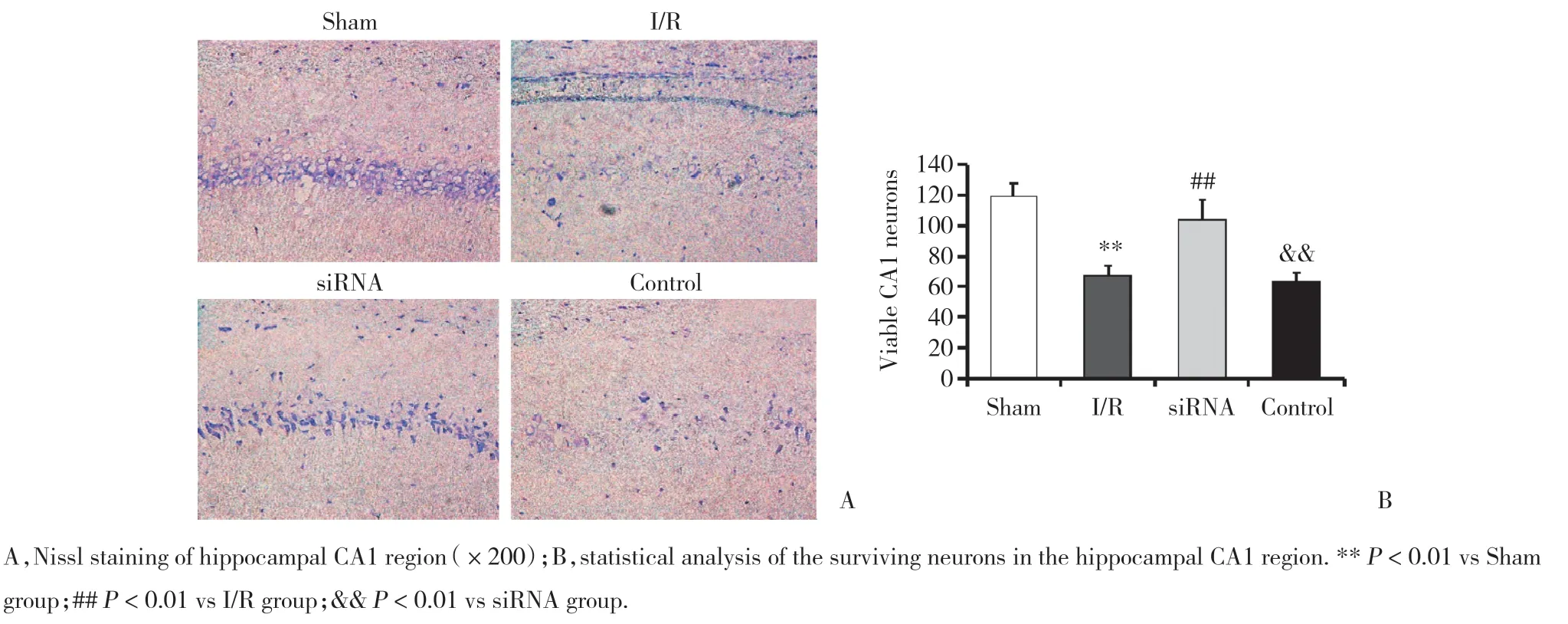
图3 STEAP3对脑I/R沙鼠海马神经元损伤的影响Fig.3 Effects of STEAP3 on hippocampal neuron injury of gerbils with cerebral I/R
2.5 STEAP3干扰后对脑I/R沙鼠海马组织中GPX4蛋白表达的影响
GPX4为铁死亡相关蛋白,应用Western blotting检测各组沙鼠海马组织中GPX4的表达情况,结果(图4)显示,I/R组与Sham组比较GPX4蛋白表达明显减少(P< 0.01),siRNA组GPX4蛋白表达明显高于I/R组(P< 0.05)和Control组(P< 0.01),Control组与I/R组比较差异无统计学意义(P> 0.05)。
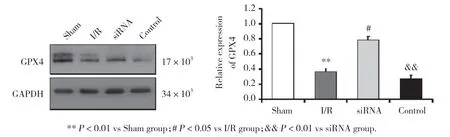
图4 STEAP3对脑I/R沙鼠海马组织中GPX4蛋白表达的影响Fig.4 Effects of STEAP3 on the expression of GPX4 protein in the hippocampus of gerbils with cerebral I/R
2.6 STEAP3干扰后对脑I/R沙鼠海马组织中Fe2+的影响
应用Fe2+试剂盒检测沙鼠海马组织中的Fe2+,结果(图5)显示,I/R组与Sham组比较Fe2+水平明显升高(P< 0.01),siRNA组Fe2+水平明显下降,明显低于I/R组和Control组(P< 0.01),Control组与I/R组比较差异无统计学意义(P> 0.05)。
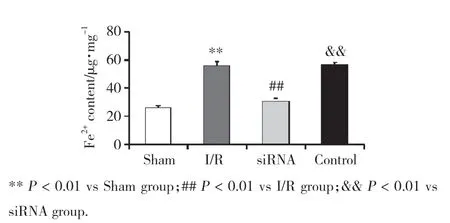
图5 STEAP3对脑I/R沙鼠海马组织中Fe2+水平的影响Fig.5 Effects of STEAP3 on the Fe2+ levels in the hippocampus of gerbils with cerebral I/R
2.7 STEAP3干扰后对脑I/R沙鼠海马组织中4-HNE表达和MDA含量的影响
为了分析STEAP3对细胞脂质氧化的影响,首先应用Western blotting检测4-HNE蛋白的表达,结果(图6A)显示,I/R组4-HNE蛋白表达明显高于Sham组(P< 0.05),而敲除STEAP3后siRNA组4-HNE蛋白表达低于I/R组和Control组(P< 0.05),Control组与I/R组比较差异无统计学意义(P> 0.05)。接下来应用MDA试剂盒检测MDA含量,结果(图6B)显示,I/R组脑组织MDA含量明显高于Sham组(P< 0.01),而siRNA组MDA含量明显低于I/R组和Control组(P<0.01),Control组与I/R组比较差异无统计学意义(P>0.05)。

图6 STEAP3对脑I/R沙鼠海马组织中4-HNE蛋白表达和MDA含量的影响Fig.6 Effects of STEAP3 on the expression of 4-HNE protein and MDA content in the hippocampus of gerbils with cerebral I/R
脑是机体重要的器官之一,对缺氧的耐受能力差,缺血数分钟就会造成不可逆性损伤。但在缺血后一定时间内恢复脑血液灌注,会加重缺血脑组织不可逆性损伤[7]。脑缺血再灌注损伤与缺血性脑卒中后的致残率和死亡率密切相关,深入阐明脑I/R损伤的发生机制,能够为临床治疗提供重要参考,减轻再灌注导致的脑组织损伤程度。本研究发现,铁还原酶STEAP3在沙鼠脑I/R模型中高表达,敲除其表达可明显减轻脑组织损伤,说明STEAP3能够促进脑I/R损伤的发生;
通过检测铁死亡相关指标GPX4、Fe2+、4-HNE、MDA,发现脑I/R损伤中STEAP3可能通过铁死亡途径发挥作用。
短暂的缺血性低灌注可导致严重的急性脑损伤。脑组织再灌注过程中,多种复杂的机制可诱导神经元死亡,导致迟发性神经损伤。大量研究已经证实,在脑I/R引起的神经元损伤中,铁死亡是神经元死亡的主要形式之一。铁死亡是基于细胞内亚铁的细胞死亡方式,在生物化学、形态和遗传上与凋亡、坏死和自噬不同[8],铁和氧化还原代谢的多种因素导致了铁死亡。
STEAP家族包括4个多通道膜蛋白,最初被报道为铁稳态调节因子,并已被确定参与许多细胞和分子事件,如细胞命运和炎症反应。STEAP3作为该家族的主要成员之一,已被证实参与了铁稳态、外泌体的组装和分泌、炎症等一些生物学过程[9]。本研究通过Western blotting检测沙鼠海马组织中STEAP3蛋白的表达,发现I/R组STEAP3蛋白的表达明显高于Sham组,提示STEAP3在脑I/R损伤中可能发挥一定的作用。为探究STEAP3的作用机制,造模前24 h给予沙鼠尾静脉注射STEAP3 siRNA(siRNA组)。siRNA组沙鼠神经功能评分和海马组织中DNA损伤指标H2AX 蛋白表达明显低于I/R组,Nissl染色也发现siRNA组海马CA1区神经元数量多于I/R组。这些结果说明,敲除STEAP3能够减轻脑I/R组织的损伤程度。
铁死亡的主要特点是铁依赖性,即细胞内游离铁增多,Fe2+提供了氧化过程所需的电子。贮铁蛋白降解释放和转铁蛋白转入增多等多种途径使大量Fe3+进入细胞内,细胞内Fe3+被还原为Fe2+,构成了体内不稳定铁池的来源,一方面通过芬顿反应直接导致脂质过氧化物增多,另一方面参与合成含铁酶类促发铁死亡[10]。STEAP3是一种铁还原酶,能够促进Fe3+还原成Fe2+。本研究证实,I/R组Fe2+增多,干扰STEAP3表达,siRNA组与I/R组比较沙鼠海马组织Fe2+水平明显降低,说明STEAP3能够影响脑I/R组织中Fe2+的水平。
GPX4被认为是铁死亡标志性蛋白,是一种将H2O2分解成水或相应醇的酶,GPX4活性降低可提高细胞质和脂质的活性氧水平,最终导致细胞铁死亡[11]。4-HNE蛋白表达和MDA含量被用来评价细胞内脂质氧化的水平。本研究也进一步证实,与Sham组比较I/R组GPX4蛋白表达减少,4-HNE蛋白表达和MDA含量增多;
而siRNA组与I/R组比较,GPX4蛋白表达增多,4-HNE蛋白表达和MDA含量减少。以上结果提示,STEAP3可能通过促进细胞内Fe3+还原为Fe2+,介导铁死亡,从而影响脑I/R损伤的发生和发展。
STEAP3是铁代谢有关的基因,与肿瘤等多种疾病有关。在肿瘤的研究中发现,STEAP3通过诱导间质转化、促进转铁蛋白受体表达和激活STAT3-FoxM1信号轴促进胶质瘤的进展[12];
STEAP3通过阻滞细胞周期G1期,抑制肝癌细胞增殖[13]。在病理性心肌肥大的研究中发现,STEAP3可阻断Rac1依赖性信号级联的激活,是病理性心肌肥大的负调节因子[14]。STEAP3在肝脏I/R损伤中的作用已被证实,并通过TAK1介导JNK/p38途径发挥功能[5]。
综上所述,本研究证实了STEAP3在沙鼠脑I/R损伤中高表达,并通过介导铁死亡而影响脑I/R损伤的发生和发展,抑制其表达对脑I/R损伤具有保护作用。
猜你喜欢沙鼠海马脑组织海马作文周刊·小学二年级版(2022年20期)2022-05-05你越追,它越远意林·少年版(2021年13期)2021-08-30海马创新作文(小学版)(2019年10期)2019-09-25长爪沙鼠全脑缺血再灌注损伤后半胱氨酰白三烯受体表达变化的研究浙江医学(2018年16期)2018-09-08小脑组织压片快速制作在组织学实验教学中的应用中国组织化学与细胞化学杂志(2017年1期)2017-06-15芒果苷对自发性高血压大鼠脑组织炎症损伤的保护作用中成药(2017年6期)2017-06-13“海马”自述小学生学习指导(低年级)(2017年5期)2017-05-04DNA双加氧酶TET2在老年痴呆动物模型脑组织中的表达及其对氧化应激中神经元的保护作用吉林大学学报(医学版)(2015年4期)2015-12-172,4-二氯苯氧乙酸对子代大鼠发育及脑组织的氧化损伤作用癌变·畸变·突变(2015年3期)2015-02-27长爪沙鼠高脂血症的初步研究实验动物与比较医学(2014年5期)2014-02-28推荐访问:灌注 损伤 表达推荐文章