cGAS抑制剂对小鼠脑缺血再灌注损伤的干预作用及其机制
来源:优秀文章 发布时间:2023-04-27 点击:
黄丽丹,李冰玉,李亚男,王苏,龚平,2
1 武汉大学人民医院麻醉科,武汉 430060;
2 武汉大学口腔医院麻醉科 口腔基础医学省部共建国家重点实验室培育基地和口腔生物医学教育部重点实验室
缺血性脑卒中是我国最常见的卒中类型,具有高发病率、高致残率、高病死率的特点[1-3]。近年来我国缺血性脑卒中患者数量持续增加且呈现发病年轻化趋势,给家庭和社会带来了沉重的压力[4-5]。寻求安全有效的治疗方案是缺血性脑卒中相关研究的重点。早期静脉溶栓或机械取栓、及时恢复脑血流是目前治疗缺血性脑卒中的首选方案,但在脑组织恢复血供后常会出现损伤进一步加重的现象,即脑缺血再灌注损伤(CIRI)[6-7]。再灌注损伤是十分复杂的级联反应,涉及多种因素与机制[8]。新近研究发现,环状GMP-AMP 合酶(cGAS)天然免疫信号通路参与再灌注损伤的激活,同时有研究表明cGAS介导的天然免疫通路与细胞自噬密切相关[9-11]。对于cGAS 天然免疫信号通路是否能通过调控细胞自噬进而参与脑缺血再灌注损伤,以及抑制cGAS 激活对缺血再灌注损伤的干预作用,目前尚不明确。2021 年9 月—2022 年6 月,本研究观察了cGAS 抑制剂RU. 521 对小鼠CIRI 的干预作用,并基于自噬相关蛋白表达调节探讨相关机制。现报告如下。
1.1 实验动物与主要材料 健康雄性C57BL/6 小鼠购自湖南斯莱克景达实验动物有限公司,采用随机数字表法分为假手术组、模型组、实验组,每组6 只。cGAS 抑制剂RU. 521 购自美国MedChemexpress 公司,HE 染色试剂和Nissl 染色试剂购自武汉赛维尔生物科技有限公司,cGAS抗体购自武汉三鹰生物技术有限公司,LC3B 购自美国CST 公司,Beclin-1 购自武汉爱博泰克生物科技有限公司,TUNEL试剂盒购自武汉赛维尔生物科技有限公司。
1.2 模型制作及cGAS 抑制剂用法 模型组、实验组采用线栓法制备大脑中动脉栓塞模型。参照课题组前期研究[12]中的方法,小鼠室温下称重麻醉后仰卧位固定,剪除术野毛发,碘伏消毒皮肤,颈部正中切口,显微镜下钝性分离左侧颈总动脉、颈内动脉和颈外动脉,避免损伤迷走神经,分别结扎颈总动脉近心端和颈外动脉起始处,在颈总动脉上系一活结,随后在颈总动脉上剪一小缺口,将线栓沿颈总动脉插入颈内动脉,自颈总动脉分叉处进线9 ~ 10 mm。缺血1 h 后将线栓取出进行再灌注。假手术组分离大脑中动脉但不阻断。实验组于再灌注前10 min腹腔注射5 mg/kg的cGAS抑制剂RU.521。
1.3 脑组织损伤情况评估 于再灌注6 h后处死小鼠,分离颅骨取出脑组织,石蜡包埋后制备切片。部分切片依次使用二甲苯、梯度乙醇脱蜡水化,苏木素染色并冲洗,1%盐酸乙醇分色,0.6%氨水处理,HE染色观察胞核和胞质染色情况;
部分切片于载玻片上摊平,置于烤片机烤片,依次使用氯仿、梯度乙醇浸片。蒸馏水洗涤后室温下焦油紫进行Nissl 染色观察尼氏体。
1.4 脑组织细胞凋亡率检测 取适量脑组织用多聚甲醛固定,制备石蜡切片,二甲苯脱蜡,梯度乙醇水化,水浴锅加热0.01 mol/L 柠檬酸钠缓冲液至95 ℃,放入切片加热,待缓冲液冷却后用PBS 清洗,滴加一抗黑暗处孵育过夜;
次日37 ℃复温,PBS 清洗,滴加二抗,室温避光孵育后加入DAPI,黑暗中继续孵育;
采用抗荧光猝灭密封试剂进行密封;
显微镜下拍照,观察并计算凋亡细胞数,以凋亡细胞数除细胞总数计算凋亡率。
1.5 脑组织中cGAS、LC3B、Beclin-1 蛋白检测 取适量组织加入RIPA后冰上裂解、离心、提取总蛋白,计算各样品蛋白浓度。根据蛋白分子大小制备分离胶及浓缩胶,上样后以90 V 电泳至Marker 分出条带,转至120 V 直至溴酚蓝跑至分离胶底部终止电泳。将PVDF 膜置入转移槽,加入预冷的电转液,根据蛋白分子大小设定转移时间进行电转。加入cGAS(1∶500)、LC3B(1∶1 000)、Beclin-1(1∶500)一抗4 ℃摇床孵育过夜。次日TBST 洗涤后加入辣根过氧化物酶标记的二抗孵育,ECL显影,扫描后分析蛋白条带灰度值。
1.6 统计学方法 采用Graph Pad Prism9.0 软件。正态分布的计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用Turkey 检验。P<0.05为差异有统计学意义。
2.1 各组小鼠脑组织损伤情况比较 假手术组细胞未见病理改变;
与假手术组相比,模型组病理学形态异常,主要表现为神经元形态不规则,固缩或消失,尼氏小体稀少或消失;
与模型组相比,实验组神经元形态相对规则,大部分细胞膜较完整,胞核较清晰,尼氏小体数量较多。见图1。
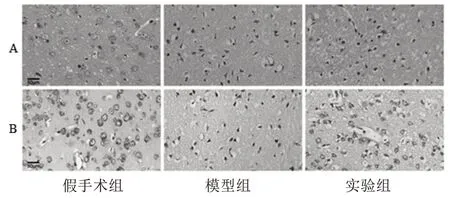
图1 各组小鼠脑组织病理变化
2.2 各组小鼠脑组织细胞凋亡率比较 模型组小鼠脑组织细胞凋亡率高于假手术组,实验组细胞凋亡率低于模型组(P均<0.05)。见表1。
2.3 各组小鼠脑组织中cGAS、LC3B、Beclin-1 蛋白表达比较 模型组小鼠脑组织中cGAS、LC3B、Beclin-1蛋白表达高于假手术组,实验组cGAS、LC3B、Beclin-1蛋白表达低于模型组(P均<0.05)。见表1。
表1 各组小鼠脑组织细胞凋亡率及cGAS、LC3B、Beclin-1蛋白表达比较(± s)
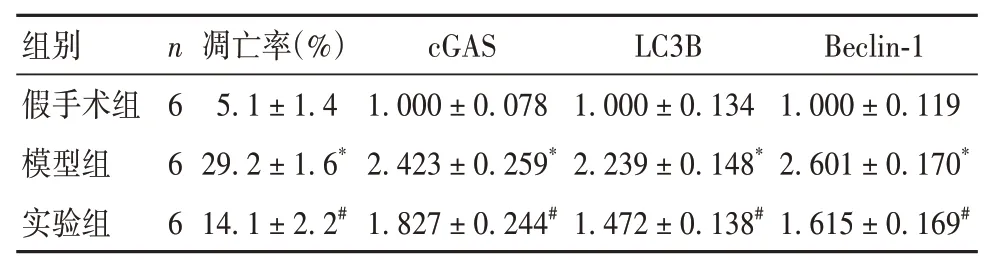
表1 各组小鼠脑组织细胞凋亡率及cGAS、LC3B、Beclin-1蛋白表达比较(± s)
注:与假手术组相比,*P<0.05;
与模型组相比,#P<0.05。
组别假手术组模型组实验组Beclin-1 1.000 ± 0.119 2.601 ± 0.170*1.615 ± 0.169#n 6 6 6凋亡率(%)5.1 ± 1.4 29.2 ± 1.6*14.1 ± 2.2#cGAS 1.000 ± 0.078 2.423 ± 0.259*1.827 ± 0.244#LC3B 1.000 ± 0.134 2.239 ± 0.148*1.472 ± 0.138#
缺血性脑卒中是我国人口致死、致残的主要因素,给家庭和社会带来了沉重的经济负担[13-14]。目前缺血性脑卒中的治疗手段以溶栓或取栓为主,有助于恢复脑组织的有效灌注,但治疗后常会出现更严重的并发症即CIRI[15]。CIRI 是十分复杂的级联反应,涉及氧化应激、炎症反应、细胞自噬、兴奋性毒性、钙超载、线粒体功能受损等多种机制,而这些因素彼此关联、相互作用,最终导致缺血区神经元的坏死和功能障碍[16-17]。因此,积极寻求减轻CIRI 的方案已成为临床关注的热点。
cGAS通路作为经典的天然免疫信号通路,可通过识别病原相关分子模式从而抵御病原体入侵,亦可利用损伤相关分子模式对机体进行监控,是机体抵御病原体入侵的关键性自我监控防御系统[18-19]。近期cGAS 通路在非免疫生理过程中的作用亦受到重视。研究发现,cGAS 通路可参与DNA 损伤修复过程,并通过介导核因子κB和丝裂原活化蛋白激酶等内源性通路激活参与机体稳态的调控[20-21]。新近研究发现,激活cGAS 通路不仅能产生强大的天然免疫反应,还可调控多种形式的细胞死亡和应激反应[22]。有学者发现,cGAS通路在再灌注初期功能显著上调[23]。因此,若能在再灌注早期进行及时干预则有望减轻脑损伤,对临床防治CIRI 产生重要价值。
研究表明,cGAS通路激活与自噬依赖的细胞死亡有关[24]。端粒损伤可促进DNA 片段释放进入细胞质,进而导致过度自噬的发生,表现为自噬相关蛋白LC3 表达上调和p62 表达下调,抑制自噬或cGAS通路则可明显改善细胞的状态[25-26]。进一步研究发现,cGAS 共有5 个LC3 相互作用区域[27],同时cGAS还可与自噬相关蛋白Beclin-1 相互作用,释放自噬负调控因子,负反馈调节自噬过程[28]。本研究结果显示,与假手术组相比,模型组脑组织中cGAS 表达升高,同时伴随着神经元形态不规则、细胞固缩、尼氏小体溶解或消失等现象,细胞凋亡率亦呈升高趋势,提示CIRI 过程中cGAS 升高可导致神经元的损伤。
自噬可通过自我消化和循环利用细胞内受损的细胞器及错误折叠或聚集的蛋白质等,维持细胞内稳态和正常功能[29-30]。自噬通常被认为是一种促生存的机制,但亦有研究认为自噬是一种Ⅱ型程序性细胞死亡方式[31]。研究表明,适度自噬可发挥保护性作用,而过度自噬则可能成为细胞死亡的驱动因素。如在机体处于氧化应激、再灌注损伤等病理状态下,自噬激活可通过加速受损细胞器的更新和动员细胞内能量储存从而维持代谢平衡,但再灌注后过度激活的自噬又会导致正常细胞结构受损进而引起程序性细胞死亡[32-33]。自噬相关蛋白LC3B、Beclin-1 对自噬的进展具有决定性作用,二者表达升高可能导致细胞死亡。本研究结果显示,模型组脑组织中LC3B、Beclin-1表达高于假手术组,细胞凋亡率高于假手术组,与相关研究结果一致[34-35]。
本研究模型组和假手术组的实验结果表明,激活cGAS 通路可通过增强自噬导致脑损伤。已有研究表明,cGAS 抑制剂RU.521 可透过血脑屏障发挥抑制cGAS 的作用。用5 mg/kg 的RU.521 对小鼠进行腹腔注射可获得稳定的抑制效果[36-38]。本研究采用cGAS 选择性抑制剂RU.521 对小鼠腹腔注射,发现病灶脑组织中自噬相关蛋白LC3B、Beclin-1 表达降低,细胞凋亡率下降,同时神经元形态相对规则,大部分包膜较完整,胞核较清晰,尼氏小体数量较多,表明抑制cGAS 通路后自噬下调,进而细胞凋亡减少。
综上所述,小鼠CIRI 状态下cGAS 天然免疫通路功能上调,可促进细胞自噬激活,增加细胞凋亡进而加重脑损伤;
cGAS抑制剂预处理可减轻小鼠脑缺血再灌注损伤,其机制可能与调节自噬有关。