免疫检查点抑制剂导致免疫相关不良反应的研究进展
来源:优秀文章 发布时间:2023-04-18 点击:
白 黎,王 珂
(吉林大学第二医院呼吸与危重症医学科,长春 130041)
免疫检查点( immune checkpoint)也被称为免疫抑制性受体。2018年,James P Allison因发现细胞毒性淋巴细胞抗原-4CTLA-4(cytotoxic lymphocyte antigen-4,)和 Tasuku Honjo因发现程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)及程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)免疫检查点,从而通过抑制负免疫调节而达到治疗癌症的目的被授予诺贝尔生理学或医学奖[1],免疫检查点相关的研究从此备受全世界的关注。在人体中存在多种不同类型的免疫细胞,它不仅保护机体免受外界环境中病原体的侵害,也在不断清除自身组织中的癌变细胞来维护机体的健康状态。每种类型的免疫细胞在保护机体中发挥不同作用,在这个过程中,一种重要的细胞类型就是T细胞(即T淋巴细胞),其可以随着血液循环在体内游动,能穿过血管壁进入或离开组织。当它穿过身体组织时,会通过“天线状”结构,即表面受体(T cell receptor,TCR)对所遇到的细胞进行识别,从而检查细胞是否异常。如果受检的细胞受到病毒或者细菌等感染,T细胞受体就会识别出被感染的细胞,随即附着在被感染细胞上,TCR发出细胞信号,T细胞通过释放致死性分子来摧毁异常细胞。T细胞之所以在癌症免疫治疗中发挥着核心作用,是因为它们可以把癌细胞识别为异常细胞,从而摧毁癌症细胞。TCR除了能够激活T细胞外,还包括一些抑制性受体,其作用是抑制T细胞功能,这些抑制性受体即被称为免疫检查点。当这些检查点被激活后,T细胞不能够再去破坏异常细胞。癌细胞会滥用这些检查点,从而向T细胞发出停止信号,癌细胞就会防止自己被摧毁,即肿瘤的免疫逃逸[2]。目前,研究最为广泛的免疫检查点为CTLA-4、PD-1、PD-L1、TIM-3(T cell immunoglobulin and mucin-domain containing-3T 细胞免疫球蛋白黏蛋白分子-3)、TIGIT(T-cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain T细胞免疫球蛋白和免疫受体酪氨酸抑制性基序结构域)、LAG-3(lymphocyte activation gene-3淋巴细胞活化基因-3)[2-3]。
正常的T细胞激活需要两个信号才能完全激活。主要信号(信号1)发生在抗原提呈细胞(APC)呈递的抗原-主要组织相容性复合体(MHC)与TCR结合时。然而,信号1本身不足以激活T细胞。当名为CD28的共刺激分子与APC表面的B7(CD80和CD86)结合时,出现第二个信号(信号2)。在这种相互作用之后,T细胞被激活并执行各种效应器功能(例如杀死肿瘤细胞)(见图1)。CTLA-4是第一个临床靶向的免疫检查点[4],也是第一个被描述的仅在T细胞活化后才在T细胞表面表达的免疫检查点,然而,CTLA-4与CD28有很高的同源性,共享相同的配体(CD80 和 CD86),与B7分子结合的亲和力比CD28高得多,从而抑制T细胞的激活。PD-1是另一种表达在T细胞表面的负性调节受体,它通常与PD-L1(在多种组织和肿瘤细胞中广泛表达)或PD-L2(仅限于某些APC)结合。肿瘤选择某些免疫检查点途径作为“免疫逃逸“的主要机制。在肿瘤微环境中,免疫检查点如CTLA-4、PD-1及其配体PD-L1显著过度表达[5],抑制T细胞的激活,导致“免疫耗竭”(见图2)。因此,这些免疫检查点是重要的免疫治疗靶点,阻断免疫检查点可以“解除”这种免疫抑制,并重新激活能够摧毁肿瘤细胞的细胞毒性T细胞[6]。

图1 T细胞的正常激活过程
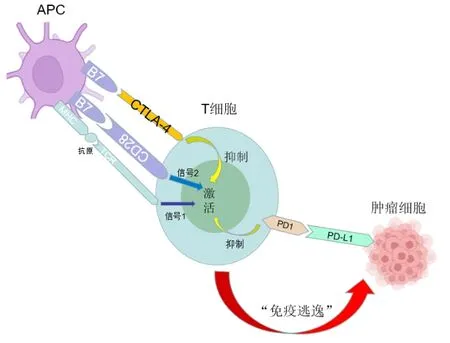
图2 T细胞的耗竭过程
截至目前,美国食品与药物管理局(FDA)已经批准了7种免疫检查点抑制剂( immune checkpoint inhibitors,ICIs)用于治疗各种实体肿瘤和血液恶性肿瘤[7],包括抗CTLA-4抗体(ipilimumab)、抗PD-1 抗体(pembrolizumab、nivolumab、cymplimab)和抗PD-L1抗体(atezolizumab、duvalumab、avvelumab)[8](见表1)。国内上市的13款PD-1/L1抑制剂包括抗PD-1抗体(纳武利尤单抗、帕博利珠单抗、特瑞普利单抗、信迪利单抗、卡瑞利珠单抗、替雷利珠单抗、派安普利单抗、赛帕利单抗)及抗PD-L1抗体(度伐利尤单抗、阿替利珠单抗、恩沃利单抗、舒格利单抗)(见表2)。这些药物已被证明在晚期肺癌[9-14]、恶性黑色素瘤[15]、泌尿系统肿瘤[16]、消化系统肿瘤[17-19]等多种恶性肿瘤治疗中有效。除此之外,全世界仍有上百个关于ICIs治疗不同恶性肿瘤的临床试验正在开展,这将为恶性肿瘤的治疗策略带来新的选择与角度。但随着ICIs药物适应症家族的不断扩大以及药物可及性的不断提高,免疫治疗相关不良反应(immune-related adverse events,irAEs)也逐渐被发现和关注。IrAEs是在ICIs治疗期间或治疗后可能产生的副作用,因为它们是高度活跃的免疫反应的结果,并在癌症治疗过程中不连续地表现出来,这种反应会“敌我不分”从而损害健康的组织,或者导致自身免疫或炎症性疾病。

表1 获得FDA批准的ICIs汇总(更新至2021)
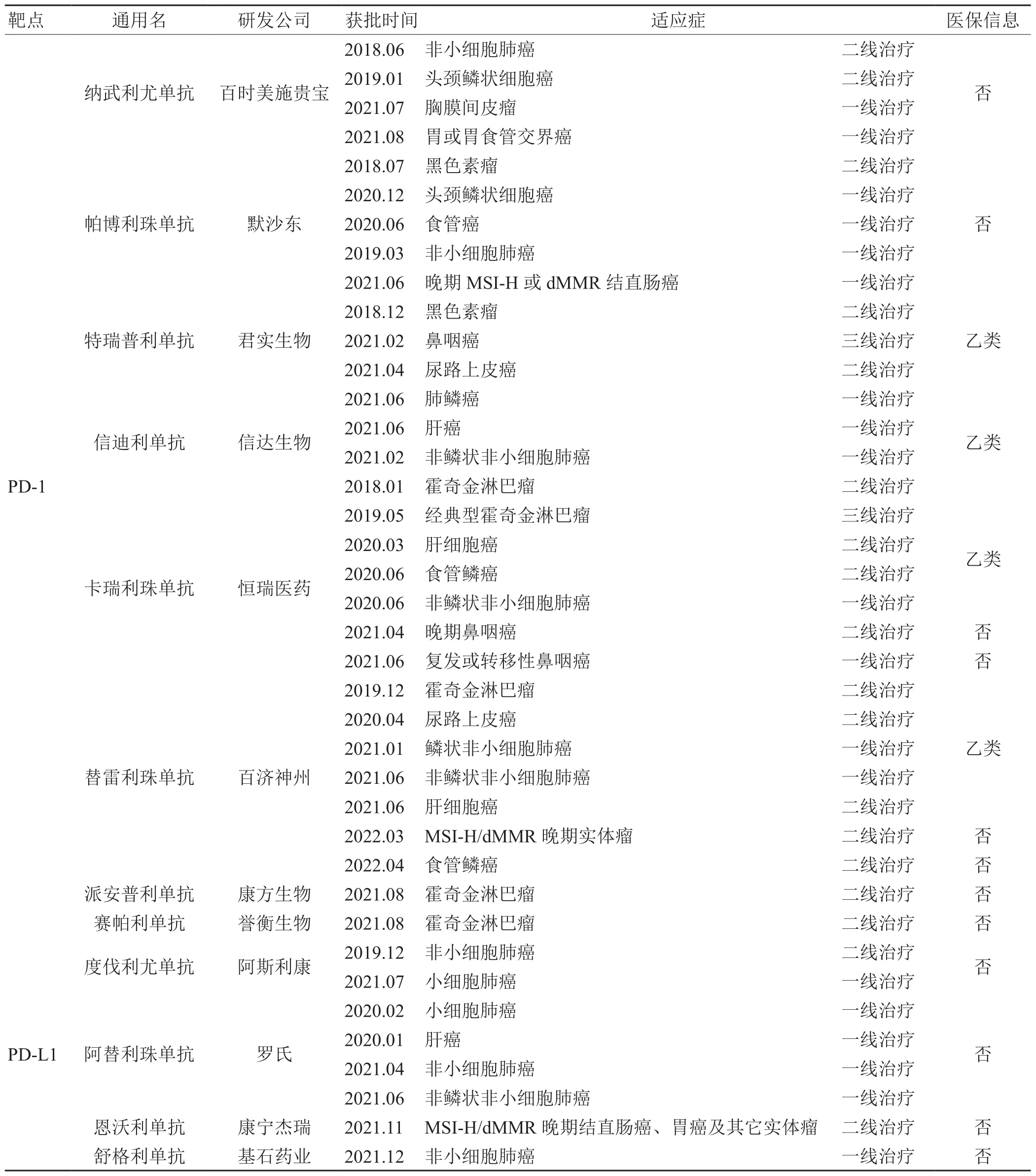
表2 国内上市的13款PD-1/L1药品信息汇总(更新至2022.04)
近年来,随着对ICIs治疗研究的不断深入,关于irAEs与ICIs治疗的关系也在同步探索中。越来越多的证据表明,免疫相关不良事件(irAEs)的发生可能是免疫检查点抑制剂疗效的预测指标。J.Meanwatthana等[20]通过对2017-2019年所有在Watthan osoth癌症医院接受了至少一剂经批准的ICIs治疗的18岁及以上患者进行12个月的跟踪调查。观察指标包括irAEs的发生率、不良事件处理和肿瘤客观反应。对可能与irAEs发生相关的因素进行双变量分析绘制横向回顾图表发现,irAEs的发展可能与肿瘤的客观缓解率有关。Mohammad Alomari等[21]通过一项回顾性研究发现胃肠道免疫相关不良事件(GI-irAEs)的发生与肿瘤反应性增强和生存改善相关。鉴于ICIs治疗处于初期探索阶段,很少有文献研究GI-irAEs的发展与肿瘤对ICIs的反应之间的关系。这项研究确定了GI-irAEs患者的预后和生存优势。客观评估证实,与未发生GI-irAEs的患者相比,发生GI-irAEs的患者对ICIs治疗的肿瘤反应更好。这些结果与以往的研究结果一致,强调了自身免疫与肿瘤免疫之间的密切关系。GI-irAEs的发展可能是免疫系统激活的替代指标,因此可能鼓励临床医生继续而不是停止ICIs治疗,以治疗可耐受的非危及生命的GI毒性。此外,在这项研究中,几乎2/3的肝炎患者出现了无症状的转氨酶或胆红素升高。因此,应强调在免疫治疗前和治疗期间常规监测肝功能检查对早期诊断和治疗的重要性。目前,对免疫治疗的研究还在继续,对得出的这些结论还需要大规模的临床数据得以验证。这种联系是延伸到所有irAEs,还是仅限于特定器官/系统内的iAEs,还有待进一步去探索。由于ICIs治疗获批肿瘤治疗尚处于初始阶段,需要多个学科密切合作,提高对免疫不良反应的认识。
3.1 发生机制
免疫检查点抑制剂治疗(以下简称为免疫治疗)通过重新激活机体的自身免疫系统而达到增强抗肿瘤免疫反应的目的,因此在发挥抗肿瘤作用的同时,可能会“误伤”全身的健康组织。从而导致全身各系统不同的毒副效应。对发生 irAEs 的组织进行组织病理学分析有助于探究其发生的分子学机制。在Emily Coleman、Christine Ko等[22]进行的一项回顾性队列研究中,对98名患者中103例与ICIs相关的炎性皮疹进行了回顾。前五位诊断为苔藓样(25%)、斑丘性(18%)、银屑病样(17%)、湿疹(12%)和免疫空洞反应(8%)。发现ICIs所致皮疹的临床和组织病理学特征通常与典型皮肤病相一致。说明机体在启动自身免疫系统时不会精准狙击肿瘤细胞,从而会误伤机体其他健康的组织。另一项Gregory S.Phillips, Jennifer Wu等[23]进行的一项回顾性分析发现427例患者中有285例皮肤irAEs,最常见的irAEs是瘙痒(32%)和斑丘疹(28%)。其他包括牛皮癣、大疱性类天疱疮(BP)和白癜风。组织病理学表现为淋巴细胞性炎性浸润性病变,伴有嗜酸性粒细胞,偶见表皮海绵状增厚。65例患者中有34例(52%)血清白介素6(IL-6)水平升高;
而嗜酸性粒细胞、血清白介素10(IL-10)和免疫球蛋白E(IgE)水平的升高与3级或更高的irAEs有关。内分泌疾病也是最常见的免疫相关不良事件之一,但这些内分泌疾病的确切发病机制也仍不清楚[24]。虽然近年来免疫不良反应的研究在如火如荼地开展,但irAEs 发生的确切病理生理学机制尚不清楚,目前认为可能与外周免疫反应耐受性的紊乱[25-26]、T
细胞的异常激活[27]、机体炎症因子促炎活性的增高[28]、肠道微生物的菌群失调[29-30]、特定的自身免疫T细胞克隆识别共同抗原[31]、抗原的级联反应[32]、细胞因子白介素17(IL-17)的参与[28,33]、T细胞对肿瘤和正常组织的相关抗原存在的交叉反应等有关[33]。虽然有初步的观察结果,但仍需大规模的临床数据去进一步明确发生irAEs的原因。
3.2 临床特点
免疫检查点抑制剂引起的不良反应与传统的化疗相比:1)irAEs发生率总体较低[34]。Martin Reck等[35]发现化疗组中与治疗相关的3~5级不良事件的发生率是ICIs组的2倍(53.3% 比26.6%);
Fiamma Berner等[31]发现大约30%的患者可以发生任何级别的irAEs,约10%的患者可能发生3~5级的irAEs。2)irAEs可能发生在多个器官,发病时间差异很大,通常由受累器官系统决定的,大多数irAEs的严重程度较轻,可通过密切监测和对症治疗进行管理[34]。从早期出现(第1周)到延迟事件发生(急性肾损伤可长达26周出现),主要的发病窗口时间是4~12周。根据药物警戒的数据,发病中位数多为40 d,绝大多数事件都发生在这段时间内,因此前2个月可被视为“关键药物警戒窗口”。延迟事件包括风湿系统疾病(如关节炎的平均发病时间为81 d,系统性红斑狼疮的平均发病时间为196 d)、内分泌系统疾病(糖尿病平均发病时间为116 d)、严重皮肤反应(抗CTLA-4药物的平均发病时间为65 d)和甲状腺功能障碍(抗PD-1/PD-L1药物的平均发病时间为92 d)。除此之外,对于心肌炎,则为快速事件(联合方案的中位数为16.5 d)和晚期事件(中位数为178 d)[36]。3)irAEs也可以在停止ICIs治疗之后,并可能随着时间的推移而兴衰。以及是否会产生后期毒性风险(即在开始治疗多年之后)尚不清楚[33]。但在肿瘤的早期阶段,持续的irAEs会严重影响患者的生活质量,必须仔细评估风险—收益比[37]。4)由于irAEs复杂性及多样性,临床医生面对越来越多的常见和罕见的irAEs,不同疾病的特征、主治医生的严谨及不同癌症的疗程可能会混淆目前现有回顾性研究的结果,故在临床工作中irAEs的发生率高于目前临床研究和文献报道。5)irAEs以 1~2 级为主,3~4 级发生率低,轻微的不良反应通常不需要立即干预,可观察及对症处理,具有自限性[38]。而由此引发的内分泌疾病则需要长期激素替代治疗。6)根据PD-1/PD-L1使用模式的不同,irAEs的频率、类型和严重程度各不相同:关于单用PD-1/PD-L1抑制剂,46例可评估患者中有23例(50.0%)发生了任何级别的irAEs,8例(17.4%)患者因肺炎(5例,10.9%)、肾上腺功能不全(3例,6.5%)和肝炎(1例,2.2%)而住院。在PD-1/PD-L1抑制剂与细胞毒性化疗联合使用方面,68例可评估患者中有22例(32.4%)发展为任何级别的irAEs,7例(10.3%)因肺炎(5例,7.4%)、皮炎(1例,1.5%)和自身免疫性溶血性贫血(1名,1.5%)而住院[39]。7)不同种类 ICIs、不同治疗剂量或组合疗法,irAEs 频率、类型和严重程度也有所差异[40]。8)同一 ICIs 作用于不同肿瘤时产生的irAEs频率、类型及严重程度也有所区别。
3.3 常见类型
可能影响的器官、系统,及产生常见的免疫相关不良反应(见表3)。

表3 常见的免疫相关不良反应[41]
3.4 治疗原则
目前,欧洲医学肿瘤学学会(ESMO)[42]、癌症免疫治疗学会(SITC)毒性管理工作组[43]和国家综合癌症网络(NCCN)(2018年)基于专家共识[41,43-44]等列出了irAEs的管理指南。这些指南为大多数常见的irAEs提供了一般的治疗方案,详细说明了免疫抑制药物(如全身性皮质类固醇)和根据其严重性进行治疗的持续时间[34]。使用不良事件通用术语标准对严重 程度进行1~5 级分级(1=轻度,2=中度,3=重度,4=危及生命,5=毒性相关死亡)。针对不同等级的毒性反应,处理原则也不同:1级无需住院,密切观察患者毒性变化,做到及时干预以免毒性进一步变化;
2级则暂停ICI 治疗,当症状和/或实验室检查值降至 1 级以下时恢复ICI 治疗。口服或静脉滴注皮质类固醇是目前irAEs治疗的主要药物,如果症状 持续超过1周,则应开始糖皮质激素(泼尼松每天0.5~1 mg·kg-1或当量)治疗;
随着患者症状的改善,这些类固醇会在2~4周内停用。对于 3 级和 4 级,应给予高剂量皮质类固醇治疗(泼尼松每天1~2 mg·kg-1),当症状消退至1级或以下时,糖皮质激素应逐渐减量。对于3级毒性后续是否恢复ICI治疗,在充分评估患者的肿瘤状态和风险/获益比后,再决定是否恢复ICI治疗;
对于4级毒性,除激素替代治疗控制的内分泌疾病外,应永久停用 ICI。对于激素无效或者更严重或难治的病例,则可以考虑其他免疫抑制剂包括TNF-α抑制剂(如英夫利西单抗)、麦考酚酯、他克莫司及生物性免疫制剂等[33,41-43]。在免疫治疗开始前,应该告知所有患者ICIs治疗潜在毒性的可能性。做到患者及家属可以及时向治疗团队报告可疑症状并及时就诊,接受全面评估,使得治疗团队可以密切关注病情变化进而及时采取进一步干预手段防止毒性的进一步恶化。同时要加强多学科合作,遵守指南合规合理解决。
近年来,由于对免疫治疗的研究不断深入,研究者们寻找用于预测免疫检查点抑制剂抗肿瘤反应和irAEs的生物标志物仍然是一个挑战。通过对irAEs发生特点和机制的不断探索,寻求能够有效预测其发生发展的生物标志物,从而帮助临床一线医生高效评估肿瘤患者免疫治疗的疗效性及风险性。及时、敏锐地接收到irAEs相关生物标志物发出的“警示信号”有助于在免疫治疗前、治疗中及随访中识别发生irAEs可能性大的患者,能够做到更及时、高效、密切地跟踪治疗过程,在其发生重度致死性irAEs前做到早期干预、对症处理、动态调整免疫治疗方案。同时一些研究者发现,irAEs的发生发展与免疫治疗疗效呈现相关性[20-21,45-46]。因此,急需对irAEs预测性相关生物标志物进行不断探索。目前,一些研究发现,年龄、性别、营养状态等一般临床特征,自身免疫性疾病抗体、细胞因子、血液细胞计数及其比值、免疫细胞计数及其比值、炎症因子、肠道微生物、家族遗传基因等多种指标可能与其有关。但是人体复杂的免疫系统及其动态变化给探索免疫治疗及irAEs相关的生物标志物形成巨大的困难,目前研究发现的一些标志物仍需要大规模的临床数据去支撑,以便制定疾病各个阶段的精确个体化治疗方案,使得肿瘤患者获得更高效、精准、个体化治疗疗效,同时便于临床医生全程监测患者病情动态变化。
猜你喜欢检查点免疫治疗单抗FOLFOXIRI联合贝伐单抗±阿替利珠单抗治疗转移性结直肠癌实用肿瘤学杂志(2022年3期)2022-11-30Spark效用感知的检查点缓存并行清理策略①计算机系统应用(2022年4期)2022-05-10免疫检查点抑制剂相关内分泌代谢疾病天津医科大学学报(2021年4期)2021-08-21肿瘤免疫治疗发现新潜在靶点中国生殖健康(2020年7期)2020-12-10司库奇尤单抗注射液皮肤性病诊疗学杂志(2020年4期)2020-09-02免疫检查点抑制剂在肿瘤治疗中的不良反应及毒性管理国际呼吸杂志(2019年4期)2019-03-12肾癌生物免疫治疗进展海南医学(2016年8期)2016-06-08使用抗CD41单抗制备ITP小鼠的研究中国卫生标准管理(2015年16期)2016-01-20分布式任务管理系统中检查点的设计现代计算机(2015年31期)2015-09-28非小细胞肺癌免疫治疗临床新进展医学研究杂志(2015年5期)2015-06-10推荐访问:免疫 检查点 抑制剂