慢性肾病大鼠血清Bcl-3、Gal-3、TGF-β1与肾间质纤维化的关系*
来源:优秀文章 发布时间:2023-04-18 点击:
黄越熙 毛海霞 张丽玲 李艳 吴蔚桦 欧三桃
(1.西南医科大学附属医院肾病内科,四川 泸州 646000 2.四川省肾脏病临床医学研究中心,四川 泸州 646000)
慢性肾脏病(Chronic kidney disease,CKD)是一个全球性的公共问题,其患病率逐年上升[1]。而肾纤维化是各种CKD进展至终末期的主要病理改变和共同通路,其严重程度与患者的治疗选择及预后判断关系密切,因此准确评估肾纤维化程度具有十分重要的意义[2]。临床上肾活检是诊断肾纤维化的金标准,可以准确直观地了解肾脏病理改变及判断肾纤维化程度,但是有创操作,实施有一定的局限性,B 超、CT、MRI 等非侵入性手段可一定程度地可用于肾纤维化的判断,但是这些检查只能通过肾脏解剖改变间接反映肾纤维化情况,难以早期发现并判断其严重程度[3]。而生物标志物既能评估或定量测量某种疾病的生物学和病理学进程,同时也可作为疾病的治疗靶点[4]。目前研究已经发现多种肾纤维化诊断生物标志物,但尚无公认的判断肾纤维化的标记物,因此深入探讨并筛选出有价值的生物标记物具有十分重要的意义。B细胞淋巴瘤因子3(B cell lymphoma 3,Bcl-3)、大鼠半乳糖凝集素3(Galectin-3,Gal-3)是近年来有应用前景的潜在肾纤维化生物标志物,但其价值还需进一步研究。本研究旨在通过建立腺嘌呤诱导的CKD大鼠模型并检测大鼠血清Bcl-3、Gal-3、转化生长因子β1(Transforming growth factor-β1,TGF-β1)水平,分析其与肾间质纤维化的关系,探讨其是否可成为判断肾纤维化的新型生物标志物。
1.1 实验动物 SPF 级雄性SD大鼠20只,体重(200±10) g,8周龄,购自西南医科大学实验动物中心[SCXK(川)2018-17]。于西南医科大学附属中医医院中西医结合研究中心动物房饲养并取材[SYXK(川)2018-065]。本实验遵循“3R”原则给予人道的关怀。经由西南医科大学实验动物伦理委员会审批通过(swmu20220018)。
1.2 主要仪器及试剂 腺嘌呤(Sigma公司,美国);
Gal-3 ELISA试剂盒(江苏酶免实业有限公司,中国)、大鼠TGF-β1 ELISA试剂盒(江苏酶免实业有限公司,中国)、大鼠Bcl-3 ELISA试剂盒(江苏酶免实业有限公司,中国);
Masson染色液(合肥博美生物科技有限责任公司,中国);
α-SMA抗体(武汉博士德生物工程有限公司;
中国);
高速冷冻离心机(Eppendorf 公司,德国);全自动生化分析仪(西门子,德国);
石蜡切片机(Thermo公司,美国);
光学显微镜(Nikon公司,日本);
酶标仪(Rayto,RT-6100)。
1.3 实验方法
1.3.1 实验分组和模型制备 SPF级雄性SD大鼠20只,适应性喂养1周后,随机分为对照组(n=10)和模型组(CKD,n=10)。腺嘌呤溶于蒸馏水,制成2.5%混悬液,CKD组第1~4周每日定时给予腺嘌呤混悬液250 mg/(kg·d)灌胃,第5~6周给予腺嘌呤混悬液125 mg/(kg·d)灌胃;
对照组给予等体积生理盐水灌胃,两组均予以普通饲料喂养。所有大鼠自由进食及饮水,光照时间明暗各半,室温18℃~25℃。
1.3.2 标本采集 分别于第3、6周末处死大鼠,经腹主动脉采血;
留取肾组织置于10%中性福尔马林液中固定,制成石蜡切片,另一部分肾组织冻存于-80℃冰箱中用。
1.3.3 血尿素氮、肌酐及Bcl-3、Gal-3、TGF-β1指标检测 全自动生化分析仪测定大鼠肾功能。酶联免疫吸附法(ELISA) 测定血清Bcl-3、Gal-3、TGF-β1含量。所有试剂盒均购自江苏酶免实业有限公司,严格按照试剂盒说明书进行操作。
1.3.4 肾组织HE染色 固定的肾组织经脱水、包埋、切片后,脱蜡至水、染色、封片,观察肾脏病理改变。
1.3.5 肾组织Masson染色 固定的肾组织经脱水、包埋、切片后,脱蜡至水;
切片入Bouin液,37℃温箱内2 h,流水冲洗;
天青石蓝染料滴染2~3 min,稍水洗;
Mayer苏木素染色液滴染2~3 min,稍水洗;
酸性乙醇分化液分化数秒,流水冲洗10 min;
丽春红品红染色液滴染10 min,蒸馏水稍水洗;
磷钼酸溶液处理10 min;
倾去上液,滴入苯胺蓝染色液染5 min;
弱酸溶液处理2 min;
脱水、透明、中性树胶封固。每例选取3张切片观察10个非重复视野(200×),以蓝色为阳性表达,计算Masson染色阳性面积占整个视野的百分比,对其进行半定量分析[5]。半定量评分标准:0分,无着色;
1分,轻度,面积<10%;
2分,中度,面积11%~25%;
3分,重度,面积26%~50%;
4分,极重度,面积>50%。
1.3.6 免疫组化检测大鼠肾组织α-SMA蛋白表达 肾组织石蜡切片脱蜡至水后行抗原修复,3% H2O2阻断内源性过氧化物酶 10 min,山羊血清封闭液封闭,滴加一抗、二抗、DAB 显色液,苏木素复染,常规脱水封片。每例切片观察10个非重复视野(200×),以出现棕黄色颗粒为阳性信号,应用Image-pro Plus 6.0图像分析软件分析阳性染色所占面积百分比,取其均值,结果用百分比表示[5]。
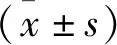
2.1 两组大鼠肾功能比较 与对照组比较,CKD组大鼠各时间点血尿素氮、肌酐水平均明显升高(P<0.05),见表1。
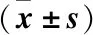
表1 两组大鼠肾功能比较Table 1 Comparison of renal function between two groups of rats
2.2 两组大鼠血清Bcl-3、Gal-3、TGF-β1水平比较 与对照组比较,CKD组大鼠各时间点血Bcl-3、Gal-3和TGF-β1水平均明显升高(P<0.05) ;
在CKD组内,Bcl-3在6周的水平较3周明显升高(P<0.05)。见图1。

图1 两组大鼠血清Bcl-3、Gal-3、TGF-β1水平比较Figure 1 Comparison of serum Bcl-3,Gal-3 and TGF-β1 levels in two groups of rats注:与对照组同一时间点比较,①P<0.05;
与 CKD 组同一时间点比较,②P<0.05
2.3 两组大鼠肾组织HE染色情况 对照组各时间点肾组织无明显病理改变,而CKD组各时间点可见肾小管上皮细胞变性坏死、扩张、间质内纤维组织增生以及炎细胞浸润,且第6周比第3周改变更明显,见图2。

图2 两组大鼠肾组织HE染色Figure 2 HE staining of renal tissue in two groups of rats
2.4 两组大鼠肾组织Masson染色情况及肾间质纤维化评分 对照组大鼠第3周末及第6周末的肾间质未见明显胶原纤维沉积;
CKD 组大鼠肾间质可见蓝色胶原纤维沉积增多,且第6周末较第3周末明显增多(P<0.05)。CKD组肾间质胶原纤维相对面积评分也明显高于对照组,且第6周末高于第3周末(P<0.05)。见图3。
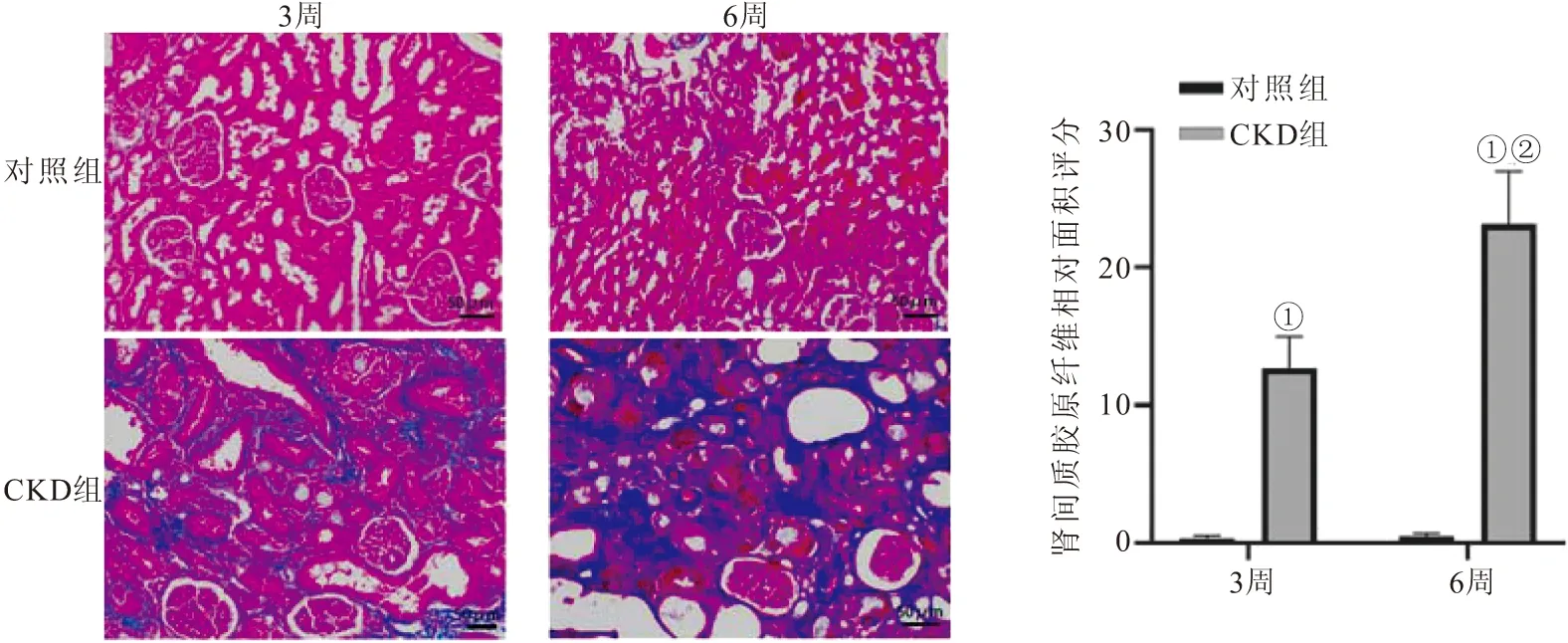
图3 Masson染色结果及肾间质胶原纤维相对面积评分Figure 3 Masson staining results and relative area score of interstitial collagen fibers in the kidney注:与 对照组同一时间点比较,①P<0.05;
与 CKD 组比较,②P<0.05
2.5 两组大鼠α-SMA免疫组化染色情况 对照组大鼠各时间点肾间质中未见α-SMA的表达,但在CKD组大鼠肾间质中α-SMA表达明显增加(P<0.05),见图4。
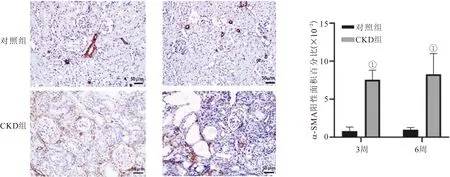
图4 两组大鼠α-SMA免疫组化染色结果及其阳性面积百分比Figure 4 Immunohistochemical staining results of α-SMA and its positive area percentage in two groups of rats注:与对照组同一时间点比较,①P<0.05
2.6 血Bcl-3、Gal-3、TGF-β1与肾间质纤维化的相关性分析 CKD大鼠血Bcl-3、Gal-3、TGF-β1水平与肾间质纤维化相对面积呈正相关(rs=0.776,P<0.001;rs=0.58,P<0.001;rs=0.52,P=0.001),见图5。
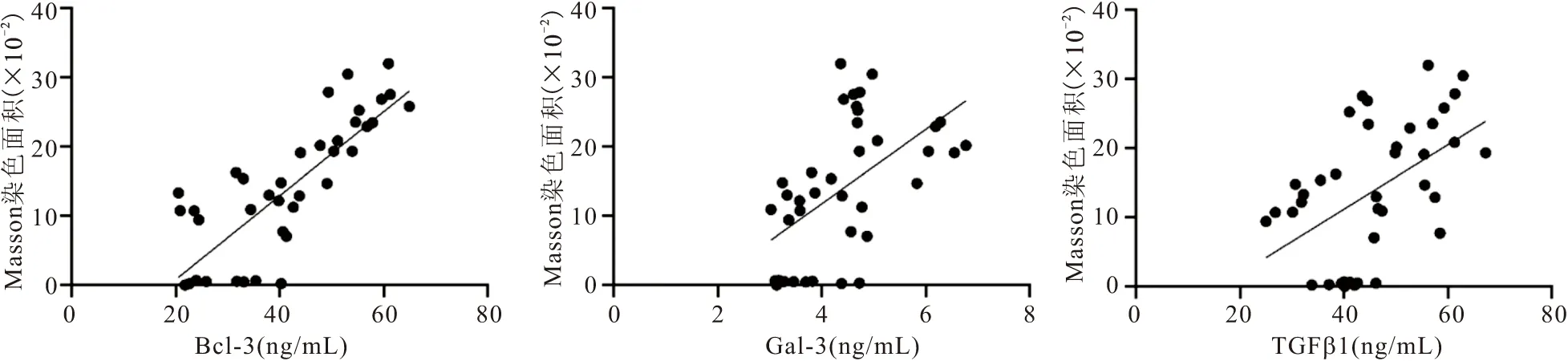
图5 血Bcl-3、Gal-3、TGF-β1与肾间质纤维化的相关性分析Figure 5 Correlation analysis of blood Bcl-3,Gal-3,TGF-β1 and renal interstitial fibrosis
肾间质纤维化是慢性肾脏病的主要病理改变,是肾脏疾病进展到终末期肾病的主要病因之一[6],早期预防及干预肾纤维化是延缓肾衰竭的关键措施。肾间质纤维化动物模型的造模方法主要分为手术(单侧输尿管结扎等)、药物(腺嘌呤、环孢素A等)和其他[7]。本研究采用腺嘌呤灌胃制备CKD大鼠肾间质纤维化模型,腺嘌呤在黄嘌呤氧化酶的催化下生成2,8-二羟基腺嘌呤,后者使肾小管发生堵塞,造成血清尿素氮、肌酐、尿酸显著升高,尿酸形成结晶,在肾小管、间质及肾小球部位沉积,导致大量肾单位损伤,最终发生肾间质纤维化[7-8]。本研究中,HE染色结果提示CKD大鼠模型建立成功。Masson染色显示CKD大鼠肾间质有明显的蓝色胶原纤维沉积,纤维化相关标志物α-SMA的表达水平也较对照组明显增加。由于肾脏纤维化主要由常驻成纤维细胞产生,而内皮细胞的转分化可能是其主要来源,在转分化期间,内皮细胞获得间充质标志物α-SMA[9]。以上均证实腺嘌呤诱导CKD大鼠模型出现了肾间质的纤维化。因此,在腺嘌呤灌胃制备CKD大鼠肾间质纤维化模型中探讨Bcl-3、Gal-3、TGF-β1与肾间质纤维化的关系。
TGF-β1家族蛋白是多功能细胞因子,在发育、炎症、免疫和组织重塑和修复等多种生物学过程中起着关键性的作用。且在肾纤维化中,TGF-β1是作用较为显著的一种蛋白[8]。已有研究发现,当发生肾纤维化时,组织[10-12]、血清[13-14]和尿液[10,14-15]中的TGF-β1 水平明显升高。Baczkowska等[16]研究发现血清TGF-β1 浓度可能预测肾移植术后患者肾纤维化的发展。本研究发现CKD大鼠各时间点的血清TGF-β1水平明显高于对照组,且其水平与肾间质纤维化之间呈正相关关系,表明随着肾间质纤维化的进展,TGF-β1表达水平也逐渐升高。其诱导肾纤维化的可能的机制包括[10]:①诱导胶原I等细胞外基质 (Extracellular matrix,ECM)的合成。②诱导基质金属蛋白酶(Matrix metalloproteinases,MMPs)和金属蛋白酶组织抑制物 (Tissue inhibitor of metalloproteinase,TIMPs) 的失衡,阻止ECM的降解。③对肾脏固有细胞的直接作用。④促进纤维细胞等多种来源的肌纤维化母细胞转分化和增殖,介导纤维化反应。Gal-3是β-半乳糖苷结合凝集素Galectin家族中30kDa的成员,参与了纤维化、心室重构、癌症以及自身免疫和炎症等过程,具有多种生物学功能,是检测各种疾病早期的潜在生物标记物[17-18]。尽管大量研究[17,19-20]发现Gal-3在肾纤维化过程中表达上调,可促进肾脏纤维化的发生,但针对血清Gal-3水平与肾纤维化的研究相对较少。研究[21]表明,较高的循环Gal-3水平与发生CKD的风险增加和肾功能迅速丧失有关,而进行性CKD的发展将导致肾小管间质纤维化。Ou等[22]发现血浆Gal-3水平升高与肾纤维化风险增加相关,并进一步证明了Gal-3与间质纤维化、肾小管萎缩和血管内膜纤维化有关。其次,他们在RNA序列分析中发现Gal-3在纤维化肾活检样本中表达上调。最后,结合GO富集分析以及KEGG分析,认为Gal-3可能通过调节细胞间粘附和细胞增殖来促进肾纤维化过程。本研究发现CKD肾纤维化时血清Gal-3明显升高,且与肾纤维化呈正相关,因此Gal-3有望成为肾纤维化的血清学标志物。
Bcl-3是IκB家族的成员,有报道称Bcl-3可通过直接结合Smad3,保护Smad3蛋白免受泛素化和降解来调节TGFβ/Smad信号通路,从而参与肾纤维化[8,23]。而目前关于Bcl-3与肾纤维化的研究较少。Chen等[23]发现Bcl-3在UUO小鼠模型肾纤维化中显著上调,且在CKD患者中,血清Bcl-3水平显著高于健康对照组,并且与人附睾蛋白4(Human epididymis protein 4,HE4)的血清水平高度相关,而HE4是肾纤维化的生物标志物,因此他们推断Bcl-3可以作为CKD肾纤维化的一个新的有价值的生物标志物。本研究亦发现CKD大鼠血清Bcl-3水平与肾间质纤维化呈正相关,且6周的Bcl-3水平较3周明显升高,这表明Bcl-3可能不仅有助于评估肾纤维化,还可反应其严重程度。
本研究存在一定的局限性,仅为小样本的动物实验,且只是初步观察了CKD时血清TGF-β1、Gal-3和Bcl-3的变化及其与肾纤维化的关系,未能深入探讨其变化价值,且未在临床应用中进一步验证。
本研究结果提示,在腺嘌呤诱导的CKD大鼠模型中,血清TGF-β1、Gal-3和Bcl-3水平明显增高,且与肾间质纤维化密切相关,有望成为评估肾纤维化的新型生物标志物,未来还需要进一步的前瞻性、大样本的研究来进一步证实本研究的结果以及TGF-β1、Gal-3和Bcl-3作为CKD患者肾纤维化生物标志物的潜在价值。
猜你喜欢腺嘌呤纤维化标志物肝纤维化无创诊断研究进展传染病信息(2022年3期)2022-07-156-苄基腺嘌呤对大豆内部水分分布及其生长状态的影响农业工程学报(2022年5期)2022-06-22两种剂型龟鹿二仙胶对于腺嘌呤诱导肾阳虚型少弱精子症大鼠的干预作用世界科学技术-中医药现代化(2021年5期)2021-11-05肝纤维化的中医药治疗肝博士(2021年1期)2021-03-29脓毒症早期诊断标志物的回顾及研究进展中华老年多器官疾病杂志(2016年9期)2016-04-28肾纤维化的研究进展医学研究杂志(2015年6期)2015-07-01冠状动脉疾病的生物学标志物医学研究杂志(2015年7期)2015-06-22肿瘤标志物在消化系统肿瘤早期诊断中的应用现代检验医学杂志(2015年6期)2015-02-06MR-proANP:一种新型心力衰竭诊断标志物现代检验医学杂志(2015年5期)2015-02-06液相色谱串联质谱法同时检测DNA中3_甲基腺嘌呤和3_乙基腺嘌呤分析化学(2014年8期)2014-09-02推荐访问:纤维化 血清 肾病