黄芪和蜜炙黄芪中糖类组分和非糖类组分的差异性研究
来源:优秀文章 发布时间:2023-04-16 点击:
赵婷婷,裴 科*,于子涵,曹 岗,李慧峰,孔祥鹏,张朔生,孙 琳,刘玉杰,蔡 皓
1.山西中医药大学中药与食品工程学院,中药炮制山西省重点实验室,山西 晋中 030619
2.南京中医药大学药学院,国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023
3.浙江中医药大学药学院,中药炮制研究中心,浙江 杭州 310053
4.山西中医药大学中药与食品工程学院,山西省现代中药工程实验室,山西 晋中 030619
黄芪为豆科植物蒙古黄芪Astragalimembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao 或膜荚黄芪A.membranaceus(Fisch.)Bge.的干燥根,其味甘,性温,归足太阴脾、手太阴肺经;
功效为补中益气、升阳举陷、益卫固表[1]。黄芪的炮制方法众多,在历代医书[2-3]中记载有蜜炙、米炒、酒炒、盐水炒、乳汁炒、米泔水炒、姜汁炒等方法,其中蜜炙法是记载最多并且沿用至今的炮制方法。蜜炙黄芪最早出现于《华佗神方》[4],经过历史长河的筛选,目前是被《中国药典》2020 版所收载的唯一黄芪炮制品。现代研究证明,蜂蜜作为中药中常用的一类辅料,它的添加可提高中药中一些化学成分的稳定性[5],同时提高部分活性成分的生物利用度;
此外有研究表明蜂蜜的天然深共晶特性也是其提高中草药功效和安全性的原因之一[6]。对于黄芪蜜炙后化学成分的变化机制研究,以往都是以小分子成分的变化规律为主,有研究发现黄芪在清炒和蜜炙后很多小分子有机物含量下降[7]。肖满珊[8]研究发现黄芪蜜炙后总黄酮类成分有所减少,总皂苷类成分有所增加。蜂蜜中含有大量的葡萄糖和果糖,还有少量的蔗糖、麦芽糖[9]。然而蜜炙之后黄芪中糖类组分的变化目前很少有文献报道,因此有必要运用糖组学从整体上研究黄芪蜜炙后糖类组分的变化。本研究首次整合糖组学和代谢组学的方法进行了黄芪蜜炙后糖类组分和非糖类组分整体变化的研究,来观察蜜炙对黄芪各组分的综合影响。
近年来,代谢组学结合糖组学从整体角度来研究中药炮制前后成分变化的方法被广泛应用于中药研究领域[10-12],不同于以往的研究只有一个或者几个指标性成分,这2 种方法结合可通过同时分析糖类组分和非糖类组分,从整体上解释中药炮制前后成分的改变。本实验参考文献方法[10-11,13],应用UPLC(C18)-PDA、HPLC(NH2)-ELSD、高效凝胶渗透色谱(HPGPC)-ELSD 和超高效液相色谱质谱(UHPLC-Q-Orbitrap HRMS)等技术,基于代谢组学和糖组学方法,对黄芪蜜炙前后的糖类组分和非糖类组分进行系统的比较研究,为黄芪蜜炙后明确补中益气功效增强的物质基础提供参考。
1.1 仪器
HC-2518 型高速离心机(安徽中科中佳科学仪器有限公司);
旋转蒸发器(上海亚荣生化仪器厂);
KQ2200E 型超声波清洗器(昆山市超声仪器有限公司);
Q-Exactive 型四级杆-静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific 公司);
Waters 2695 型高效液相色谱仪、Waters 2998 型蒸发光散射器(ELSD)、Acquity UHPL 超高效液相(美国沃特世公司);
HH-4 型数显恒温水浴锅(金坛市杰瑞尔电器有限公司);
台式干燥箱(北京中兴伟业世纪仪器有限公司)。
1.2 试剂
乙腈、甲醇(赛默飞世尔科技有限公司)为质谱纯;
甲酸(天津市光复精细化工研究所)为色谱纯;
1-苯基-3-甲基-5-吡唑啉酮(PMP)购自上海麦克林生化科技有限公司;
土蜂蜜(批号GB14963)购自江西意蜂实业有限公司;
超纯水。
对照品D-(+)-木糖(纯度≥99%,批号D17N9S74410)、D-阿拉伯糖(纯度≥99%,批号Z23D11H135480)、D-半乳糖(纯度≥98%,批号Z22J9H64187)、D-(+)-半乳糖醛酸(纯度≥98%,批号K07J12B133073)、D-甘露糖(纯度≥98%,批号S08J12G137083)、D-岩藻糖(纯度≥98%,批号M23F8K29918)、鼠李糖(纯度≥98%,批号O12A10K95105)、D-果糖(纯度≥99%,批号J25N10R104151)、蔗糖(纯度≥98%,批号H22J9R53193)、水苏糖(纯度≥98%,批号J04D10R104841)、麦芽糖(纯度≥98%,批号RM0331FC14)、蜜二糖(纯度≥98%,批号K23M7S15176)、甘露三糖(纯度≥98%,批号L01J11Y117030)均购自上海源叶生物科技有限公司;
右旋糖酐相对分子质量标准(1 套,批号140637-201203)购于中国食品药品检定研究院;
D-葡萄糖(纯度>98%,批号50-99-7)购于北京索莱宝科技有限公司;
芒柄花苷(质量分数>98%,批号 201130)购于上海融禾医药科技有限公司;
毛蕊异黄酮葡萄糖苷(质量分数≥98%,批号5240)、芒柄花素(质量分数≥98%,批号3524)购于上海诗丹德标准技术服务有限公司;
黄芪甲苷(质量分数≥98.5%,批号C10735032)购于上海麦克林生化科技有限公司;
5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF,质量分数≥98%,批号H12M9Z61023)购于上海源叶生物科技有限公司。
1.3 药材
黄芪饮片(批号211004、211005、211009、211012、211015、211020)购自北京同仁堂(四川)健康药业有限公司,经山西中医药大学中药与食品工程学院中药炮制重点实验室张朔生教授鉴定为蒙古黄芪A.membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao 干燥根的生品饮片。
2.1 蜜炙黄芪的制备
取炼蜜,加适量开水稀释,按照《中国药典》2020年版通则0213 炮制通则蜜炙法,将炼蜜淋入一定量的生黄芪饮片中,拌匀,闷润8~10 h,闷透,将闷润好的黄芪置炒锅中,用文火炒至饮片不黏手,搓之即散,颜色深黄,略带焦斑,取出,放凉,备用。
2.2 黄芪和蜜炙黄芪多糖的制备
取黄芪和蜜炙黄芪药材饮片(批号211004)各50 g,先后分别加8、6 倍量的去离子水,在100 ℃煎煮2 次,每次2 h,合并提取液,减压浓缩至一定体积,缓缓加入无水乙醇至最终醇体积分数为70%,静置过夜,抽滤,上清液60 ℃挥干得小分子成分部位备用,沉淀60 ℃烘干得黄芪和蜜炙黄芪粗品多糖粉末。
各取半份黄芪和蜜炙黄芪粗品多糖粉末,200 mL 超纯水溶解,加入木瓜蛋白酶0.05 g(200 U),45 ℃下恒温水浴反应6 h,加原溶液体积1/3量10%的三氯乙酸,在冰浴中搅拌15 min 后静置30 min,3500 r/min 离心15 min,弃去沉淀,上清液冷冻干燥得黄芪和蜜炙黄芪总多糖。
2.3 黄芪和蜜炙黄芪多糖的组分表征
2.3.1 黄芪和蜜炙黄芪多糖的重均相对分子质量(Mw)分布范围分析
(1)对照品溶液制备:精密称取Mw分别为180、2700、9750、13 050、36 800、64 650、135 350、300 600、2 000 000 的右旋糖苷对照品适量,用超纯水溶解并定容至1 mL 的量瓶,配制成质量浓度为2 mg/mL的对照品溶液,13 000 r/min 离心15 min,0.22 μm微孔滤膜滤过,供进样分析。
(2)供试品溶液制备:精密称取“2.2”项下的黄芪和蜜炙黄芪粗多糖适量,分别加超纯水定容至1 mL,配制成质量浓度为15 mg/mL 的供试品溶液。13 000 r/min 离心15 min,0.22 μm 微孔滤膜滤过,供进样分析。
(3)色谱条件:参考文献报道[10-11,13],采用TSK-GEL G4000PWXL 凝胶柱(300 mm×7.8 mm,10 μm)色谱柱,柱温35 ℃,流动相为超纯水,体积流量0.5 mL/min,进样体积10 μL,ELSD 漂移管温度115 ℃,N2体积流量3.2 L/min。
2.3.2 黄芪和蜜炙黄芪多糖的单糖组成分析
(1)对照品溶液的制备:取各单糖对照品适量,精密称定,分别用超纯水溶解并定容,制成甘露糖2.11 mg/mL、鼠李糖2.01 mg/mL、半乳糖醛酸2.06 mg/mL、葡萄糖2.04 mg/mL、阿拉伯糖2.09 mg/mL、木糖2.00 mg/mL、岩藻糖2.03 mg/mL、半乳糖2.05 mg/mL 的单一对照品溶液。精密吸取各单一对照品溶液200 μL,加入氨水溶液和0.5 mol/L 的PMP 甲醇溶液各200 μL,混合,70 ℃反应30 min,冷却,加入200 μL 冰醋酸中和溶液,再加1 mL 氯仿萃取3 次,有机相弃,吸取全部上清液稀释10 倍,13 000 r/min 离心15 min,0.22 μm 微孔滤膜滤过后供进样。
(2)供试品溶液的制备:精密称取“2.2”项下的黄芪和蜜炙黄芪总多糖适量,分别加超纯水定容至10 mL,配制成15 mg/mL 的多糖溶液。精密吸取多糖溶液各0.5 mL,加入3 mol/L 三氟乙酸3 mL,封口,100 ℃水解3 h,冷却,60 ℃烘干,加入1 mL超纯水复溶,即得黄芪和蜜炙黄芪多糖水解液。精密吸取多糖水解液500 μL,加入氨水溶液和0.5 mol/L 的PMP 甲醇溶液各100 μL,混合,70 ℃反应30 min,冷却,加入100 μL 冰醋酸中和溶液,再加0.5 mL 氯仿萃取3 次,有机相弃,吸取全部上清液稀释10 倍,13 000 r/min 离心15 min,即得黄芪和蜜炙芪多糖水解液衍生化样品,0.22 μm 微孔滤膜滤过后供进样。
(3)色谱条件:参考文献报道[10-11,13],采用Hypersil Gold C18色谱柱(250 mm×4.6 mm,5 μm),设置柱温35 ℃,流动相为乙腈-0.1 mol/L 乙酸铵水溶液,梯度洗脱:0~5 min,15%~20%乙腈;
5~30 min,20%~28%乙腈;
30~31 min,28%~15%乙腈;
31~33 min,15%乙腈;
体积流量0.8 mL/min;
进样量10 μL;
检测波长250 nm。
2.3.3 黄芪和蜜炙黄芪中寡糖及果糖的分析
(1)对照品溶液制备:取各寡糖及果糖对照品适量,精密称定,分别用60%乙腈溶解并定容,制成甘露三糖1.00 mg/mL、蔗糖1.22 mg/mL、麦芽糖1.04 mg/mL、蜜二糖1.01 mg/mL、水苏糖1.04 mg/mL、果糖1.12 mg/mL 的单一对照品溶液。
(2)供试品溶液制备:精密称取“2.2”项下黄芪和蜜炙黄芪小分子成分部位适量,用超纯水溶解并定容至10 mL 量瓶中,配制成15 mg/mL 的溶液,精密吸取1 mL,60 ℃蒸干,用60%乙腈溶解并定容至10 mL,13 000 r/min 离心15 min,0.22 μm 微孔滤膜滤过后供进样。
(3)色谱条件:参考文献报道[10-11,13],采用Agilent ZORBAX NH2 柱(250 mm×4.6 mm,5 μm)色谱柱;
柱温35 ℃;
流动相为乙腈-水(70∶30);
体积流量1 mL/min;
进样量10 μL;
ELSD 漂移管温度100 ℃;
N2体积流量3.2 L/min。
2.3.4 黄芪和蜜炙黄芪游离单糖分析 取“2.2”项下黄芪和蜜炙黄芪小分子成分部位150 mg,用超纯水溶解并定容至10 mL 量瓶,配制成15 mg/mL 的溶液,精密吸取100 μL,按“2.3.2(2)”项下方法衍生化制备供试品溶液,并采用“2.3.2”项下色谱条件进行检测。因果糖为酮糖,无法进行PMP 衍生化,采用“2.3.3(3)”项下方法进行检测。
2.3.5 单糖和寡糖测定的方法学考察
(1)线性关系和范围:分别取衍生化后单糖的混合对照品以及果糖和蔗糖的混合对照品溶液适量,制备成不同浓度的系列混合对照品溶液,再分别按照“2.3.2”和“2.3.3”项下色谱条件进样测定,以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线 [其中果糖和蔗糖以对照品质量浓度的对数为横坐标(X),峰面积的对数为纵坐标(Y),绘制标准曲线],如表1所示,结果表明各成分在各自范围内线性关系良好。

表1 单糖和寡糖的线性关系Table 1 Linear relation of monosaccharides and oligosaccharide
(2)精密度试验:称取“2.2”项下的黄芪总多糖和小分子成分部位各150 mg,精密称定,分别按照“2.3.2”项和“2.3.3”项中供试品制备的方法制备供试品溶液,再分别按照“2.3.2”和“2.3.3”项下色谱条件各连续进样6 次,结果表明,两种供试品溶液各成分峰面积的RSD 值均小于2%,说明该仪器精密度良好。
(3)重复性试验:称取“2.2”项下的黄芪总多糖和小分子成分部位各150 mg,精密称定,分别按照“2.3.2”项和“2.3.3”项中供试品制备的方法制备供试品溶液各6 份,分别按照“2.3.2”和“2.3.3”项下色谱条件进样测定,计算各成分的含量并求得RSD 值,结果表明两种方法各成分含量的RSD 值均小于2%,说明单糖和寡糖测定方法的重复性较好。
(4)稳定性试验:用精密度试验中黄芪总多糖和小分子成分部位的样品,按照“2.3.2”和“2.3.3”项下色谱条件,在2、4、6、8、12、24 h 进样分析,结果表明,各分析物峰面积的RSD 值均小于2%,说明2 种供试品溶液在24 h 内均稳定。
(5)加样回收率试验:取“2.2”项下的各成分含量已知的黄芪总多糖和小分子成分部位各150 mg,精密称定,上述2 种样品各平行制备6 份,向黄芪总多糖中加入甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖含量100%的对照品溶液,向小分子成分部位中加入果糖和蔗糖含量100%的对照品溶液,分别按照“2.3.2”和“2.3.3”项下色谱条件进样测定,得甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖、果糖和蔗糖的平均加样回收率分别为 96.58%、97.38%、98.38%、97.87%、96.69%、99.29%、98.13%、97.58%、97.90%,RSD 分别为1.85%、2.11%、2.83%、1.04%、1.87%、1.67%、2.78%、1.16%、1.20%。结果说明单糖和寡糖的测定方法准确度良好。
2.3.6 各糖类组分分析结果
(1)多糖Mw分布:以右旋糖苷对照品保留时间为横坐标,Mw的对数值为纵坐标,得线性回归方程lgMw=12.084-0.453 6t,R2=0.997 1。黄芪和蜜炙黄芪多糖色谱图见图1,根据对照品线性回归方程计算黄芪多糖Mw分布范围为266~1.65×109,有3 个明显的色谱峰,Mw分别为3.64×106、4.25×103、623,根据峰面积计算其相对含量分别为54.55%、14.05%、31.41%;
蜜炙黄芪多糖Mw分布范围为200~1.36×109,同样有3 个主要色谱峰,Mw分别为2.34×106、4.03×103、642,相对含量分别为55.24%、6.92%、37.85%,如图2所示。

图1 黄芪和蜜炙黄芪多糖的HPGPC 图Fig.1 HPGPC chromatograms of polysaccharides of AR and HAR

图2 黄芪和蜜炙黄芪多糖不同相对分子质量占比Fig.2 Different molecular weight proportions of AR and HAR
多糖最基本的特征是多糖相对分子质量的分布,相对分子质量的改变意味着多糖性质的改变。因此,本实验采用多分散系数(α)[14](α=Mw/Mn),将多糖的相对分子质量进行量化处理(Mn=∑Hi/∑Hi/Mi,Mw=∑HiMi/∑Hi,Mn为数均相对分子质量;
Hi为供试品在保留时间i的响应值;
Mi为样品i的相对分子质量,即供试品在保留时间i的相对分子质量)。最后计算得黄芪和蜜炙黄芪3 种多糖的α 分别为5.098、7.889、1.089 和7.742、5.288、1.085。
(2)黄芪和蜜炙黄芪多糖的单糖组成分析结果:通过与单糖的混合对照品色谱图保留时间进行比较(图3),黄芪和蜜炙黄芪多糖均含有甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖等,采用标准曲线法计算各单糖的含量,并换算成相对物质的量比,生黄芪多糖中各个单糖物质的量比为0.70∶0.20∶0.85∶5.67∶0.44∶2.04∶0.32,炙黄芪中各个单糖物质的量比为0.79∶0.15∶0.73∶7.10∶0.31∶1.71∶0.35,结果表明黄芪和蜜炙黄芪各单糖组成无明显差别,而蜜炙黄芪多糖中葡萄糖含量比例上升。
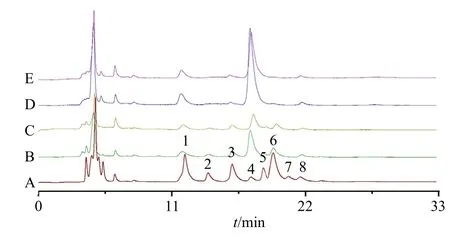
图3 黄芪和蜜炙黄芪中单糖的UPLC 图Fig.3 UPLC chromatograms of monosaccharides of AR and HAR
(3)黄芪和蜜炙黄芪寡糖分析结果:黄芪和蜜炙黄芪均含有蔗糖(图4),采用标准曲线法计算蔗糖含量,结果表明黄芪在蜜炙后,蔗糖含量由(197.74±26.32)mg/g 显著下降至(147.22±20.86)mg/g(P<0.001)。

图4 黄芪和蜜炙黄芪中寡糖和果糖的HPLC 图Fig.4 HPLC chromatograms of oligosaccharides and fructose in AR and HAR
(4)黄芪和蜜炙黄芪游离单糖分析结果:黄芪和蜜炙黄芪均含有甘露糖、半乳糖醛酸、葡萄糖和岩藻糖(图3)。用标准曲线法计算样品中游离单糖的含量,由表2 可见,蜜炙黄芪中果糖、甘露糖、葡萄糖含量显著高于黄芪(P<0.05、0.01),而半乳糖醛酸的含量显著低于黄芪(P<0.05)。
表2 黄芪和蜜炙黄芪中游离单糖的含量(±s,n=9)Table 2 Contents of free monosaccharides in AR and HAR(±s,n = 9)
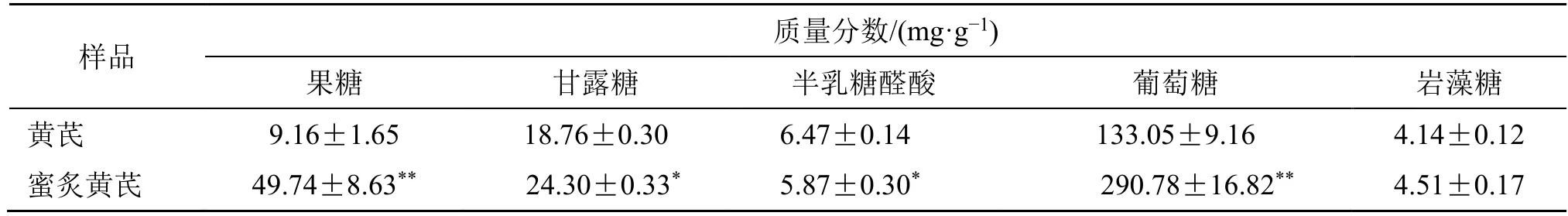
表2 黄芪和蜜炙黄芪中游离单糖的含量(±s,n=9)Table 2 Contents of free monosaccharides in AR and HAR(±s,n = 9)
与黄芪比较:*P<0.05 **P<0.01 ***P<0.001,表4 同*P < 0.05 **P < 0.01 ***P < 0.001 vs AR,same as table 4
样品 质量分数/(mg·g-1)果糖 甘露糖 半乳糖醛酸 葡萄糖 岩藻糖黄芪 9.16±1.65 18.76±0.30 6.47±0.14 133.05±9.16 4.14±0.12蜜炙黄芪 49.74±8.63** 24.30±0.33* 5.87±0.30* 290.78±16.82** 4.51±0.17
2.4 黄芪和蜜炙黄芪非糖小分子组分表征
2.4.1 对照品溶液的制备 取黄芪甲苷、芒柄花苷、芒柄花素、毛蕊异黄酮葡萄糖苷、5-HMF 对照品适量,精密称定,用甲醇溶解并定容,混合,再用倍半稀释法制成含黄芪甲苷0.011 mg/mL、芒柄花苷0.099 mg/mL、芒柄花素0.010 mg/mL、毛蕊异黄酮葡萄糖苷0.010 mg/mL、5-HMF 0.099 mg/mL 的混合对照品溶液。
2.4.2 供试品溶液的制备 取黄芪药材饮片(批号211004、211005、211009、211012、211015、211020)共6 批,按“2.1”项下方法炮制蜜炙黄芪饮片,并按“2.2”项下方法制备黄芪和蜜炙黄芪的小分子部位,得黄芪和蜜炙黄芪小分子部位各6 批,每批制备2 份(共12 份)供试品溶液。各取黄芪和蜜炙黄芪小分子部位适量,加甲醇配制成5 mg/mL的溶液,再吸取1 mL,过ODS 固相萃取小柱后定容至10 mL,13 000 r/min 离心15 min,同样的方法共制备黄芪和蜜炙黄芪小分子部位供试品溶液各12 份,0.22 μm 微孔滤膜滤过后进样。2.4.3 UHPLC-Q-Orbitrap HRMS 分析 采用代谢组学策略对黄芪和蜜炙黄芪中的差异性非糖小分子进行筛选,对代表性成分进行定量分析,其中5-HMF 由于其弱离子化,采用UPLC-PDA 检测。
(1)色谱条件:ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);
流动相为0.1%甲酸水溶液(A)-乙腈溶液(B),梯度洗脱0~0.5 min,5%A;
0.5~1.5 min,5%~15%A;
1.5~4.5 min,15%~30%A;
4.5~7 min,30%~60%A;
7~11 min,60%~70%A;
11~12 min,70%~100%A;
12~13 min,100%A;
13~13.5 min,100%~5%A;
13.5~16 min,5%A;
体积流量0.3 mL/min,进样量1 μL,柱温40 ℃;
进样量2 μL。5-HMF 的检测波长283 nm。
(2)质谱条件:采用电喷雾离子源(ESI),正、负离子同时采集,鞘气体积流量40 arb,辅助气体积流量5 arb,喷雾电压3.2 kV,毛细管温度320 ℃,辅助气加热温度350 ℃,高压环形离子导入装置电压(S-Lens RF Level)为50。检测模式采用全扫描/数据依赖二级扫描(Full MS/dd-MS2),扫描范围为m/z100~1000,一级质量分辨率为70 000 FWHM,二级分辨率17 500 FWHM,碰撞能量为30 eV。
2.4.4 数据采集与处理 采用 Compround Discoverer 3.3 软件对质谱数据进行峰提取、峰匹配、保留时间对齐、碎片离子采集及峰面积归一化等处理,再结合mz-Cloud、Chemspider 数据库进行成分鉴定和匹配。将处理的数据导入SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)。统计学分析采用SPSS 26.0 软件。
2.4.5 差异性成分分析 运用SIMCA 14.1 软件分析,将数据Par 标准化后,去除离群值,得到正、负离子模式下生黄芪和蜜炙黄芪的 PCA 图、OPLS-DA 图和S-plot 图,由图5 可知,黄芪组和蜜炙黄芪组可明显区分,说明2 组之间的非糖小分子成分存在差异。以VIP>1,t检验(P<0.05),分子离子的相对质量偏差在±5×10-6以内,mz-Cloud数据库成分鉴定匹配得分大于70%为标准来筛选黄芪和蜜炙黄芪之间的显著性差异成分,再结合相关文献,最后共鉴定出20 个差异性成分(图6、表3),其中黄酮类成分6 个,皂苷类成分8 个。表3 中的差异倍数(fold change)大于1 表示与黄芪相比,蜜炙黄芪中的含量水平上调,小于1 表示水平下调。将鉴定出的20 个差异性成分的峰面积归一化数据进行热图分析,结果见图7。

图7 黄芪和蜜炙黄芪的差异成分热图分析Fig.7 Heat map analysis of differential components in AR and HAR

表3 黄芪和蜜炙黄芪中非糖小分子差异性成分Table 3 Differential non-sugar small molecules of AR and HAR

图5 正、负离子模式下黄芪和蜜炙黄芪的PCA 图(A、D)、OPLS-DA 图(B、E)、S-plot 图(C、F)Fig.5 PCA plot(A、D)、OPLS-DA plot(B、E)、S-plot diagram(C、F)of AR and HAR in postive ion mode and negative ion mod

图6 正(A、C)、负(B、D)离子模式下黄芪(A、B)和蜜炙黄芪(C、D)的TIC 图Fig.6 TIC chromatograms of AR(A、B)and HAR(C、D)in postive ion mode(A、C)and negative ion mode(B、D)
2.4.6 代表性成分含量测定 采用外标一点法计算样品中毛蕊异黄酮葡萄糖苷、芒柄花苷、芒柄花素、黄芪甲苷和5-HMF 的含量。由表4 可知黄酮类成分和皂苷类成分在黄芪和蜜炙黄芪中含量差异较大。与黄芪相比,蜜炙黄芪中的黄酮类成分毛蕊异黄酮葡萄糖苷、芒柄花素、芒柄花苷含量明显降低(P<0.05、0.01),皂苷类成分黄芪甲苷显著增加(P<0.01)。呋喃醛衍生物5-HMF 在黄芪中未检测到,在蜜炙黄芪中的含量显著升高(P<0.001)。
表4 黄芪和蜜炙黄芪中代表性非糖小分子成分的含量比较(±s,n = 12)Table 4 Comparison of representative non-sugar small molecules of AR and HAR(±s,n = 12)

表4 黄芪和蜜炙黄芪中代表性非糖小分子成分的含量比较(±s,n = 12)Table 4 Comparison of representative non-sugar small molecules of AR and HAR(±s,n = 12)
样品 质量分数/(mg·g-1)毛蕊异黄酮葡萄糖苷 芒柄花素 芒柄花苷 黄芪甲苷 5-HMF黄芪 146.29±4.38 311.15±8.03 69.67±2.40 111.29±4.60 0蜜炙黄芪 94.02±5.11** 242.94±7.76* 55.07±2.91* 280.53±9.18** 676.10±23.47***
本研究结合糖组学(UPLC-PDA、HPLC-ELSD、HPGPC-ELSD)和代谢组学(UHPLC-Q-Orbitrap HRMS)技术,分析比较了黄芪和蜜炙黄芪中的糖类组分和非糖小分子组分的差异。
黄芪多糖部位通过色谱分析发现含有重均Mw分别为3.64×106、4.25×103、623 的3 种多糖,蜜炙黄芪多糖部位含有重均Mw分别为2.34×106、4.03×103、642 的3 种多糖,说明黄芪多糖中Mw最大的组分(Mw=3.64×106)的重均Mw要大于蜜炙黄芪中Mw最大的多糖组分(Mw=2.34×106),同时黄芪和蜜炙黄芪多糖中Mw最大组分的多分散系数分别为5.098、7.742,说明相比于蜜炙黄芪,生品黄芪该组分更加均一,其原因可能为炮制过程中高Mw多糖裂解成较小Mw的多糖[23-24],导致Mw降低,同时组分更加不均一。蜜炙黄芪中重均Mw为642 的多糖组分占比要大于生品黄芪,重均Mw为4.03×103的多糖组分占比要小于生品黄芪,其原因可能为炮制过程中的加热因素对重均Mw为4.03×103的多糖影响较大,其发生降解,导致相对分子质量降低;
而重均Mw为2.34×106的多糖变化较小。
通过分析发现,与黄芪相比蜜炙黄芪中果糖含量升高了5 倍,葡萄糖含量升高了2 倍。其原因为蜂蜜本身含有大量的果糖、葡萄糖和少量的蔗糖。而蜜炙黄芪中蔗糖的含量显著降低,可能存在以下两方面的原因,一方面为炮制所用蜂蜜为炼蜜,在炼蜜过程中其少量的蔗糖已经发生了水解、糖基化以及美拉德反应,另一方面为黄芪炮制过程中存在的水分和加热因素使蔗糖水解为果糖和葡萄糖,并发生了糖基化和美拉德反应[25],产生了5-HMF 等呋喃醛衍生物[10,12],使蔗糖降解,最终导致蜂蜜中少量蔗糖的引入不足以抵消其炮制过程中的转化和降解。查阅文献发现[26-27],炼蜜随着时间的延长和温度的增加,5-HMF 的含量也随之增加[28],果糖较之于葡萄糖和蔗糖,更易转化为5-HMF,因此加蜜炮制后5-HMF 的含量会更高[29]。现代研究结果表明,5-HMF具有保护肝细胞[30]、抗炎和抗氧化[31]等作用。
查阅文献发现多糖作为黄芪中的重要生物活性成分,通过降低血糖、改善胰岛素抵抗、抑制胰岛β细胞凋亡等机制预防和治疗糖尿病及其并发症[32-34]。对于蜜炙黄芪中多糖类组分在炮制过程中发生的Mw、Mw分布以及含量的变化,会对黄芪的功效产生何种影响还需要进一步深入的研究。糖类组分中的蔗糖在机体中经蔗糖酶水解生成单糖,可使血糖升高,可能引发胰岛素抵抗,对各器官组织产生毒性作用,导致糖尿病及并发症的发生[35-36]。研究发现,蔗糖比单体果糖和葡萄糖更能引起严重的糖脂代谢异常[37]。本实验结果表明,黄芪蜜炙后蔗糖含量下降,而果糖和葡萄糖含量明显上升。果糖不仅是一种提供热量的己糖,还可能潜在影响机体行为和参与某些代谢途径[38],包括中枢系统、肝脏代谢、炎症反应、肠道微生物群和骨骼肌基因表达等[39]。对于非糖类组分,蜜炙黄芪中毛蕊异黄酮、毛蕊异黄酮葡萄糖苷、芒柄花素、芒柄花苷等多种黄酮及其苷类成分含量下降,而黄芪甲苷、异黄芪皂苷II、大豆皂苷Bb 等多种皂苷类成分含量上升。其原因可能是炮制过程中黄酮类成分结构发生了转化导致其含量降低,而炮制使皂苷类成分更易煎出因此含量上升。
本课题组前期研究表明黄芪中的多糖和皂苷类成分能明显促进机体物质能量代谢[20]。但多糖作为大分子化合物,空间构型复杂,本实验对多糖部分的研究还无法充分阐释黄芪蜜炙后多糖结构改变的机制以及其与药效的关系。因此,黄芪蜜炙后具有显著差异性的糖类组分和非糖类组分在整体上对蜜炙黄芪药效的影响还需要进一步研究。
利益冲突所有作者均声明不存在利益冲突
猜你喜欢单糖果糖批号一种JTIDS 信号批号的离线合批方法航天电子对抗(2022年4期)2022-10-24雪莲果低聚果糖化学成分及其生物活性中成药(2021年5期)2021-07-21果糖基转移酶及低聚果糖生产研究进展食品界(2019年8期)2019-10-07海藻多糖的单糖组成对体外抗氧化活性的影响天然产物研究与开发(2019年1期)2019-03-01医学科技期刊中药品生产批号标注探析中国科技纵横(2018年2期)2018-11-29中药材批号划分与质量管理中成药(2018年7期)2018-08-04蹄叶槖吾叶多糖提取工艺优化及单糖组成研究天然产物研究与开发(2016年1期)2016-06-05HPLC-ELSD法测定不同产地麦冬及山麦冬中的果糖中成药(2016年4期)2016-05-17气相色谱法分析大麻药多糖成分中单糖组成中南民族大学学报(自然科学版)(2015年2期)2015-12-16HPLC-ELSD法测定烟草中单糖含量中南民族大学学报(自然科学版)(2015年2期)2015-12-16推荐访问:组分 黄芪 糖类