辣椒素通过肠道菌群改善DSS诱导的小鼠结肠炎
来源:优秀文章 发布时间:2023-03-10 点击:
郭雪,徐婧,徐豪明,张艳,黄琛,聂玉强,周永健,周有连
【提要】目的 探讨不同剂量的辣椒素对小鼠溃疡性结肠炎肠道炎症和肠道菌群的影响。方法 将25只清洁级6~8周龄C57小鼠随机分为正常对照组、葡聚糖硫酸钠(DSS)组、辣椒素(5 mg/kg CAP)+DSS组、辣椒素(10 mg/kg CAP)+DSS组、辣椒素(20 mg/kg CAP)+DSS组,每组5只。通过自由饮用3% DSS水诱导小鼠结肠炎模型。在DSS干预前7 d,每天给予200 μL相应剂量的辣椒素灌胃,至干预的第8天处死。观察记录小鼠体质量、疾病活动指数(DAI)、测量结肠长度;
利用实时荧光定量聚合酶链式反应(RT-qPCR)和蛋白印迹(WB)检测结肠组织的炎症因子及肠道屏障的基因转录水平以评估辣椒素对结肠炎小鼠的作用;
并通过粪便16S rRNA测序检测小鼠肠道菌群。结果 辣椒素在一定范围内,成剂量依赖性改善小鼠肠炎大体,下调促炎症因子IL-6、IL-18的表达,增强肠道屏障ZO-1、MUC2、Tff3、Occludin的表达;
并可重塑肠炎肠道菌群组成,改变菌群相对物种丰富度。结论 辣椒素在合适的剂量范围内可有效改善小鼠结肠炎,并调整小鼠肠道菌群结构。
溃疡性结肠炎(ulcerative colitis, UC)是炎症性肠病(inflammatory bowel disease, IBD)的一种,是一种慢性非特异性肠道炎症,病因不明,临床治疗效果不佳,多认为与遗传易感因素、环境因素、免疫因素及肠道菌群改变有关[1]。IBD患者的肠道菌群紊乱常以有益菌的减少及有害菌的增多为特征,临床上也尝试使用粪菌移植(fecal microbiota transplantation,FMT)技术重塑患者肠道菌群治疗UC,但其疗效目前仍存在争议[2]。辣椒是一种药食两用的草本植物,可用作饮食调味剂和中草药,具有悠久的历史[3]。辣椒素是辣椒的主要活性成分,具有抗炎、抗肿瘤、镇痛、增强造血干细胞动员等作用[4-6]。目前,辣椒素对IBD的影响尚存在争议且辣椒素影响肠道菌群的研究报道尚少。本研究使用葡聚糖硫酸钠(DSS)构建肠炎小鼠模型,给予小鼠不同剂量的辣椒素干预,通过评估小鼠的体重、疾病活动指数(disease activity index, DAI)、炎症因子及黏膜屏障的表达、粪便菌群变化,探讨辣椒素对DSS 诱导结肠炎的疗效,并初步探讨辣椒素改善肠炎与肠道菌群的关系。
1.1 动物及主要试剂
1.1.1 动物 25只清洁级8~10周龄、体重为22~25 g的雄性C57小鼠,购自广东省医学实验动物中心并饲养于华南理工大学附属第二医院(广州市第一人民医院)26 ℃恒温动物实验室【实验动物生产许可证号为SCXK(粤)2022-0002】。相关动物方案经过华南理工大学附属第二医院(广州市第一人民医院)管理委员会批准。
1.1.2 试剂及仪器 DSS购自美国MP Biomedical公司;
辣椒素购自MCE (HY-10448); RNA later、Trizol、购自美国Thermo Fisher Scientific公司;
PCR逆转录试剂盒及TB Green Premix Ex TaqⅡ购自日本Takara公司;
引物由上海生工生物工程有限公司合成;
普通PCR仪、Nanodrop2000微量分光光度计购自美国Thermo Fisher Scientific公司;
实时荧光定量PCR仪为德国Analytik Jena公司产品;
Occludin抗体购自美国Proteintech Group公司(货号:27260-1-AP);
MUC2抗体购自爱博泰克生物公司(货号:A4767)。
1.2 实验方法
1.2.1 辣椒素溶液配置 根据试剂说明书,加入无水乙醇溶解为100 mg/mL储备液,-80 ℃冰箱保存,小鼠灌胃前加入适量玉米油,配置为相应的工作液浓度。
1.2.2 结肠炎小鼠模型的建立与取材 小鼠在12 h昼夜交替、26 ℃环境适应性饲养一周。将25只清洁级6~8周龄C57小鼠随机分为空白对照组(正常对照组)、葡聚糖硫酸钠组(DSS组)、辣椒素(5 mg/kg)+DSS组(DSS+CAP5)、辣椒素(10 mg/kg)+DSS组(DSS+CAP10)、辣椒素(20 mg/kg)+DSS组(DSS+CAP20),每组5只。DSS干预方案:予小鼠含DSS(质量体积分数为3%)的饮用水连续、自由饮用7 d,构建小鼠急性结肠炎模型。辣椒素给药方案:DSS造模前7 d,治疗组每天给予相应浓度的辣椒素200 μL灌胃,DSS组予相应剂量的PBS灌胃,至DSS造模结束,共14 d。每天定时称量小鼠的体重,观察并记录粪便性状及隐血情况。结束造模采用颈椎脱臼法处死。取回肠、结肠及直肠拍照测量。取出盲肠内容物,于-80 ℃保存,用于16S rRNA测序。
1.2.3 DAI评分 根据赵亚妮等[7]的评分标准,在DSS造模期间,每日记录小鼠体重,粪便性状及血便情况:每日体重与初始体重相比,体重下降百分比为0~1%计0分,1%~5%计1分,5%~10%计2分,10%~15%计3分,≥15%计4分;
粪便性状无异常计0分,粪便松散计2分,稀便计4分;
粪便隐血试验阴性计0分,粪便隐血试验阳性计1分,肉眼血便计2分。根据症状评分计算DAI:DAI=(体重下降得分+粪便性状得分+粪便隐血或肉眼血便得分)/3。
1.2.4 实时荧光定量聚合酶链式反应(Real-time qPCR) 根据Trizol试剂说明书,对肠组织进行研磨,提取RNA并检测纯度和浓度,稀释为相应浓度;
根据逆转录试剂说明书进行逆转录,采用SYBR Green按照95 ℃预变性30 s,95 ℃变性15 s,40个循环;
60 ℃退火1 min,40个循环;
95 ℃ 1 s;
Melt,6 s反应进行扩增,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,按照2-ΔΔCT法进行定量分析。
1.2.5 小鼠肠道16S rRNA测序 用DNA抽提试剂盒提取粪便DNA,并使用通用引物515F (5′-GTGCCAGCMGCCGC-GGTAA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′) 进行样本16S rRNAV4区PCR扩增,基于IonS5TM XL测序平台进行高通量测序(北京诺禾致源科技股份有限公司提供技术支持),应用Silva132数据库进行物种注释。选取各组门、科水平相对丰度前10位的物种绘制堆叠图,分析物种组成。利用线性判别分析效应量(linear discriminantanalysis effect size,LEfSe)差异分析算法筛选出各组差异有统计学意义的优势菌[线性判别式分析(lineardiscriminant analysis, LDA)评分≥4 log10][8]。
1.2.6 蛋白印迹(Western blot) 取小鼠结肠经RIPA+蛋白酶抑制剂+磷酸酶抑制剂混合液匀浆裂解,后用BCA法测定蛋白浓度,配制10%的聚丙烯凝胶,经电泳、转膜后,用脱脂奶粉封闭,一抗4 ℃过夜,抗体浓度为Occludin (1∶1 000)、MUC2(1∶500);
复温后,二抗孵育1 h,TBST清洗后,显影。
1.3 统计学方法
应用SPSS 26和ImageJ 1.52软件进行统计学分析,Graphpad Prism 9.4.0和Adobe Illustrator 2021绘图。两组间比较用两样本t检验,多组间采用单因素方差分析,重复测量计量资料采用重复测量方差分析。P<0.05有统计学差异。
2.1 辣椒素缓解小鼠体重下降,改善DAI评分
空白对照组小鼠一般情况良好,体质量平稳上升,DAI在0分上下波动,DSS组小鼠在造模4天后开始出现活动度减少、毛色暗淡、体重下降等现象,症状逐渐加重,出现腹泻、肉眼血便。从第4天起,体重下降与正常组小鼠相比出现统计学差异(第4天:P<0.05;
第5、6、7天:P均<0.001)。给予辣椒素干预的治疗组中,小鼠体重下降程度均低于DSS组,且与辣椒素剂量成正比。如图1A所示,与模型组相比,给予20 mg/kg剂量的辣椒素组,体重下降在造模的第5、6、7天均有统计学差异(P均<0.01),给予10 mg/kg剂量的辣椒素组,在第7天有统计学差异(P<0.01),5 mg/kg的辣椒素组无统计学差异,但可见减缓体重下降的趋势。实验终点时,空白组小鼠疾病活动程度趋近于0,DSS组小鼠DAI显著升高(P<0.0001),给予辣椒素干预后DAI降低。如图1B所示,末次(第7天)DAI评分中,20 mg/kg CAP+DSS组DAI下降最为明显,有统计学差异(P<0.01),10 mg/kg组有下降趋势,但无统计学意义(P>0.05)。

图1 各组小鼠的体质量下降百分比及末次DAI评分 A:体质量下降百分比;
B:末次DAI评分(注释:#表示模型组与正常组相比;
*表示辣椒素干预组与模型组相比;
#:P<0.05;
##:P<0.01;
###:P<0.001;
####:P<0.0001;
*:P<0.05;
**:P<0.01;
***:P<0.001;
****:P<0.0001)
2.2 辣椒素降低小鼠死亡率及缓解肠炎小鼠的结肠缩短与病理损伤
与正常组相比,DSS组结肠长度明显缩短(P<0.001),给予辣椒素干预后,结肠缩短有改善,其中以20 mg/kg剂量组最为显著(P<0.01,图2A和B);
在DSS造模的第6天,模型组小鼠1只出现死亡,第7天,5 mg/kg剂量辣椒素组出现1只死亡,其余组全部存活。对照组小鼠结肠黏膜完整,腺体结构排列整齐,杯状细胞丰富,固有层无明显中性粒细胞浸润,而肠炎模型组小鼠结肠上皮完整性损害严重,上皮细胞破坏,腺体缺损,黏膜固有层可见中性粒细胞浸润严重。辣椒素干预后,可不同程度缓解上皮的破坏,部分腺体恢复,杯状细胞数量增加,但病理评分未见差异(图2C-H)。

图2 各组小鼠结肠长度及HE染色 A:结肠大体;
B:结肠长度统计;
C:正常对照组;
D:DSS组;
E:5 mg/kg辣椒素干预组;
F: 10 mg/kg辣椒素干预组;
G: 20 mg/kg辣椒素干预组;
H:组织病理评分(#表示模型组与正常组相比;
*表示辣椒素干预组与模型组相比,DSS+CAP5和DSS+CAP20各只小鼠评分相同)
2.3 辣椒素降低小鼠炎症并增强肠道屏障
利用实时荧光定量聚合酶链式反应(Real-time qPCR)检测结肠组织的炎症因子及黏膜屏障的基因转录水平。如图3A所示,DSS干预后,炎症因子IL-6、IL-18显著升高(P均<0.001);
屏障蛋白ZO-1、黏液屏障MUC2表达量显著降低 (ZO-1:P<0.01;
MUC2:P<0.0001)。给予辣椒素干预后,炎症因子水平与模型组相比显著下降(10 mg/kg组:IL-6和IL-18:P均<0.0001;
20 mg/kg组:IL-6和IL-18:P均<0.0001;
IL-1β:P=0.0267);
而屏障蛋白表达量显著升高(5 mg/kg组:ZO-1,Tff3:P均<0.0001;
MUC2:P<0.05;
20 mg/kg组:ZO-1和Tff3,P均<0.0001;MUC2,P0.05);与康等人报道结果一致[10]。Western Blot结果显示(图3B-C):DSS干预后,紧密连接蛋白Occludin表达显著降低(P<0.05);
给予辣椒素干预后,与模型组相比显著升高(10 mg/kg组和20 mg/kg组:P均<0.01);
黏液蛋白MUC2,辣椒素干预后,有升高趋势,但无统计学意义。
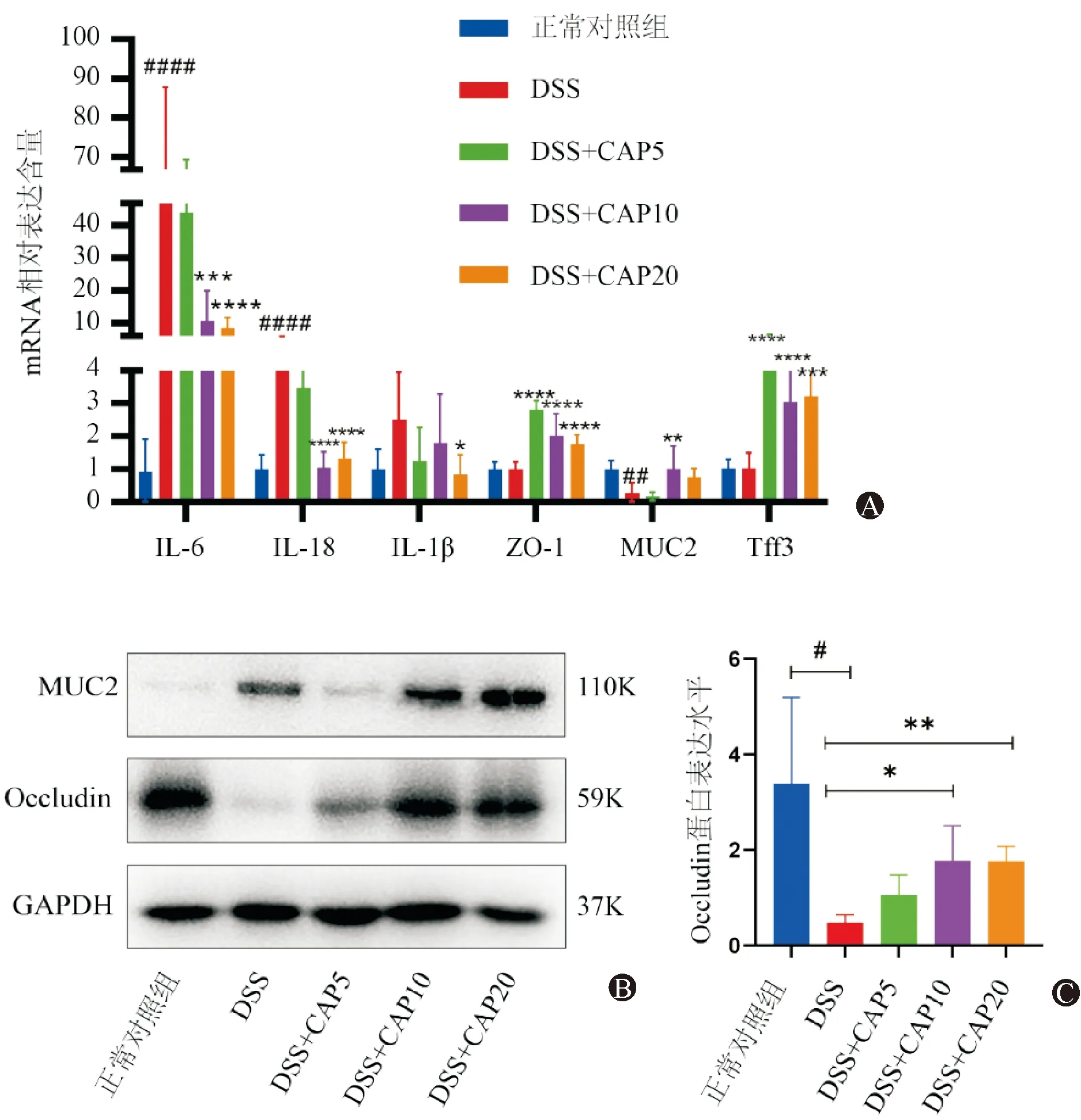
图3 炎症因子及屏障在各组水平 A: 小鼠结肠IL-6、IL-18、IL-1β、ZO-1、MUC2和Tff3 在各组的mRNA相对表达量;
B:MUC2和Occludin蛋白在各组的表达量;
C:Occludin蛋白表达水平柱状图(#表示模型组与正常组相比;
*表示辣椒素干预组与模型组相比)
2.4 辣椒素调节小鼠肠道菌群
2.4.1 物种组成分析
在门水平(图4A),各组优势菌门均为厚壁菌门、变形菌门、拟杆菌门。厚壁菌门在空白对照组小鼠肠道菌群中的相对丰度为71.17%,在DSS组中水平明显下降为26.15%,不同剂量辣椒素干预后,水平均较DSS组升高(分别为5 mg/kg:36.57%、 10 mg/kg:53.44%、20 mg/kg:47.58%);
变形菌门在空白对照组小鼠肠道菌群中的相对丰度为10.18%,在DSS组明显升高为42.78%,不同剂量辣椒素干预后,水平均较DSS组下降(分别为5 mg/kg:17.84%、 10 mg/kg:10.55%、20 mg/kg:13.15%);
拟杆菌门在空白对照组小鼠肠道菌群中的相对丰度为4.79%,在DSS组升高为9.35%,不同剂量辣椒素干预后,水平均较DSS组升高(分别为5 mg/kg:33.62%、 10 mg/kg:19%、20 mg/kg:28.99%)。
在科水平(图4B),各组优势菌科差异较大。肠杆菌科在空白对照组小鼠肠道菌群中的相对丰度为0.88%,在DSS组明显升高为36.54%;
不同剂量辣椒素干预后,水平均较DSS组降低(分别为5 mg/kg:15.62%、 10 mg/kg:6.25%、20 mg/kg:11.17%);
丹毒丝菌科在空白对照组小鼠肠道菌群中的相对丰度为25.80%,在DSS组降低为14.31%,不同剂量辣椒素干预后,水平均较DSS组升高(分别为5 mg/kg:23.21%、 10 mg/kg:28.67%、20 mg/kg:26.79%);
拟杆菌科在空白对照组小鼠肠道菌群中的相对丰度为2.97%,在DSS组升高为3.84%,不同剂量辣椒素干预后,水平均较DSS组升高(分别为5 mg/kg:18.49%、 10 mg/kg:7.19%、20 mg/kg:22.46%);
乳杆菌科在空白对照组小鼠肠道菌群中的相对丰度为19.55%,在DSS组显著下降为2.26%,其中以10 mg/kg与20 mg/kg的辣椒素干预后,水平较DSS组升高(分别3.68%、 3.38%);
毛螺菌科在空白对照组小鼠肠道菌群中的相对丰度为6.76%,在DSS组降低为1.63%,不同剂量辣椒素干预后,水平均较DSS组升高(分别为5 mg/kg:4.02%、 10 mg/kg:6.91%、20 mg/kg:3.8%)。


图4 物种相对丰度图及LEFSe分析 A:物种相对丰度图:门水平;
B:物种相对丰度图:科水平;
C:LDA值分布柱状图;
D:进化分支图
2.4.2 LEFSe分析
如图4 C和D所示:空白对照组出现了大量差异有统计学意义的细菌,包括厚壁菌门(LDA评分=5.328 log10,P=0.046)、梭菌纲(LDA评分=4.828 log10,P=0.049)、乳杆菌目(LDA评分=4.918 log10,P=0.004)、梭菌目UCG-014(LDA评分=4.599 log10,P=0.021)、颤螺菌目(LDA评分=4.335 log10,P=0.008)、芽胞杆菌目(LDA评分=4.121 log10,P=0.012)、乳杆菌科(LDA评分=4.921 log10,P=0.004)、瘤胃菌科(LDA评分=4.344 log10,P=0.011)、芽孢杆菌科(LDA评分=4.11 log10,P=0.007)、木质乳酸杆菌属:(LDA评分=4.826 log10,P=0.007)、回肠杆菌属:(LDA评分=4.370 log10,P=0.049)、毛螺菌属NK4A136_group:(LDA评分=4.208 log10,P=0.012)、乳杆菌属:(LDA评分=4.167 log10,P=0.016)、杆菌属:(LDA评分=4.087 log10,P=0.013)、鼠乳杆菌:(LDA评分=4.821 log10,P=0.007)、缬裂芽杆菌种:(LDA评分=4.367 log10,P=0.049)、炭疽杆菌:(LDA评分=4.07 log10,P=0.021);
DSS组出现的有统计学差异的细菌包括疣微菌门(LDA评分=4.605 log10,P=0.017);
疣微菌纲(LDA评分=4.628 log10,P=0.016)、肠杆菌目(LDA评分=5.176 log10,P=0.04)、疣微菌目(LDA评分=4.625 log10,P=0.018)、肠杆菌科(LDA评分=5.164 log10,P=0.018)、阿克曼斯亚科(LDA评分=4.613 log10,P=0.019)、埃希杆菌-志贺菌属(LDA评分=5.148 log10,P=0.022)、嗜黏蛋白阿克曼菌属:(LDA评分=4.608 log10,P=0.02)、大肠埃希氏菌(LDA评分=5.155, log10,P=0.022)、嗜黏蛋白阿克曼菌(LDA评分=4.588 log10,P=0.017;
5 mg/kg的辣椒素干预后的有统计学差异意义的细菌为拟杆菌门(LDA评分=5.184 log10,P=0.002);
拟杆菌纲(LDA评分=5.144 log10,P=0.002);
拟杆菌目(LDA评分=5.164 log10,P=0.018);
拟杆菌科(LDA评分=4.674 log10,P=0.004);
拟杆菌属(LDA评分=4.68 log10,P=0.004);
10 mg/kg的辣椒素干预后出现的有统计学差异的细菌包括毛螺菌目及毛螺菌科(LDA评分=4.463 log10,P=0.034);
20 mg/kg的辣椒素干预后出现的有统计学差异的细菌包括,消化链球菌目(LDA评分=4.276 log10,P=0.011)、消化链球菌科(LDA评分=4.264 log10,P=0.016)、罗姆布茨菌属及罗姆布茨菌种(LDA评分=4.246 log10,P=0.012)、木犀科(LDA评分=4.951 log10,P=0.004)、图里西杆菌属(LDA评分=4.538 log10,P=0.031)。
近十年来,IBD的患病率逐年上升,具体发病机制尚不明确。学者推测:饮食、心理等多种环境因素作用于遗传易感者,间接或直接导致肠道菌群紊乱,可引起肠道屏障损伤,诱发免疫系统紊乱,形成局部溃疡[1]。由此可见:肠道菌群在溃疡性结肠炎中发挥着不容小觑的作用。而辣椒素的药理作用在我国已有近百年的研究历史,已被证明有抗炎[9-10]、抗菌[11-12]、镇痛[13]、减肥调脂[14]、抗肿瘤[15]、保护消化系统[16]等作用,在我们的研究,辣椒素缓解了DSS诱导的溃疡性肠炎并调节肠道菌群,这将饮食中的辣椒素与肠道菌群建立联系。
本实验用含3% DSS自由饮用水构建小鼠急性肠炎模型,在造模第四天出现体重下降、腹泻、肉眼血便等症状,是UC患者的典型临床特征。依据DAI评分和结肠缩短可见模型组和正常组小鼠有显著差异,急性溃疡性结肠炎造模成功。当给予不同浓度的辣椒素灌胃7天,可见体重下降程度、DAI评分、结肠缩短程度成不同水平的改善,与蒋等人[17]在研究中指出50 mg/kg可防止胃肠道溃疡的结论一致。在DSS模型组中IL-6,IL-18,IL-1β等促炎因子显著上调,给予辣椒素干预后炎症因子显著下调,可发挥抗炎作用。外周膜蛋白(ZO-1)、黏蛋白MUC2和三叶因子3(Tff3)对于促进肠道稳态与黏膜修复至关重要[18]。我们的研究在基因转录水平证明了给予辣椒素干预后可促进肠屏障上调,与曹等人[19]的研究结果一致。
辣椒素作为辣椒的活性代谢产物,可通过口服进入胃肠道,因此,研究其在胃肠道中的作用,特别是对IBD的影响,有很大的临床意义。先前的研究报道辣椒素可恶化[20]、缓解[21]、或不影响UC[22]的严重程度,尚存在争议。研究报道[23-24],辣椒素可增加肠黏膜血液灌注或增强造血干细胞动员来预防和治疗溃疡性结肠炎的。本实验通过构建急性肠炎小鼠,通过灌胃的干预方式模拟辣椒素在人体内的作用途径,结果表明辣椒素在一定的剂量范围内成浓度依赖性改善的体重下降、DAI评分、炎症因子及黏膜屏障水平等指标,但对病理改善不太显著。本研究中选用的剂量中20 mg/kg效果最为显著,而有研究报道[25],辣椒素剂量浓度过大,会对胃肠黏膜造成损害,最佳剂量需要进一步探索。
肠道菌群紊乱是IBD发病的重要机制之一[26]。本研究通过16SrDNA测序分析发现,辣椒素干预后可以增加肠道菌群多样性,调整DSS小鼠肠道菌群结构,其中产丁酸盐的理研菌科、毛螺菌属、罗姆布茨菌属的相对丰度上调; 并且,辣椒素干预组中升高的木犀菌科、毛螺菌科、理研菌科、拟杆菌科中的均存在利用黏蛋白单糖的成员,其可与肠道致病菌占据同样生态位(利用黏蛋白单糖)的共生菌去挤占致病菌的生存空间,是潜在的微生态治疗策略。Nature Communications[27]发表的一项研究报道了一种方法,在小鼠中鉴定出能利用黏蛋白单糖的多种共生菌,并从中挑选构建了混合菌株群落,能有效抑制艰难梭菌的生长和定植。我们推测辣椒素干预后调整肠道菌群改善肠炎可能与此机制有关。
综上所述,辣椒素可缓解DSS诱导的小鼠结肠炎症,改变肠道菌群结构,为以后临床和基础研究探索辣椒素对IBD患者的影响提供参考依据。但本研究尚存在以下不足:①本实验研究对象为雄性小鼠,而有文献报道雌雄小鼠肠道菌群组成存在差异,可能与性别敏感性有关[28];
②本实验构建的为急性肠炎模型,辣椒素干预时间较短,而长期慢性模型更能模拟饮食对IBD的影响。本研究辣椒治疗IBD提供了一定依据,但辣椒素的具体作用机制仍需大量的探索。