胰高血糖素样肽-1调节Th细胞分化对屋尘螨诱导小鼠过敏性气道炎症的影响
来源:优秀文章 发布时间:2023-01-27 点击:
马东霞,黄南,李文静,杨雅琪,蒋晴,陈浩,张书辰,汪茵,杨林,祝戎飞
近年来气道过敏性疾病患病率在全球范围内呈上升趋势,过敏性哮喘是气道过敏性疾病的重要组成部分,是儿童支气管哮喘的主要组成部分,同时占成人支气管哮喘的50%,在导致过敏性哮喘的过敏原中,屋尘螨(house dust mite,HDM)是主要的过敏原,其分布广泛,并且难以避免[1]。过敏性哮喘是一种异质性炎症性肺病,是机体对过敏原产生的以 Th2 细胞异常免疫应答为主的气道可逆性气流受限的一种气道慢性炎症。特异性变应原Th2细胞的激活及其分泌的IL- 4、 IL- 5 与IL-13等在维持过敏原特异性IgE水平、嗜酸性粒细胞增多、组织炎症和损伤等方面发挥关键作用,从而导致严重的临床表现和慢性炎症[2- 3]。而Th1 细胞分化不足,进而分泌的IFN-γ、IL- 2等因子减少,抑制Th2分化的作用减弱,进而促进T细胞向Th2细胞方向分化,IL- 4、IL- 5等Th2 型细胞因子分泌增多,进一步加重Th1/Th2细胞失衡,促进过敏性哮喘的进展[1]。
胰高血糖素样肽-1 (glucagon like peptide-1,GLP-1) 是由小肠 L 细胞分泌的葡萄糖依赖性的肠降血糖多肽激素,常用于糖尿病治疗[4- 5]。近年来研究发现 GLP-1 类似物利拉鲁肽可以降低由卵清蛋白与脂多糖(lipopolysaccharide,LPS) 诱导的阻塞性肺疾病的发病率及死亡率,改善肥胖相关性哮喘;
GLP-1 类似物Exendin- 4 (Ex- 4) 改善高糖诱导的离体人细支气管气道高反应性[6- 8]。由此,推测GLP-1对HDM诱导的过敏性气道炎症有抑制作用。
为验证以上假设,本研究选用引起过敏性哮喘最常见的过敏原HDM,构建小鼠过敏性哮喘模型,应用临床常用的GLP-1类似物利拉鲁肽干预小鼠,探讨GLP-1对小鼠过敏性哮喘的影响,并分析其对Th1、Th2细胞炎性因子分泌的作用,进一步明确 GLP-1 在过敏性哮喘生物学功能中的作用。
1.1 实验材料
1.1.1 实验动物:健康雄性C57/BL6(H- 2b)小鼠,体重20~23 g,6~8周龄,24只,购于北京维通利华生物科技股份有限公司,饲养于华中科技大学同济医学院附属同济医院科研中心。
1.1.2 实验试剂及主要仪器:HDM提取物购自北京博蕾德科技发展有限公司;
FACS相关实验试剂和抗体CD4-Bv510、CD8-APC、IFN-γ-FITC、IL- 4-PE,购自BD Pharmingen;
IL- 4、IL- 5、IL-13 ELISA试剂盒购自联科生物;
刘氏染液购于Baso Diagnostics INC.Zhuhai;
Fixation Buffer和 Intracellular Staining Perm Wash Buffer及Cell Stimulation Cocktail (plus protein transport inhibitors) 购于Thermo Fisher Scientific 公司。流式细胞仪购于BD FACSCelesta公司,酶标仪购于 BioTek公司。
1.2 实验方法
1.2.1 小鼠过敏性哮喘模型的建立:将24只SPF级C57/BL6 小鼠随机分为Con组、GLP-1组、屋尘螨(HDM)组、屋尘螨+GLP-1(HDM+GLP-1)组。HDM组,给予 HDM 鼻腔滴注,即从第 1 天(d1)至第 3 天(d3)通过鼻腔滴注连续给予 50 μg/50 μL的无菌HDM,然后从第 14 天(d14)到第17 天(d17)通过鼻腔滴注连续给予 5 μg/50 μL的无菌HDM 建立小鼠 HDM 过敏性气道炎症模型;
并皮下注射200 μL生理盐水,注射时间同HDM+GLP-1组。HDM+GLP-1组小鼠从d3开始皮下注射GLP-1类似物利拉鲁肽(0.2 mg/kg,利拉鲁肽Novo Nordisk,Novo Alle,Bagsvaerd,Denmark,溶于200 μL生理盐水中,q12h,利拉鲁肽在小鼠中所用剂量及干预方式借鉴文献[9-10]报道),HDM鼻腔滴注方案同HDM组。GLP-1组小鼠皮下注射利拉鲁肽,并给予50 μL生理盐水鼻腔滴注,方案同HDM+GLP-1组。Con给予50 μL生理盐水鼻腔滴注,200 μL生理盐水皮下注射,处理时间同HDM+GLP-1组。各组小鼠均于最后1次鼻腔滴注后24 h处死取标本。
1.2.2 小鼠肺脏组织病理学观察:上述各组小鼠取小鼠右肺组织,PBS清洗后,置于4%多聚甲醛中固定24 h,常规石蜡包埋切片,行HE染色,显微镜下观察肺组织病理学变化。
1.2.3 支气管肺泡灌洗液炎症细胞检测:以1%戊巴比妥钠溶液腹腔注射,麻醉小鼠,小鼠仰卧位固定解剖板上,剪开颈部皮肤暴露气管,将注射器7号针头针尖去除,并磨平,在气管上部插入并缝合线固定,1 mL注射器灌注3次,每次灌注0.7 mL预冷的PBS。将收集的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)混合均匀,取 20 μL BALF 用细胞计数仪计数,另取80 μL BALF甩片,进行刘氏染色。计数中性粒细胞数、巨噬细胞数、嗜酸性粒细胞数和淋巴细胞数。剩余BALF于4 ℃,450 g离心10 min。上清分装后保存于-80 ℃冰箱备用。
1.2.4 流式细胞术检测小鼠支气管肺门淋巴结Th1/Th2水平:在显微镜下摘取小鼠支气管肺门淋巴结,置于含有1%青霉素链霉素的PBS中,冲洗两次后,在无菌操作台,移于200目无菌滤网上,浸于1%青霉素链霉素的PBS,无菌眼科剪刀剪碎组织,1 mL注射器活塞橡胶端研磨,收集研磨液,300 g离心7 min。弃上清,重悬于RPMI1640完全培养液中,调整细胞浓度1×106/mL,加入1×Cell Stimulation Cocktail,37 ℃,5% CO2培养箱中培养8 h。
将上述细胞收集在相应流式管内,加入3 mL PBS轻轻吹打均匀,300 g离心7 min,加入100 μL 含有 CD4 与CD8的PBS,避光,4 ℃ 孵育30 min,加入4 mL PBS离心,弃去上清液。加入2 mL fixation Buffer,4 ℃孵育45 min,离心后弃除上清,加入100 μL含有IFN-γ、IL- 4、IL-17抗体的1× Intracellular Staining Perm Wash Buffer,4 ℃孵育30 min,加入4 mL 1× Intracellular Staining Perm Wash Buffer离心,弃去上清液,然后加入200 μL 1× Intracellular Staining Perm Wash Buffer重悬细胞,流式检测。
1.2.5 ELISA检测小鼠支气管肺泡灌洗液炎症因子浓度:取适量上述BALF上清,按照ELISA试剂盒说明书操作,检测IL- 4、IL- 5、IL-13炎性因子水平。
1.3 统计学分析

2.1 小鼠肺脏组织病理学变化
小鼠肺组织HE染色结果显示,HDM 组小鼠肺组织切片小支气管及血管周围均见明显的炎性细胞浸润,支气管上皮细胞可见部分断裂及脱落;
GLP-1干预后组炎症反应明显减轻;
Con组及GLP-1组小鼠肺组织切片未见显著病理性改变,支气管结构规则且完整,较HDM组及HDM+GLP-1组病理损伤明显减轻(图1)。
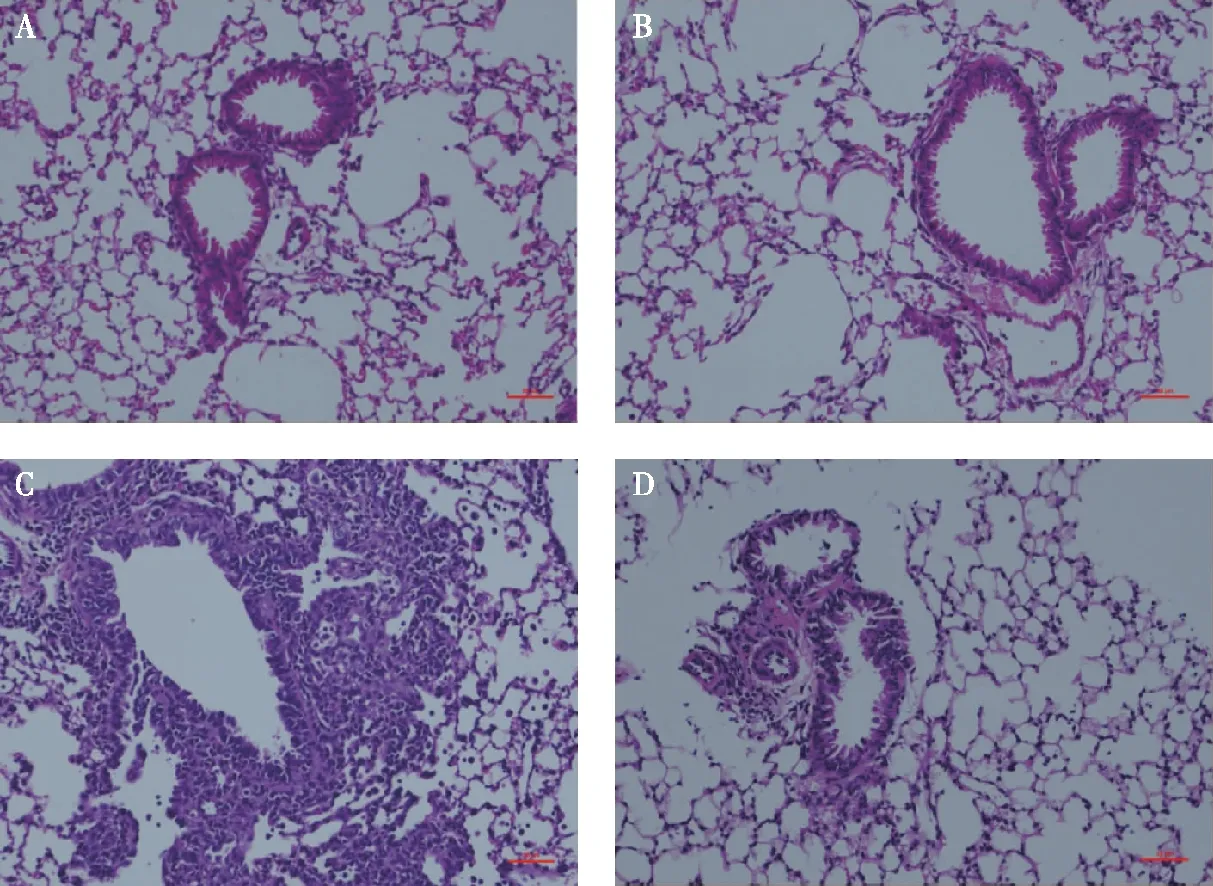
图1 GLP-1抑制HDM诱导的小鼠过敏性哮喘气道炎症
2.2 支气管肺泡灌洗液炎症细胞水平
HDM组小鼠BALF中巨噬细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞较Con组及GLP-1组显著增加;
HDM+GLP-1组较HDM组嗜酸性粒细胞及巨噬细胞均显著减少(P<0.01及P<0.05),中性粒细胞及淋巴细胞也有一定减少,但无统计学意义(图2)。

图2 GLP-1对HDM诱导小鼠过敏性哮喘BALF中炎症细胞数的影响
2.3 流式细胞术检测小鼠支气管肺门淋巴结中Th1/Th2水平
显微镜下可见HDM组小鼠支气管肺门淋巴结明显增大,而Con组及GLP-1组小鼠,支气管肺门淋巴结未见明显增大。图3流式细胞术检测显示,HDM+GLP-1组小鼠支气管肺门淋巴结中CD4+IL- 4+较HDM组小鼠比例显著降低(P<0.05),同时CD4+IFN-γ+细胞比例较HDM组小鼠明显增多(P<0.01),差异具有统计学意义。同时发现两组小鼠支气管肺门淋巴结中CD8+IFN-γ+比例与CD4+IFN-γ+细胞变化一致,HDM+GLP-1组显著升高(P<0.01);
GLP-1干预的哮喘模型组CD8+IL- 4+较HDM组有下降趋势。
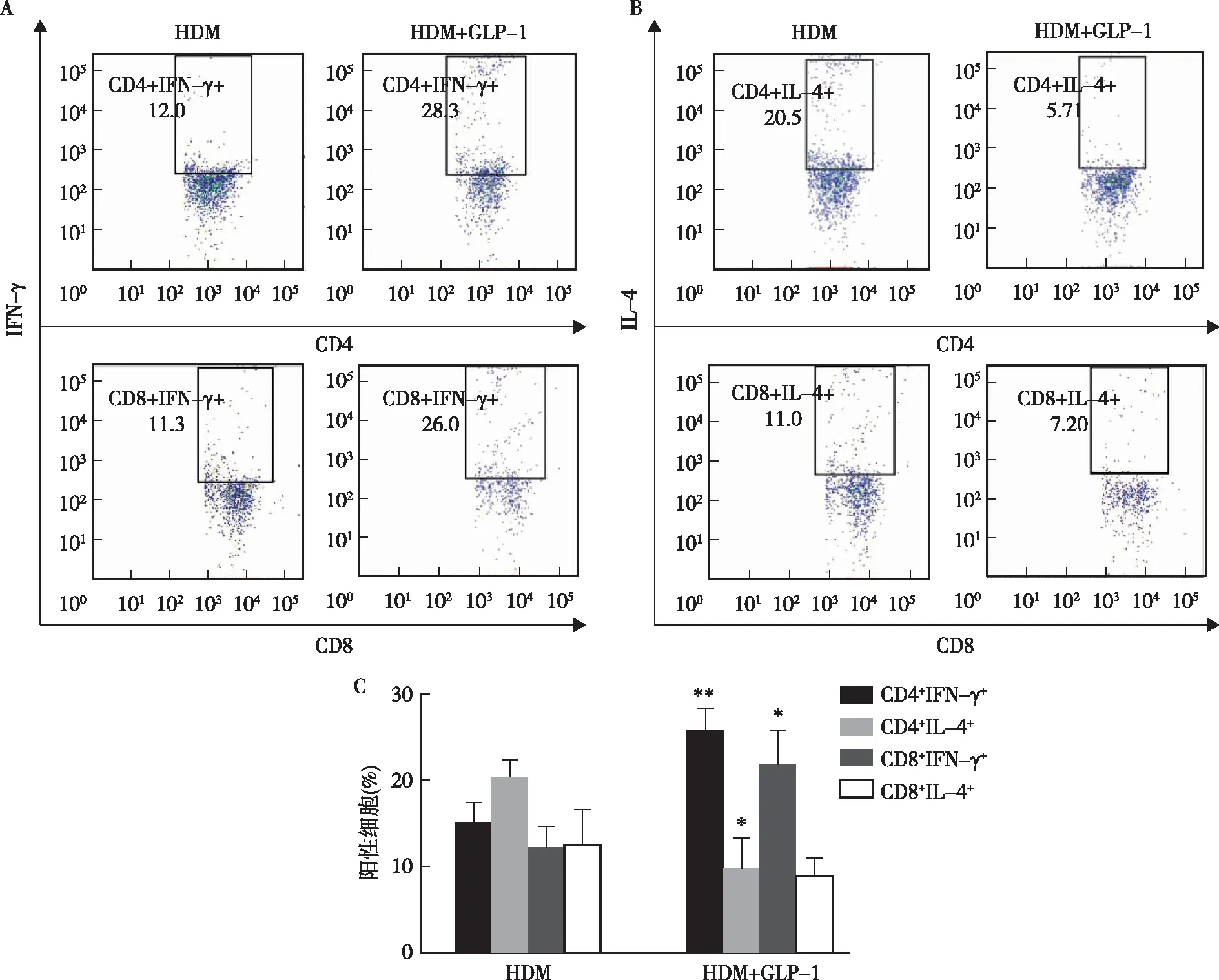
图3 GLP-1对HDM诱导过敏性哮喘小鼠支气管和肺门淋巴结Th1 (CD4/CD8+IFN-γ+)细胞和Th2 (CD4/CD8+IL- 4+)细胞分化的影响
2.4 小鼠支气管肺泡灌洗液炎症因子浓度
用ELISA检测小鼠BALF中Th2型炎症因子IL- 4、IL- 5、IL-13水平,结果显示HDM+GLP-1组小鼠BALF中IL- 4、IL- 5、IL-13水平较HDM组显著降低(分别P<0.01,P<0.05,P<0.01)(图4)。

图4 GLP-1对HDM诱导过敏性哮喘小鼠Th2型炎症细胞因子水平的影响
支气管哮喘作为一种常见的气道慢性炎症性疾病,近年来被认为是一种综合诊断,包括多种不同的临床表现(表型)和不同的病理生理机制(内生型)[4,6]。过敏性哮喘是最常见的哮喘表型,具有发病早、对变应原敏感、与IgE相关,由Th2细胞介导的一种疾病亚型[7,9]。免疫反应的启动,通常始于变应原特异性Th2细胞的激活和分化,并由变应原触发。2型免疫细胞分泌的2型细胞因子(IL- 4、IL- 5、IL-13)在过敏性哮喘中有重要作用。而Th1型免疫反应减弱也是过敏性哮喘发生的重要因素,适量的Th1细胞相关因子IFN-γ可以抑制T细胞向Th2细胞分化,因此适当提高Th1型细胞反应可负向调节过敏性哮喘的进展[10]。目前有学者根据过敏性哮喘的具体分子机制将哮喘分为不同的内生型,在此基础上,随着新型生物疗法的发展,传统哮喘治疗无效的患者可以给予抗lgE、抗IL- 5、抗IL- 4/IL-13等新型生物药物控制哮喘症状,改善病情[11-13]。生物分子靶向治疗可较好的控制病情,不过由于费用较高,在临床应用中受到一定限制[12]。
GLP-1是一种代谢激素,由小肠L细分泌,可与广泛分布的受体(GLP-1R)相互作用,触发胰岛素产生、葡萄糖摄取、食欲下降等[14]。GLP-1R在肺中表达丰富,可刺激血管扩张、表面活性剂的产生和支气管扩张。近年来研究发现GLP-1类似物利拉鲁肽可以改善肥胖相关哮喘的病情[15]。GLP-1R激动剂可作为一种临床应用安全,实验室和临床研究均可立即使用的药物。将来通过进一步研究,GLP-1R激动剂或许可作为一种所谓的新型药物,用于治疗哮喘、肥胖和糖尿病合并患者[16]。
本研究应用GLP-1类似物利拉鲁肽干预由屋尘螨诱导的小鼠过敏性哮喘模型,发现GLP-1类似物能够显著抑制小鼠过敏性气道炎症,炎症细胞浸润明显减少。GLP-1干预的小鼠过敏性哮喘模型组BALF中嗜酸性粒细胞及巨噬细胞较HDM组显著减少,嗜酸性粒细胞及2型巨噬细胞在T细胞向Th2细胞分化中有重要作用[17-18]。为进一步研究GLP-1抑制气道过敏性炎症的机制,本研究在显微镜下摘取支气管肺门淋巴结,并用流式细胞术检测其中CD4/CD8+IFN-γ+及CD4/CD8+IL- 4+比例,发现支气管肺门淋巴结中CD4/CD8+IL- 4+细胞比例降低,而CD4/CD8+IFN-γ+细胞比例升高,调整了Th1/Th2细胞平衡。有学者提出过敏性哮喘主要与CD4+Th2细胞有关,而本研究发现在HDM诱导的小鼠过敏性哮喘模型中,CD8+IL- 4+细胞也呈现显著增高,其在过敏性哮喘中可能有重要作用;
同时用GLP-1干预的小鼠哮喘模型组,CD8+IFN-γ+比例较模型组显著升高,CD8+IL- 4+细胞比例有一定的下降。进一步用ELISA检测支气管肺泡灌洗液中炎症因子水平,结果与Th细胞变化一致,GLP-1类似物干预可以降低Th2型炎症因子水平。本研究证实GLP-1在HDM诱导的小鼠过敏性哮喘模型中可以调节T细胞分化,促进Th1/Th2细胞再平衡,但其具体机制有待于进一步研究。
本研究证实GLP-1能抑制HDM所致过敏性气道炎症,其可能通过调节T细胞向Th1/Th2细胞分化再平衡发挥作用,为过敏性哮喘患者提供了新的治疗思路及理论依据,尤其可为糖尿病合并过敏性哮喘患者提供理想的治疗手段。
猜你喜欢 利拉鲁过敏性支气管 利拉鲁肽的器官保护作用及研究进展西南医科大学学报(2022年2期)2022-11-23了解并远离支气管哮喘保健医苑(2022年1期)2022-08-30慢阻肺患者肺功能与HRCT支气管壁厚度的相关性昆明医科大学学报(2022年2期)2022-03-29利拉鲁肽联合二甲双胍治疗2型糖尿病的疗效及对血糖水平的影响中国药学药品知识仓库(2022年1期)2022-03-23利拉鲁肽 降糖又护心保健与生活(2021年17期)2021-09-17万物复苏话过敏性鼻炎中老年保健(2021年2期)2021-08-22过敏性鼻炎的治疗方法中老年保健(2021年3期)2021-08-22支气管哮喘的药物治疗中老年保健(2021年11期)2021-08-22经支气管肺泡灌洗术确诊新型冠状病毒肺炎1例现代临床医学(2021年4期)2021-07-31儿童过敏性紫癜IL-17、HPV-B19检测的临床意义皮肤病与性病(2021年3期)2021-07-30推荐访问:小鼠 炎症 诱导