非生物胁迫下植物体内活性氧和丙酮醛代谢的研究进展
来源:优秀文章 发布时间:2023-01-18 点击:
赵晶晶,詹万龙,周浓*
(1重庆三峡学院生物与食品工程学院/三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 404120;
2重庆三峡职业学院,重庆 404100)
由于全球气候变化,植物遭受非生物胁迫的频率和严重程度不断增加,致使其在生长发育过程中不可避免地暴露于一种或多种非生物胁迫下,如干旱、淹水、高温、低温、盐碱胁迫等。当植物处于非生物胁迫时,植物体内会产生大量的有害物质,如活性氮(RNS)、活性氧(ROS)、丙二醛(MDA)或丙酮醛(MG)等,这些有害物质会破坏植物体内细胞膜的
结构,造成细胞生理功能受损,产生脂质过氧化反应,最终使细胞死亡,致使植物的生理代谢、生长发育及产量形成等过程受损。前人关于非生物胁迫下植物体内ROS(Gill and Tuteja,2010;
李格等,2018;
刘聪等,2019)或MG(王月等,2018;
叶芯妤等,2019)的代谢机制研究已十分深入,而关于非生物胁迫对植物体内ROS和MG代谢机制间关系的研究尚未见报道。本文重点总结植物体内ROS和MG的合成代谢过程、分解代谢过程以及两者合成和分解代谢间的关系,阐明不同非生物胁迫(干旱胁迫,温度胁迫,盐、碱和盐碱胁迫及重金属胁迫)条件下植物体内ROS和MG代谢间的调节情况,以期为非生物胁迫下植物体内ROS和MG代谢机制的深入研究提供借鉴。
1.1 非生物胁迫下植物体内ROS的合成代谢过程
ROS是氧化能力很强、性质极为活泼的含氧物的总称,主要包括单线态氧(1O2)、超氧阴离子()、过氧化氢(H2O2)和羟基自由基(·OH)等,是植物有氧代谢产生的有毒副产物(李格等,2018),其产生的部位主要是叶绿体、过氧化物酶体、线粒体和质外体等(Finkel,2011)(图1)。ROS作为植物体内正常的生理代谢产物,具有双重作用,低浓度的ROS可作为信号分子通过诱导细胞内一系列防御和保护基因来保护植物,进而促进植物生长发育(李格等,2018);
而高浓度的ROS对有机体有害,易引发蛋白质氧化、酶失活、核酸损伤和脂质过氧化,激活信号通路并导致细胞程序性死亡(Zhu and Bunn,1999),这种破坏作用可称为氧化胁迫。
研究表明,非生物胁迫下,植物叶绿体类囊体中的光系统I(PSI)和光系统II(PSII)反应中心是ROS产生的主要部位,空气中的O2经过光合作用会产生1O2和·OH引起氧化损伤,且PSI呼吸电子传递链中的电子可与O2反应产生并快速转化为H2O2(Asada,2006)(图1);
此外,植物线粒体细胞器中的O2可接受呼吸电子传递链中的电子形成,再快速歧化为H2O2(Xiong et al.,2007);
再者,复合体I和复合体III中泄漏的电子与O2结合可生成1O2,1O2通过Mn–SOD作用可转化为H2O2(Huang et al.,2016)(图1)。同时,过氧化物酶体也是植物细胞中H2O2的主要来源,这是因为非生物胁迫增强了光呼吸导致乙醇酸氧化酶过度反应造成的,并伴随着一氧化氮(NO)或的产生(Noctor et al.,2007)(图1)。呼吸爆发氧化酶也可称之为NADPH氧化酶(NADPHox),是质外体中ROS形成的关键酶,通常位于细胞质膜上,烟酰胺腺嘌呤二核苷酸磷酸(NADPH)作为电子供体,可接受质膜胞质侧的电子并传递给O2形成在自然歧化或在细胞壁结合的超氧化物歧化酶(SOD)催化下形成H2O2,H2O2再经Haber-Weiss反应或Fenton反应形成·OH(Asada,2006)(图1)。
1.2 非生物胁迫下植物体内MG的合成代谢过程
MG又可称之为2-氧代丙醛、α-氧代醛或甲基乙二醛,是一种小分子高活性的二羰基复合物,作为植物体内正常的生理代谢产物,可由碳水化合物、蛋白质及脂质代谢产生,主要来源于糖酵解途径,正常生理情况下MG在植物体内合成量极低,一般维持在30~75μmol/L范围内(Yadav et al.,2005)。MG在植物体内具有双重作用,低浓度的MG可作为信号分子参与种子的萌发、植物的生长发育及植物胁迫耐性的获得(Li,2016);
而高浓度的MG则是一种细胞毒素,具有高度的细胞毒性和活性,可导致DNA、RNA和蛋白质等生物大分子被破坏,类似于ROS引发的氧化胁迫,这种破坏作用可称之为羰基胁迫或MG胁迫(王月等,2018;
叶芯妤等,2019)。
MG作为植物体内正常的代谢产物,其合成过程广泛存在于叶绿体、线粒体和胞质溶胶等组织或细胞中,其产生的位点和具体比率取决于组织或细胞类型及整个植株的生理状态(Kaur et al.,2014)。植物体内的MG合成来源于多条代谢途径(图2),其中,糖酵解是MG合成的最主要途径,糖酵解或光合作用产生的磷酸二羟丙酮(DHAP)或甘油醛-3-磷酸(GAP)可自发脱去无机磷产生MG(Hossain et al.,2018);
再者,在葡萄糖氧化过程中,约有0.05%~0.30%的葡萄糖会转化为MG(Li,2016),上述是植物体内MG合成的非酶促途径。
植物体内MG合成除了非酶促途径外,还有酶促途径(图2),参与的酶主要包括磷酸丙糖异构酶(TPI)、丙酮醛合酶(MGS)、氨基脲敏感型胺氧化酶(SSAO)和丙酮醇单加氧酶(AMO),这4种酶在植物体内构成4种酶促途径:(1)GAP途径,TPI催化DHAP或GAP水解去磷酸化后形成MG,故TPI是植物体内MG形成的关键调节酶,其活性与MG的积累呈负相关(Li,2016);
(2)丙酮醇途径,丙酮单加氧酶将脂肪酸的代谢物丙酮催化为丙酮醇,后者被AMO转化为MG;
(3)氨基丙酮途径,在该途径中,来自蛋白质代谢或氨基酸代谢的氨基丙酮在SSAO催化作用下可合成MG;
(4)DHAP途径,MGS以糖酵解或光合作用产生的DHAP为底物,催化DHAP转化为MG。
1.3 非生物胁迫下植物体内ROS和MG合成代谢间的关系
非生物胁迫导致植物体内ROS和MG含量迅速升高已是不争的事实(Gill and Tuteja,2010;
李格等,2018;
王月等,2018;
刘聪等,2019;
叶芯妤等,2019)。那么非生物胁迫下,植物体内ROS与MG之间又有怎样的关系呢?大量研究证明,MG能使细胞内ROS含量升高,这是因为MG在糖基化反应过程中可生成和H2O2,并且产生的终产物—晚期糖基化终产物(AGEs)会破坏植物体内的抗氧化防御系统,降低或灭活SOD、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、谷胱甘肽S-转移酶(GST)、谷胱甘肽过氧化物酶(GPX)等抗氧化酶活性,植物细胞内AGEs的积累间接促进了ROS含量的增加(Kaur et al.,2014);
另一方面,在非生物胁迫下,为了维持植物体内MG含量在安全范围内,细胞内的还原型谷胱甘肽(GSH)含量会减少,间接影响抗坏血酸—谷胱甘肽(AsA–GSH)循环的运转,导致ROS产量增加(Meata et al.,2005);
再者,MG的醛基可与蛋白质的氨基酸残基—赖氨酸、半胱氨酸和精氨酸反应生成AGEs,从而使蛋白质结构降解和/或功能失活,对植物体造成无法修复的代谢功能障碍和细胞死亡(Ferguson et al.,1998);
此外,MG还能与膜脂反应形成不可逆的晚期脂质过氧化终产物(ALEs)(叶芯妤等,2019),导致被氧化的膜脂在结构和功能上发生改变。Saito等(2011)认为MG在植物体内可作为希尔氧化剂,催化PSI中的O2成为,而的形成会加快细胞成分的氧化损伤。
Hoque等(2010,2012)通过外源施用MG鉴定了植物体内MG和ROS之间的关系,0.5~10.0 mmol/L的MG喷施于烟草植株上会降低植株体内APX和GST的活性,致使植株发生氧化应激反应;
外源喷施MG可诱导叶绿体中的光合作用产生,从而抑制植物的光合作用(Saito et al.,2011)。MG不仅对植物体内的生物大分子具有破坏作用,还能诱发ROS的产生,继而对植物体内的生物大分子再次造成氧化损伤。
2.1 非生物胁迫下植物体内ROS的分解代谢
正常条件下,植物体内ROS的产生与清除处于动态平衡,而非生物胁迫因素会破坏细胞中ROS产生与清除之间的动态平衡,导致ROS在植物体内积累造成氧化胁迫,进而抑制植物的生长和发育(Gill and Tuteja,2010;
李格等,2018;
刘聪等,2019)。植物为了适应非生物胁迫环境,形成了非酶促和酶促2种有效的ROS清除机制来缓解体内ROS的过度积累,非酶促抗氧化系统主要包括GSH、抗坏血酸(AsA)、维生素E(VE)、维生素C(VC)、类胡萝卜素(Car)等,酶促抗氧化系统主要包括CAT、SOD、过氧化物酶(POD)、APX、单脱氢抗坏血酸还原酶(MDHAR)和脱氢抗坏血酸还原酶(DHAR)等(李格等,2018;
刘聪等,2019)。
非生物胁迫下,植物体内的VC作为非酶促抗氧化系统的一员,会在植物体内大量积累,一方面以还原剂的形式直接与ROS反应后清除ROS,另一方面可作为酶的底物在ROS清除中起重要作用(郭明欣等,2021)。而谷胱甘肽主要以GSH和氧化型谷胱甘肽(GSSG)2种形式存在,其中有活性的GSH约占90%,GSH以H2O2还原的再循环中间物形式存在,H2O2接受以GSH为中介的NADPH电子还原成H2O,从而清除H2O2(Lu,2000;
汪宽鸿等,2021)。此外,AsA可直接与1O2、和H2O2等ROS反应,清除猝灭1O2、·OH及歧化H2O2,如APX以AsA为底物,催化H2O2分解成无毒的H2O和O2,AsA氧化时形成单脱氢抗坏血酸(MDHA),MDHA进一步氧化形成脱氢抗坏血酸(DHA)。
2.2 非生物胁迫下植物体内MG的分解代谢
MG作为光合作用、糖酵解、葡萄糖氧化、蛋白质糖基化和脂质过氧化的副产物,是生命系统中自发的、不可避免的结果(王月等,2018)。由于MG的双重作用,在正常生理条件下,植物体内的MG含量维持在较低的无毒生理水平,但当植物处于非生物胁迫时,植物体内的MG含量会迅速增加2~6倍(Yadav et al.,2005),成为植物对非生物胁迫的响应信号。为了维持体内MG的动态平衡,植物进化出乙二醛酶系统和非乙二醛酶系统2种脱毒机制,其中,乙二醛酶系统承担了植物体内99%的MG脱毒作用(王月等,2018;
Mostofa et al.,2018)。
乙二醛酶系统也可称之为MG脱毒系统,包括乙二醛酶I(Gly I)、乙二醛酶II(Gly II)、乙二醛酶III(Gly III)和GSH(图3),共同构成2条分解代谢途径。(1)依赖于GSH的乙二醛酶途径:Gly I以GSH为辅因子,将MG和GSH自发形成的半硫代缩醛(HTA)转化为S-D-乳酰谷胱甘肽(SLG),SLG再经Gly II水解后形成D-乳酸,同时再生GSH,这是植物体内MG降解的主要途径,Gly I活性会直接影响MG的浓度,是MG分解过程中的关键酶(Rabbani and Thornalley,2012;
Li,2016)。(2)不依赖GSH的乙二醛酶途径:与Gly I和Gly II不同的是,植物体内的Gly III可直接将MG转变为D-乳酸,不需要GSH参与,这为植物体内MG的降解提供了更短的途径(Ghosh et al.,2016)。乙二醛酶系统不仅可清除植物体内过量的MG,还可通过调节GSH的再生来维持细胞的氧化还原平衡,这在植物感受、响应和适应非生物胁迫中发挥了重要作用。
非乙二醛酶系统主要包括醛糖/醛还原酶(ALR)、MG还原酶/脱氢酶(MGR/MGDH)和醛酮还原酶(AKR)3种酶,在正常生理条件下,非乙二醛酶系统仅可清除1%的MG,只有乙二醛酶系统受阻,该系统才发挥重要作用(Li,2016)。非乙二醛酶系统共包括3条途径:(1)ALR催化MG形成丙酮酸;
(2)MGR或MGDH以还原型烟酰胺腺嘌呤二核苷酸(NADH)为辅助因子,可直接将MG还原成乳醛;
(3)AKR以NADPH为辅助因子,可直接将MG还原成相 应的醇(Simpson et al.,2009;
Yamauchi et al.,2010)。无论是乙二醛酶系统,还是非乙二醛酶系统,在降解MG过程中产生的丙酮酸最后均可进入三羧酸循环,进一步调节植物体内的氧化还原平衡和能量代谢。
2.3 非生物胁迫下植物体内ROS和MG分解代谢间的关系
由于ROS和MG具有双重作用,故其在植物体内的浓度受严格调控,这种调控主要靠其合成代谢和分解代谢来实现。抗氧化防御系统是植物体内清除ROS的主要途径,乙二醛酶系统是植物体内清除MG的主要途径,植物体内这2条途径的唯一交叉点是GSH(图3)。谷胱甘肽是广泛存在于植物体内的生物活性非蛋白硫醇化合物,其在细胞中的含量一般维持在0.5~10.0 mmol/L,其结构含有游离的巯基,具有较强的供电子或质子氢的能力,可作为抗氧化酶的辅因子和水相的抗氧化剂(王玮玮等,2014)。GSH在植物对逆境胁迫的抵抗上具有重要作用,如ROS清除过程中,H2O2等ROS可被GSH还原,经GR催化GSH被氧化为GSSG,为ROS的清除提供还原力,还可维持细胞内GSH/GSSG比率(Carmel-Harel and Storz,2000),从而形成一种氧化还原循环。同时,GSH还可作为辅因子参与植物体内MG的清除,Gly I和Gly II共同作用可将MG转化为D-乳酸,同时伴随着GSH的再生,可见,乙二醛酶系统不仅清除了过量的MG以保持其稳态,还可调节GSH的再生及维持细胞中的氧化还原平衡(叶芯妤等,2019),乙二醛酶系统再生的GSH可进入AsA–GSH循环系统,在GR、DHAR、APX等一系列的AsA–GSH循环酶协同作用下清除过量的H2O2,维持细胞的氧化还原平衡(叶芯妤等,2019)。
植物在生长过程中进化出了多种方式来应对非生物胁迫,其中GSH和GSSG组成的GSH/GSSG途径在植物的信号传导和耐逆中发挥重要作用,GSH/GSSG作为植物细胞中最丰富的氧化还原对之一,不仅是信号传递中的氧化形式和还原形式的电子载体,还可维持细胞内的氧化还原状态(汪宽鸿等,2021)。故植物细胞通过抗氧化系统和乙二醛酶系统的协同作用,在保持MG和ROS稳态的同时,还可调控细胞内GSH/GSSG、AsA/DHA、NADPH/NADP+及NADH/NAD+比值,维持植物细胞的能量代谢、氧化还原平衡和细胞代谢稳态,这也可能是抗氧化系统和/或乙二醛酶系统提高植物耐逆性的主要原因之一(叶芯妤等,2019)。
3.1 干旱胁迫
在全球气候变暖背景下,干旱胁迫已成为全球范围内的重大气候问题之一,具有发生频率高、影响范围广、后续影响大及持续时间长等特点,并呈常态化发展趋势。干旱胁迫造成的经济损失占各类自然灾害总损失之首(樊利华等,2019)。当干旱胁迫发生时,植物叶片气孔关闭限制CO2的摄取,导致光呼吸过程中的电子传递受阻,光能利用失衡、光合速率降低及叶绿体光化学发生改变,在PSII反应中心附近的O2可能产生1O2。此外,在QA和QB转移电子过程中,O2可通过Mehler反应在PSI或PSII处形成,随后被CuZn–SOD和Mn–SOD催化成H2O2(Noctor et al.,2014),因此,干旱胁迫可诱导氧化胁迫、MG胁迫和渗透胁迫,而抗氧化系统和乙二醛酶系统活力的增强及渗透调节物质的积累是植物耐旱的重要策略(周志豪等,2017)。表1列举了不同植物对干旱胁迫的响应情况,如Nahar等(2015a,2017)以绿豆幼苗为试验材料,发现干旱胁迫会破坏植物体内的ROS和MG代谢平衡,使细胞内H2O2、、MDA和MG含量增加,脂质过氧化程度加重,造成氧化胁迫和MG胁迫,而外源施用精胺和GSH可提高干旱胁迫过程中的AsA和GSH含量及提高SOD、CAT、APX、GR、GPX、GST、MDHAR和DHAR活性,减少细胞内H2O2、和MDA的积累,减弱脂质过氧化程度,降低内源MG含量,促进Gly I和Gly II活性升高,从而提高绿豆幼苗的耐旱性。前人以油菜幼苗为材料,经干旱胁迫处理后,发现油菜叶片内的MDA和H2O2含量急剧增加,GSSG含量显著升高,CAT、MDHAR和Gly II活性降低,GST活性升高;
外源喷施茉莉酸可显著提高叶片内GPX、GR和DHAR活性以及Gly I和Gly II 2种乙二醛酶活性(Alam et al.,2014);
而二氧化硅处理可通过提高干旱胁迫下幼苗中的抗氧化剂(GSH和AsA)含量和AsA—GSH循环酶(APX、GR、GST、DHAR和MDHARH)活性,减少H2O2和MDA的积累,同时增加乙二醛酶系统中Gly I和Gly II活性(Hasanuzzaman et al.,2018a);
Hasanuzzaman和Fujita(2011)通过外源施用硒酸钠也可对抗氧化防御系统和乙二醛酶系统起到一定的调控作用,继而增强油菜幼苗的耐旱性。Hossain等(2013)在芥菜上、Hasanuzzaman等(2018b)在小麦上、Ghosh和Islam(2016)在大豆上均得到相似研究结果,说明抗氧化系统和乙二醛酶系统在化学引发诱导的植物耐逆性方面起重要作用。前人对于ROS和MG代谢机制的研究多集中于叶片,而根系作为感受干旱胁迫的原初部位具有比地上部(叶片)更敏感的反馈机制,故今后科研工作者可开展干旱胁迫下植物根系内ROS和MG代谢机制的研究。

表1 干旱胁迫下植物体内乙二醛酶系统和相关抗氧化防御系统的调节Table 1 Regulation of the glyoxalase system and associated antioxidant defense system in plants under drought stress
3.2 温度胁迫
植物生长发育的最低温度、最适温度和最高温度统称为“温度三基点”,环境温度低于植物最低温度或高于最高温度均会对植物生长发育产生有害效应,称为低温胁迫或高温胁迫。极端温度常会引起植物一系列生理生化水平的变化,植物遭遇低温胁迫后会出现水分状况、光合作用、矿质营养、新陈代谢和呼吸作用等生理过程的紊乱,光合系统中的过剩激发能量会导致光氧化和光抑制发生,叶绿体膜脂质过氧化作用增强,胡萝卜素、叶绿素和叶黄素发生降解(Wang et al.,2008)。而高温胁迫也会影响到植物的光合系统,主要表现在PSII的光化学效率降低,电子传递被抑制造成大量光能剩余,从而形成大量的活性自由基,导致细胞膜透性发生改变,膜脂过氧化,对植物造成伤害(Allakhverdiev et al.,2008)。极端温度胁迫除了会造成氧化胁迫外,还会同时诱发MG的超积累,产生MG胁迫(Hasanuzzaman et al.,2013)。
植物通过ROS和MG脱毒系统活力的增强提高了植物抵抗极端温度胁迫的耐性(表2),如低温胁迫可增强茶芽中的脂质过氧化和提高MG含量,而外源施用脯氨酸和甜菜碱可降低Gly I和Gly II活性,从而减少细胞内MG含量,提高其对低温的耐性(Kumar and Yadav,2009)。绿豆幼苗经6℃处理2和3 d后,叶片细胞内的DHAR、MDHAR、CAT和Gly II活性降低,导致酶促抗氧化防御系统和乙二醛酶系统遭到破坏,发生氧化胁迫和MG胁迫,而外源喷施亚精 胺 可 促 进AsA和GSH含 量 增 加 及APX、GR、DHAR、MDHAR、CAT和GPX抗氧化酶活性升高,加快ROS的清除,减弱脂质过氧化程度;
同时Gly I和Gly II活性升高显著减少了细胞内的MG含量(Nahar et al.,2015d)。Goulas等(2006)以拟南芥、Chen等(2013)以洋葱、Lee等(2009)以水稻为试验材料,采用蛋白组学手段进一步证实了MG脱毒系统与植物耐冷性的形成有关。榕树幼苗经35和40℃胁迫处理48 h后,叶片内的ROS和MG代谢平衡被打破,而外源施用表油菜素内酯可有效维持榕树叶片细胞的稳定性,减轻氧化胁迫和MG胁迫对叶片造成的损伤(Jin et al.,2016)。高温胁迫下,绿豆幼苗经外源GSH处理后,细胞内的CAT、APX、GR、GST、DHAR、GPX、MDHAR、Gly I和Gly II活性显著升高,从而提高幼苗对高温胁迫的抵抗能力(Nahar et al.,2015b);
同样,精胺在提高绿豆耐高温胁迫方面具有相同的研究结果(Nahar et al.,2017)。Hasanuzzaman等(2012b)在小麦、Mostofa等(2014)在水稻方面也进行了高温胁迫研究,并通过外源施用硝普钠、亚精胺来提高小麦和水稻的耐热性。同样,低温和高温胁迫可刺激水稻幼苗中的Gly I和Gly II基因表达,提高Gly I和Gly II活性,继而提高幼苗的耐冷性和耐热性(Yadav et al.,2005)。

表2 温度胁迫下植物体内乙二醛酶系统和相关抗氧化防御系统的调节Table 2 Regulation of the glyoxalase system and associated antioxidant defense system in plants under tmeperature stress
3.3 盐、碱或盐碱胁迫
根据土壤的电导率(EC)、碱化度(ESP)和pH可将盐碱土壤分为3种类型:盐土、碱土(苏打土)和盐碱土,一般认为,土壤的EC>4、pH<8.5、ESP<15.0是中性盐土壤,主要成分是NaCl和Na2SO4,有时还含有相当数量的Ca2+和Mg2+,由中性盐土壤对植物造成的伤害称之为盐胁迫。表3列举了部分盐胁迫对植物造成的损伤情况,如绿豆幼苗外源施用脯氨酸、甜菜碱、腐胺、亚精胺和精胺独立或组合处理,均可不同程度地激活抗氧化酶系统(AsA和GSH含量及GST、GPX和GR活性)和乙二醛酶系统(Gly I和Gly II),从而降低植物氧化胁迫和MG胁迫,提高绿豆幼苗的耐盐性(Hossain and Fujita,2010;
Hasanuzzaman et al.,2011a;
Nahar et al.,2015c)。在油菜(Hossain et al.,2013;
Hasanuzzaman et al.,2014b)、小麦(Hasanuzzaman et al.,2011b)和水稻(El-Shabrawi et al.,2010;
Hasanuzzaman et al.,2014a;
Mostofa et al.,2015a,2015b;
Rahman et al.,2016d)上也得到了相似研究结果。El-Shabrawi等(2010)以不同类型的水稻为试验材料,经转录组学和蛋白质组学研究发现,与盐敏感品种相比,耐盐品种具有较高的Gly I和Gly II活性及较低的内源MG含量。相反地,Gly II突变体的拟南芥幼苗对盐胁迫十分敏感,而Gly II超表达则提高了拟南芥的耐盐性,这也进一步支持了Gly II在耐盐性中的作用(Devanathan et al.,2014)。

表3 盐胁迫下植物体内乙二醛酶系统和相关抗氧化防御系统的调节Table 3 Regulation of the glyoxalase system and associated antioxidant defense system in plants under salt stress
土壤的EC<4、pH>8.5、ESP>15.0是碱性盐土壤,主要成分是Na2CO3和NaHCO3,由碱性盐土壤对植物造成的伤害称之为碱胁迫,碱胁迫破坏了植物细胞中已形成的各种离子的平衡状态,影响K+和Ca2+等离子在细胞内的分布,严重影响世界范围内的作物生长和农业生产力。中性盐和碱性盐同时引起的胁迫称之为盐碱胁迫。在自然界中,土壤的盐化和碱化相伴而生,已有研究表明,盐胁迫包括渗透胁迫和离子毒害,而碱胁迫不仅包括渗透胁迫和离子毒害,还包括pH胁迫,所以碱胁迫对植物的伤害远大于盐胁迫(Wang et al.,2003)。预计到2050年,我国50%以上的耕地均会发生盐碱化,这将严重威胁着粮食产量和土地利用率(Wang et al.,2003)。通常情况下,盐、碱或盐碱胁迫对植物的损伤可概括如下:一是造成渗透反应和水分胁迫,植物可通过根部的激素信号传导途径来调控生物量;
二是产生脱水反应和氧化胁迫,盐离子可大量地储存在细胞质中,造成渗透胁迫形成生理性干旱,进而促进ROS产生,ROS与多种亚油酸和不饱和脂肪酸反应,引起脂质过氧化作用,破坏细胞完整性,影响次生代谢产物(Wang et al.,2003);
三是碱或盐碱胁迫会降低土壤渗透势,使根际土壤pH升高,Mg2+、Ca2+、Fe2+等金属离子沉积,阻碍植物对矿质营养的吸收,造成植物体严重营养胁迫,进而干扰植物体内的各种代谢活动(王佺珍等,2017)。盐、碱或盐碱胁迫作为影响植物种子萌发、植物生长和发育的重要非生物因子之一,可导致植物发生氧化胁迫、MG胁迫、渗透胁迫等,而植物耐盐性的形成常与抗氧化系统和乙二醛酶系统活力的增强及渗透调节物质的积累密切相关(Li,2016)。
3.4 重金属胁迫
土壤和水源中的重金属会对植物造成重金属胁迫或重金属污染,如锌、铬、铜、铅、镍、钴、汞等(梁志乐等,2022)。这是因为重金属进入植物体内会破坏ROS产生和清除之间的平衡,造成细胞内ROS局部积聚,一方面造成膜脂的过氧化作用,使生物膜的完整性遭到破坏;
另一方面氧化应激会抑制光合作用,叶绿体膜系统被严重损伤,使叶片出现光合降低甚至萎蔫死亡的现象。伴随着氧化应激的发生,植物细胞内的MG含量剧增,导致植物再次受到MG胁迫的损伤。
氧化胁迫和MG胁迫是重金属毒害植物的主要原因,植物遭受重金属胁迫后体内会发生DNA损伤、蛋白质氧化、酶失活及脂质过氧化已是不争的事实,这已在绿豆(Hossain et al.,2010;
Nahar et al.,2016a,2016b;
Mostofa et al.,2018)、油菜(Hasanuzzaman et al.,2012a)和 水 稻(Mostofa and Fujita,2013;
Mostofa et al.,2015a;
Rahman et al.,2016a,2016b,2016c)上得到了证明(表4)。化学引发作为提高植物耐逆性的重要手段,在重金属胁迫下,绿豆幼苗分别用脯氨酸、甜菜碱、腐胺、硝普酸钠、精胺或亚精胺处理,均可不同程度地提高幼苗体内的抗氧化系统(CAT、APX、GR、GST、MDHAR、DHAR、AsA和GSH)和乙二醛酶系统(Gly I和Gly II)活力,降低ROS(H2O2和)和MG的积累,提高其对重金属胁迫的抵抗能力(Hossain et al.,2010;
Mostofa et al.,2015a;
Nahar et al.,2016a,2016b;
Mostofa et al.,2018)。在油菜幼苗中,硒酸钠处理可提高镉胁迫下幼苗体内的CAT、APX、GR、GPX、GST、DHAR和MDHAR抗氧化酶活性,减少细胞内MDA和H2O2含量,同时Gly I和Gly II活性升高导致MG含量降低,避免氧化胁迫和MG胁迫发生,继而提高幼苗对镉胁迫的抵抗能力(Hasanuzzaman et al.,2012a)。同样,外源施用水杨酸和海藻糖可有效地保护水稻幼苗免受铜胁迫危害(Mostofa and Fujita,2013;
Mostofa et al.,2015a);
再者,Ca2+处理可降低水稻幼苗对镉和砷的吸收,提高SOD、CAT、GST、DHAR和MDHAR氧化酶及Gly I和Gly II乙二醛酶的活性,从而减少ROS和MG在体内的过量积累,最终提高幼苗的重金属镉胁迫耐性(Rahman et al.,2016a)。Rahman等(2016b)外源施用适量的硫酸锰也得到了相似结果。Li等(2017,2018)通过外源喷施适宜浓度的MG处理小麦幼苗,发现MG处理可提高镉胁迫下幼苗体内的SOD、CAT、POD、APX、GR活性及抗氧化剂(AsA和GSH)含量,缓解镉胁迫下H2O2、、MDA和MG的积累,从而改善小麦幼苗的生长状况,说明适宜浓度的MG可能作为信号分子调控了植物重金属耐性的获得。此外,重金属胁迫和氧化胁迫可诱导水稻幼苗中Gly I和Gly II的基因表达,降低内源MG含量,进而提高水稻的胁迫耐性(Yadav et al.,2005)。
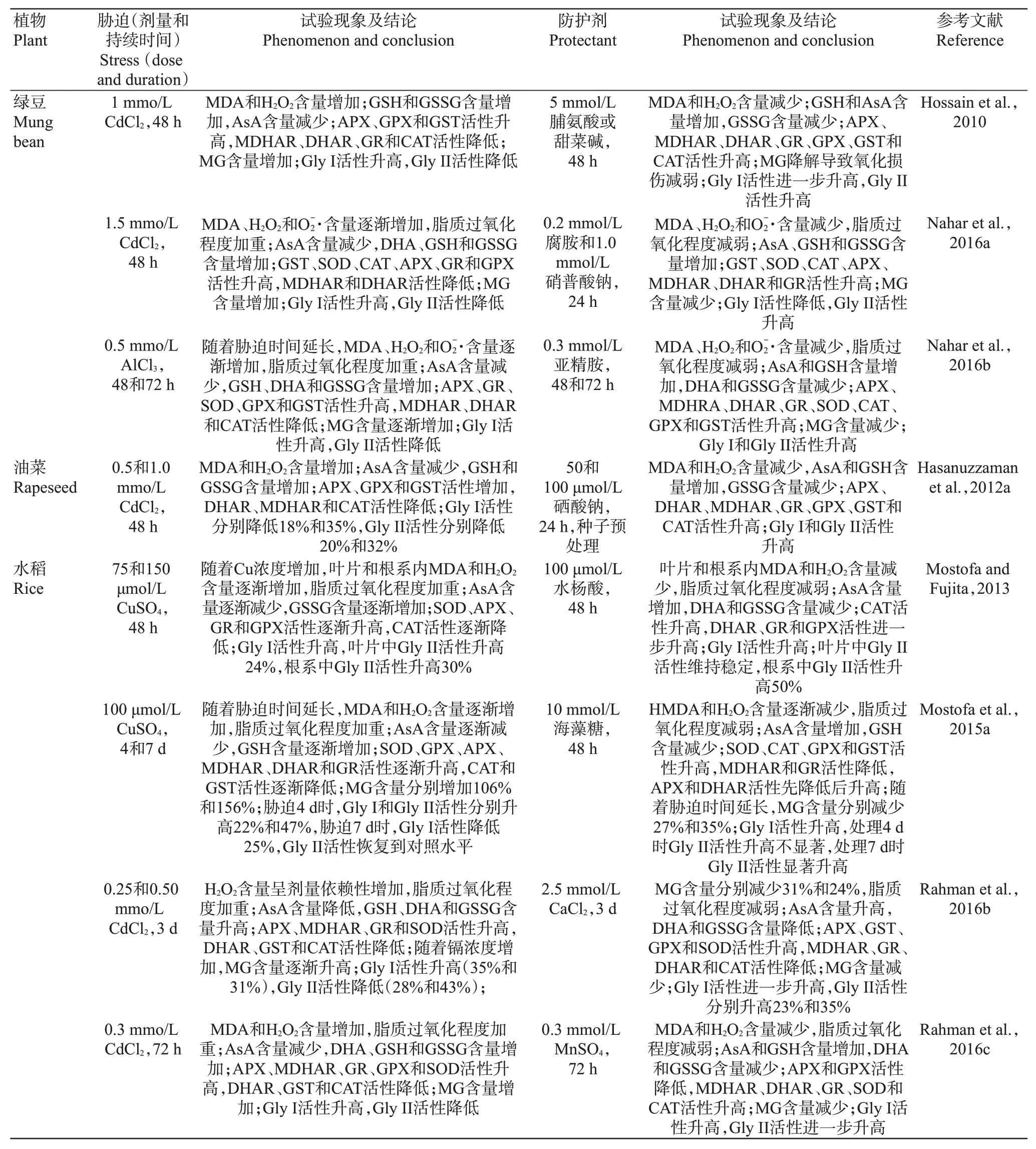
表4 重金属胁迫下植物体内乙二醛酶系统和相关抗氧化防御系统的调节Table 4 Regulation of the glyoxalase system and associated antioxidant defense system in plants under heavy metal stress
非生物胁迫下,植物细胞内会大量积累ROS和MG,导致细胞发生氧化损伤,严重影响植物的分布、生长、发育、品质和产量形成,甚至是植物生存。伴随着生理生化、分子生物学、转录组学和蛋白组学等手段的快速发展,近年来对ROS和MG代谢的研究已揭示了抗氧化防御系统和乙二醛酶系统在植物响应、感受和适应非生物胁迫中发挥的重要作用。有关非生物胁迫下植物体内ROS和MG代谢间的关系、抗氧化系统和乙二醛酶系统调控植物细胞内ROS和MG的稳态及氧化还原平衡的作用,在今后研究植物非生物胁迫耐受性中可从以下方面加强探索。
4.1 植物体内MG的信号作用
MG与NO、H2S、Ca2+、H2O2等信号分子相似,具有双重作用,高浓度的MG会破坏生物大分子物质,导致羰基胁迫(类似于ROS引发的氧化胁迫);
而低浓度的MG作为一种新型信号分子,在调节植物生长发育、种子萌发、繁殖等多种生理过程和耐逆性形成中具有重要作用,尤其是在植物耐逆性形成中与其他信号分子的确切交互作用仍有待探讨。首先应该准确测定亚细胞或细胞中的MG含量,其专一性的活体和离体定量方法,尤其是荧光法急需探索;
其次是MG可引发蛋白质的糖基化,这些糖基化的蛋白质是否是MG的受体还需进一步证实;
再者随着组学的快速发展,利用单组学(转录组学、蛋白质组学或代谢组学)或多组学结合的方法,需进一步阐明MG合成代谢和分解代谢及其诱导的植物耐逆性形成的分子机制。
4.2 乙二醛酶系统响应非生物胁迫的机理
植物为了生存进化出多种行之有效的脱毒机制,其中,抗氧化系统和乙二醛酶系统在植物非生物胁迫方面的研究已有上百年历史,但两者间关系的研究进展一直较缓慢,尤其是抗氧化系统和乙二醛酶系统如何协同作用共同调控植物细胞内ROS和MG稳态及氧化还原平衡,仍需深入研究其机理;
正常生长环境或非生物胁迫环境下,植物如何引发MG信号与NO、H2S、Ca2+、H2O2、植物激素等其他信号进行交互作用,其交互作用过程又如何激活乙二醛酶系统的基因表达和活性,其机理也尚未明确。
4.3 乙二醛酶系统耐逆基因工程的开发
乙二醛酶系统在植物响应和适应非生物胁迫中具有重要作用已是不争的事实,随着科学技术的进步,尤其是组学的发展,如何利用生物信息学手段进一步阐明乙二醛酶系统在植物耐逆胁迫中的新作用,特别是在植物感受、响应和适应非生物胁迫方面尤为突出,由于乙二醛酶系统Gly I、Gly II和Gly III的基因已被定位和克隆,构建过表达载体较容易,在此基础上开展乙二醛酶系统耐逆基因工程也取得较大进展,而过表达乙二醛酶基因的转基因植物具有较高的乙二醛酶活性和抗氧化剂水平,有助于保持细胞内MG的稳态平衡,可有效防止过量的MG积累所诱发的细胞损伤,发挥MG的信号作用,如何获得具有多重耐性的乙二醛酶系统转基因植物,尤其是转基因农作物是目前亟待解决的科学问题。
猜你喜欢 抗氧化幼苗活性 种玉米要用“锌” 幼苗不得花白病今日农业(2021年10期)2021-11-27最优育苗基质配比促番茄幼苗生长今日农业(2021年9期)2021-11-26航天器表面抑菌活性微生物的筛选与鉴定载人航天(2021年5期)2021-11-206000倍抗氧化能力,“完爆”维C!昶科将天然虾青素研发到极致当代水产(2021年6期)2021-08-13跟踪导练(一)时代英语·高二(2021年4期)2021-07-291,3,4-噻二唑取代的氮唑类化合物的合成及体外抗真菌活性烟台大学学报(自然科学与工程版)(2021年1期)2021-03-19希望诗潮(2021年1期)2021-03-15浅谈高温抗氧化涂料在LF炉石墨电极的应用建材发展导向(2019年10期)2019-08-24留住容颜之抗氧化时尚北京(2016年12期)2017-01-16默默真爱暖幼苗中国火炬(2015年12期)2015-07-31推荐访问:活性氧 丙酮 胁迫