COVID-19药物重定位研究进展
来源:优秀文章 发布时间:2023-01-15 点击:
李凤婷,刘梦璇,王晓波,罗一夫,张治然
·新型冠状病毒专栏·
COVID-19药物重定位研究进展
李凤婷,刘梦璇,王晓波,罗一夫,张治然
116044 大连医科大学药学院(李凤婷、刘梦璇);
116021 大连,中国人民解放军联勤保障部队第967医院药剂科(李凤婷、刘梦璇、王晓波、罗一夫、张治然)
药物重定位发现药物新的治疗作用主要有 4 个途径:一是以临床发现为导向,通过追踪药物效果和副作用来实现药物重定位;
二是以药物经典机制治疗学价值再发现为导向;
三是以靶向作用为导向;
四是以老药新发现的药理作用为导向。大多数被考虑用于重新定位的药物都已上市,由于多年的临床经验,它们的使用剂量和产生的毒性均已很清楚,使得其在 II ~ III 期临床试验中可以被快速评估,甚至直接使用。药物重定位的主要优势在于已知候选药物的安全性,缩短了开发时间以及降低了推进候选药物进入临床试验的成本。因此,针对突然暴发的 COVID-19,采用药物重定位策略寻找治疗药物就成为一条很有希望而且快速有效的寻找治疗药物策略。
1.1 新冠肺炎的临床表现
新型冠状病毒肺炎,简称“新冠肺炎”。主要临床表现为发热、干咳、乏力等,少数患者伴有鼻塞、流涕、腹泻等上呼吸道和消化道症状,重症病例多在 1 周后出现呼吸困难,更为严重者快速发展为急性呼吸窘迫综合征(ARDS),出现脓毒症休克、难以纠正的代谢性酸中毒和凝血功能障碍及多器官功能衰竭等症状。此外,轻症患者仅表现为低热、轻微乏力等,重症、危重症患者可能表现为中低热,甚至无明显发热。从目前收治的病例情况看,多数患者预后良好,少数患者病情危重,老年人和有慢性基础疾病者预后较差,儿童病例症状相对较轻。
1.2 新型冠状病毒结构与作用机制
新型冠状病毒(SARS-CoV-2)是 2019 年 COVID-19 暴发后在患者体内分离出来的新型病毒株,粒子表面分布刺突样蛋白,在显微镜下能观察到明显凸起的棒状粒子,呈不规则形状,直径 60 ~ 220 nm,这种刺突样形状能加快其在宿主细胞内的复制速度。SARS-CoV-2 是一类有包膜的正性单链 RNA 病毒,病毒颗粒由一个螺旋状衣壳和一个包膜组成,病毒表面具有外包膜结构,上面有 3 种蛋白:刺突蛋白 S、包膜蛋白 E 和膜蛋白 M[1]。
国际病毒分类委员会将冠状病毒暂归为 α、β、γ 和 δ 四个属,近 40 个毒种。其中感染人的冠状病毒共有 6 种(HCoV-229E、O3、N3、HK、SARS-CoV 和 MERS-CoV),加上 2019 年 12 月新出现的 COVID-19 病毒,目前发现的人冠状病毒共有 7 种。除 HCoV-229E 和 N3 属于α 冠状病毒属外,其他 5 种人冠状病毒均属于 β 冠状病毒属。
冠状病毒的生命周期可以分为病毒进入、病毒复制、蛋白合成、蛋白组装和出胞释放等基本步骤。在病毒进入的过程中,蛋白 S 发挥着重要作用,蛋白 S 的两个亚单位分别负责与细胞受体结合以及与细胞膜融合,两者协同介导病毒与细胞表面受体结合,启动病毒蛋白 S 构象变化,完成内化和病毒进入,蛋白 S 首先通过亚基中的受体结合域(RBD)与宿主受体结合,然后通过亚基融合病毒和宿主细胞膜介导病毒进入宿主细胞[2-3]。此外,宿主的半胱氨酸组织蛋白酶和跨膜丝氨酸蛋白酶已经被证实参与蛋白 S 水解和完成膜融合的过程。病毒进入细胞后,多蛋白前体在胞浆中被蛋白酶裂解生成功能性非结构蛋白,进而催化病毒基因组复制和蛋白合成。最后,合成的病毒蛋白和基因组 RNA 整合成新的病毒颗粒,通过芽生或胞吐的方式排出[4]。
SARS-CoV-2 颗粒表面的蛋白 S 与肺部上皮细胞表面的 AC 的膜蛋白结合,使得 AC 形状结构发生变化,导致病毒进入细胞内。随后 SARS-CoV-2 利用细胞自身的氨基酸分子、核苷酸分子以及脂类分子,通过化学反应合成新的病毒颗粒。新的病毒颗粒释放到细胞外,利用同样的方式,感染周围正常的细胞,导致大量细胞被病毒感染。当宿主监测到外来病原体后,天然免疫系统被激活,大量免疫细胞进入肺组织,同时释放细胞因子,形成细胞因子风暴,攻击被感染的细胞,最终导致肺炎,甚至急性呼吸窘迫综合征[5]。
通过大范围检索,目前已经进行或正在进行的 COVID-19 药物重定位临床试验共检索到 1036 项,其中中国、美国进行的临床试验较多,同时西班牙、英国等国也均进行了大量临床试验。图 1 显示了进行重定位临床试验数量前六位的国家,图 2 显示了药物重定位临床数量大于 30 的药物。

图1 重定位临床试验数量前六位的国家
本研究总结了已发布结果的 21 项药物重定位临床试验,表 1 对其发布的结果及临床研究阶段进行了整理。表 2 收集整理了 21 项临床试验所用药物及药物重定位治疗 COVID-19 的病理生理学文献,排除重复药物,共整理出 23 个临床药物。
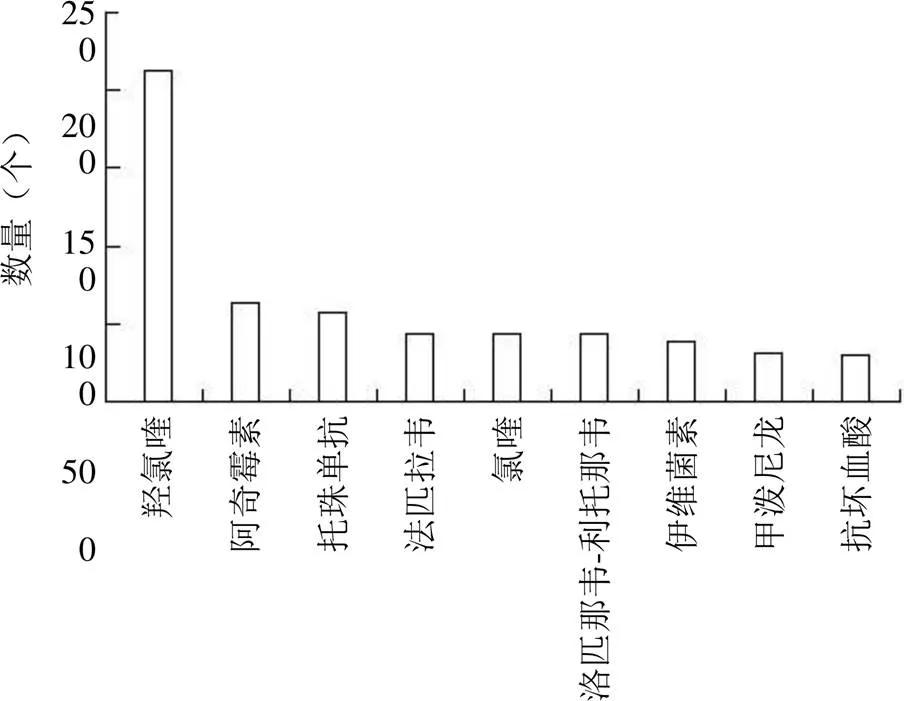
图2 药物重定位临床数量大于 30 的药物
表1 发布结果的临床试验
研究标题研究结果实验组所用药物临床阶段 Clinical trial of ivermectin plus doxycycline for thetreatment of confirmed Covid-19 infection接受伊维菌素和多西环素治疗的轻度至中度 COVID-19 感染患者恢复得更早,不太可能发展为更严重的疾病,并且更有可能在第 14 天通过 RT-PCR检测出COVID-19 阴性[6]伊维菌素、多西环素第三阶段 Adaptive COVID-19 treatment trial 2 (ACTT-2)数据显示,瑞德西韦在缩短因 COVID-19 住院并有下呼吸道感染证据的成年人的康复时间方面优于安慰剂[7]瑞德西韦第三阶段 Adaptive COVID-19 treatment trial (ACTT)在 COVID-19 患者中,尤其是在接受高流量氧气或无创通气的患者中,巴瑞克替尼联合瑞德西韦在缩短恢复时间和加速改善临床状态方面优于单独使用瑞德西韦。该组合与较少的严重不良事件相关[8]瑞德西韦、巴瑞克替尼第三阶段 Hydroxychloroquine as chemoprevention for COVID-19for high risk healthcare workers羟氯喹既不会加速 PCR 的阴性转化,也不会加速临床恢复。结论是,在这些患者中使用羟氯喹并不优于安慰剂[9]硫酸羟氯喹第二阶段 The PATCH trial (prevention and treatment of COVID-19with hydroxychloroquine)这项随机临床试验并未发现预防性服用羟氯喹会减少SARS-CoV-2的传播,所有感染 SARS-CoV-2 的参与者要么无症状,要么病程较轻且完全康复。因此,不建议在医护人员中常规使用羟氯喹来预防COVID-19[10]硫酸羟氯喹第二阶段 Effectiveness of ivermectin as add-on therapy inCOVID-19 management与对照组相比,硫酸羟氯喹和齐多夫定加用伊维菌素效果更好,住院时间更短,且相对安全。然而,可能需要更大的前瞻性研究和更长的随访来验证这些结果[11]伊维菌素第一阶段 Povidone-iodine vs essential oil vs tap water garglingfor COVID-19 patients未经稀释的聚维酮碘漱口水15 s 内对SARS-CoV-2 显示出强大的快速抗病毒活性(病毒滴度降低≥ 4 log10)[12]聚维酮碘第二阶段 Single-blind study of a single dose of peginterferonlambda-1a compared with placebo in outpatientswith mild COVID-19在这项针对无并发症 SARS-CoV-2 感染门诊患者的研究中,与安慰剂相比,单次皮下注射聚乙二醇干扰素并没有显著缩短病毒清除或症状消退的时间[13]聚乙二醇干扰素第二阶段 Study to evaluate the safety and antiviral activity ofremdesivir (GS-5734™) in participants with severecoronavirus disease (COVID-19)试验未显示 5 d 疗程和 10 d 疗程静脉注射瑞德西韦治疗在基线时不需要机械通气的 SARS-CoV-2 导致的严重 COVID-19患者的疗效存在显著差异[14]瑞德西韦第三阶段 Study to evaluate the safety and antiviral activity ofremdesivir (GS-5734™) in participants with moderatecoronavirus disease (COVID-19) compared tostandard of care treatment在中度 COVID-19 患者中,随机接受 10 d 瑞德西韦疗程的患者在开始治疗后 11 d 与标准治疗相比,临床状态没有统计学显著差异。与标准治疗相比,随机接受5 d 瑞德西韦疗程的患者在临床状态上存在统计学显著差异,但这种差异的临床重要性尚不确定[15]瑞德西韦第三阶段 Elimination or prolongation of ACE inhibitors andARB in coronavirus disease 2019在因COVID-19入院的患者中,继续和停用肾素-血管紧张素系统抑制剂对急性住院结局有相似的影响。与当前国际社会的建议一致,除非对正在进行的治疗存在明显的医学禁忌证,否则提供者应继续为COVID-19 住院患者开具这些药物[16]ARB/ACEI不适用 Prophylactic ivermectin in COVID-19 contacts伊维菌素具有抗病毒作用,能有效预防与 COVID-19 患者家庭密切接触者发生症状性感染[17]伊维菌素片第三阶段 Convalescent plasma in the treatment of COVID-19结果表明,具有足够抗 SARS-CoV-2 抗体滴度的恢复期血浆是安全的,如果在COVID-19 病程早期给予患者,则有可能对临床结果产生积极影响,包括康复和生存[18]恢复性血浆第二阶段
续表1

研究标题研究结果实验组所用药物临床阶段 Sars-CoV-2/COVID-19 ivermectin Navarra-ISGlobaltrial试验显示,伊维菌素组有降低病毒载量的趋势,有降低IgG 滴度的趋势,这可能反映了较轻的疾病和COVID-19 与组织损伤相关的主要症状的临床益处:嗅觉丧失/减退和咳嗽[19]伊维菌素第二阶段 Mavrilimumab to reduce progression of acute respiratoryfailure in COVID-19 pneumonia and systemichyper-inflammation在患有严重 COVID-19 肺炎、低氧血症和全身性过度炎症的患者中,在第 14 天,接受玛弗利木单抗但没有补充氧气的患者比例没有统计学意义上的增加,在第 28 天,接受玛弗利木单抗的患者存活比例明显增加[20]玛弗利木单抗第二阶段 Dornase alfa for ARDS in patients with severe acuterespiratory syndrome-coronavirus-2 (SARS-CoV-2)阿法链道酶降解细胞外 DNA 以减少黏液僵硬和积聚,应考虑用于治疗严重COVID-19 的临床试验[21]阿法链道酶吸入溶液第三阶段 Outcomes related to COVID-19 treated withhydroxychloroquine among in-patients withsymptomatic disease在因 COVID-19 住院的呼吸系统疾病成人中,与安慰剂相比,羟氯喹治疗在第 14 天并未显著改善临床状态。这些发现不支持在住院成人中使用羟氯喹治疗 COVID-19[22]羟氯喹第三阶段 Intranasal heparin tolerability study肝素有效抑制 SARS-CoV-2 的进入[23]鼻内肝素钠第一阶段初期 Sarilumab COVID-19建议在危重 COVID-19 患者中进行有足够效力的靶向免疫调节疗法试验,以评估生存期作为主要终点[24]萨瑞鲁单抗第三阶段 Methylprednisolone for patients with COVID-19severe acute respiratory syndrome在严重的 COVID-19 肺炎患者中,早期长期、低剂量 MP 治疗与显著降低死亡风险(71%)和减少对呼吸机的依赖相关。治疗是安全的,不影响病毒清除[25]甲基泼尼松龙未知 Post-exposure prophylaxis/preemptive therapy forSARS-Coronavirus-2在高风险或中等风险暴露于 COVID-19 后,羟氯喹在暴露后4 d 内用作暴露后预防时,不能预防与COVID-19 相容的疾病或确诊感染[26]羟氯喹第三阶段
表2 COVID-19 药物重定位药物分类
药物类别药品名称作用靶点作用机制原适应证 抗生素类药物3% 盐酸四环素30S 亚基阻止氨酰基与核糖核蛋白体的结合,阻止肽链的增长和蛋白质的合成,从而抑制细菌的生长,在细菌胞内或胞外干扰细胞分裂进程主要用于细菌性痢疾、沙眼、百日咳、肺炎、化脓性脑膜炎、皮肤感染、中耳炎等 伊维菌素甘氨酸受体亚基 α-3具有选择性的抑制作用,通过与无脊柱动物神经细胞与肌肉细胞中谷氨酸为阀门的氯离子通道的高亲和力结合而导致细胞膜对氯离子通透性的增加,引起神经细胞或肌肉细胞超极化,使寄生虫麻痹或死亡半合成的广谱抗寄生虫药 阿奇霉素蛋白质精氨酸脱亚氨酶4 型阿奇霉素与细菌 50S 核糖体亚基的 23SrRNA 结合治疗或预防已证实或强烈怀疑由易感细菌引起的感染 强力霉素16S 核糖体 RNA阻止蛋白质合成的启动,终止细菌的复制治疗革兰氏阳性和革兰氏阴性细菌,需氧菌和厌氧菌以及其他类型细菌的各种感染 抗病毒类药物法匹拉韦RNA 指导的 RNA 聚合酶催化亚基防止病毒从细胞进入和排出治疗对常规治疗无反应的流感病例 利巴韦林RNA 指导的 RNA 聚合酶催化亚基抑制病毒 RNA 和蛋白质合成与其他抗病毒药物联合治疗慢性丙型肝炎病毒感染 洛匹那韦HIV-1 蛋白酶HIV-1 蛋白酶抑制剂HIV-1 感染疾病 利托那韦HIV-1 蛋白酶HIV-1 蛋白酶抑制剂与其他抗逆转录病毒药物联合使用可治疗 HIV-1 感染 阿比多尔/抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制A 类,B 类流感病毒引起的上呼吸道感染 瑞德西韦复制酶多蛋白 1ab通过相应的 RdRp 复合物掺入新合成的病毒 RNA 中用于治疗冠状病毒 抗凝剂氨甲环酸片血纤维蛋白溶酶分子上的赖氨酸竞争性阻抑纤溶酶原在纤维蛋白上吸附,从而抑制纤溶酶原的激活用于全身纤溶亢进所致的出血,局部纤溶亢进所致的异常出血 肝素钠抗凝血酶 III选择性抑制 ATIII 介导的因子 Xa预防静脉血栓栓塞的发生 阿司匹林前列腺素 G/H 合酶 1阻止前列腺素的合成治疗疼痛、发烧和发炎
续表2

药物类别药品名称作用靶点作用机制原适应证 糖皮质激素类甲基泼尼松龙糖皮质激素受体减少血管扩张、毛细血管通透性、减少白细胞向炎症部位的迁移适用于多种内分泌、风湿性、胶原蛋白皮肤病 地塞米松糖皮质激素受体减少血管扩张和毛细血管通透性、减少白细胞向炎症部位的迁移和环丙沙星滴耳悬液联用,适用于细菌感染,治疗多发性骨髓瘤 血管紧张素转化酶抑制剂雷米普利血管紧张素转化酶强效和长时间作用的血管紧张素转化酶抑制剂使血浆肾素活性升高,血管紧张素 II 及醛固酮血浆浓度下降,导致外周血管扩张和血管阻力下降,从而产生有益的血流动力学效应用于高血压、充血性心力衰竭及降低急性心肌梗死后死亡率 氯沙坦I 型血管紧张素 II 受体松弛血管平滑肌,降低血压治疗 6 岁以上的高血压 免疫调节剂类聚乙二醇干扰素干扰素 α/受体仅表现出一种亚型用于/治疗肝炎(病毒、丙型肝炎),白血病(淋巴样),白血病(髓样),白血病(未指明)和黑色素瘤 托珠单抗IL-6 受体亚基 α重组人源化单克隆抗体 IL-6 受体抑制剂治疗中度至重度类风湿性关节炎 萨瑞鲁单抗IL-6 受体亚基 α一种人类重组 Ig 抗体,可与两种形式的 IL-6受体结合,从而抑制 IL-6 介导的信号传导适用于对抗风湿药物或肿瘤坏死因子拮抗剂无反应、反应不足或不耐受的中度至重度反应性类风湿关节炎成年患者 其他氯喹谷胱甘肽 S 转移酶肿瘤坏死因子将氯喹捕获在细胞器中并提高周围的 pH 值,从而抑制病毒复制治疗感染间日疟原虫、疟原虫、卵形疟原虫和敏感菌恶性疟原虫,也用于治疗肠外阿米巴病,还用于治疗风湿性疾病 聚维酮碘/氧化病原体原浆蛋白的活性基团,并能与蛋白质的氨基结合而使其变性,从而有效地杀死细菌、芽孢、真菌、病毒及原虫等病原体广谱的强力杀菌消毒剂,对病毒、细菌、真菌及霉菌孢子都有较强的杀灭作用 阿法链道酶//与常规治疗方法结合在一起治疗肺囊性纤维化
3.1 抗病毒类药物重定位
洛匹那韦、利托那韦是 HIV 蛋白酶抑制剂,原适用于与其他抗反转录病毒药物联合用药,治疗成人和 2 岁以上儿童的HIV-1 感染,与严重急性呼吸窘迫综合征冠状病毒有结合位点,主蛋白酶(Mpro)是冠状病毒中病毒复制的关键酶,而冠状病毒主蛋白酶和新型冠状病毒主蛋白酶的蛋白序列相似度超过 90%,因此洛匹那韦-利托那韦可作为潜在的抗 COVID-19 治疗药物[27]。其抗病毒的作用机制是通过阻止病毒复制过程中的多聚蛋白的裂解,导致产生未成熟的病毒颗粒,阻挠产生成熟的具有传染性的病毒粒子[28]。洛匹那韦是主要的病毒蛋白酶抑制剂,而利托那韦能通过作用于细胞色素 50 异构体 CY 来增加洛匹那韦的半衰期。
在一项随机对照试验中,将洛匹那韦和利托那韦联合治疗方法与 COVID-19 住院患者的常规护理进行了比较[29]。结果显示洛匹那韦和利托那韦联合使用对降低患者 28 d 出院率、死亡率和无创机械通气无显著差异,接受有创机械通气具有显著的统计学差异。洛匹那韦和利托那韦带来的不良反应包括腹泻、恶心和肝功能损害等,重度肝功能不全患者禁用。
3.2 血管紧张素转化酶抑制剂类药物重定位
血管紧张素转化酶抑制剂(ACEI)是一种抑制血管紧张素转化酶活性的化合物,临床主要用于治疗高血压、心衰等疾病。现有研究表明,ACE2 在冠状病毒进入体内导致严重急性呼吸综合征肺部损伤的病理生理学机制中发挥重要的作用[30]。一方面,ACE2 的 Spike 蛋白可与肺泡上皮细胞的ACE2 结合,从而诱发一系列炎症反应导致肺损伤[31]。另一方面,在 SARS 和某些流感病毒导致的急性肺损伤中ACE2在一定程度上缓解由于过度激活的肾素-血管紧张素-醛固酮系统(RAAS)所导致的肺纤维化和肺损伤[32]。
徐梦丹等[33]研究了 ACEI 治疗新型冠状病毒肺炎合并高血压患者预后的相关性问题。结果表明对于新冠肺炎合并高血压患者,新冠肺炎病程期间服用 ACEI 类药物可能与死亡及ARDS、脓毒症休克的发生呈负相关,对新冠肺炎合并高血压患者的预后并无不利作用。图3 是以死亡为主要临床终点,以 ARDS、脓毒症为次要临床终点,ACEI/ARB 组与非 ACEI/ARB 组相比,前者的 ARDS 和脓毒症休克发生率均明显低于后者。因此,鉴于目前的研究结果,许多国际高血压学术组织纷纷发表声明,不建议 COVID-19 伴有高血压患者停用 ACEI/ARB 类降压药。

图3 ACEI/ARB 组与非 ACEI/ARB 组住院期间临床结果
3.3 免疫调节剂类药物重定位
托珠单抗是一种重组人源化抗人IL-6 受体单克隆抗体,抗风湿性关节炎以及细胞因子释放综合征的药物,本品用于治疗对改善病情的抗风湿药物治疗应答不足的中到重度活动性类风湿关节炎的成年患者。研究表明,对慢性自身免疫性疾病给予托珠单抗治疗可能会阻止严重COVID-19 的发生[34]。在另一项临床研究中,托珠单抗的使用显示 15 例患者中有 10 例患者的血清 IL-6 水平降低,观察结果表明,对于有细胞因子风暴风险的患者,托珠单抗是一种很好的治疗选择[35]。托珠单抗的显著不良反应是肝毒性。在这种药物诱导的肝毒性中观察到脂肪变性、脂肪性肝炎和局灶性肝细胞坏死。
3.4 糖皮质激素类药物重定位
甲基泼尼松龙是一种有机化合物,具有较强的抗炎作用。原适用于危重疾病的急救,还可用于皮肤疾病、过敏反应、眼科疾病、胃肠道疾病、脊髓炎及防止癌症化疗引起的呕吐等。主要作用机制是减少血管扩张、毛细血管通透性、减少白细胞向炎症部位的迁移。静脉迅速大剂量给药可能发生全身性的过敏反应,长期用药可能发生骨质疏松、肌无力、肌萎缩、低血钾综合征、胃肠道刺激、消化性溃疡等不良反应。
在一项研究中,Wu 等[36]发现使用甲基泼尼松龙似乎可以降低 COVID-19 肺炎合并急性呼吸窘迫综合征患者的死亡风险。但是,50 例患者中有 23 例死亡,仍然具有较高的死亡率。所以 Wang 等[37]做了关于甲基泼尼松龙治疗重症 COVID-19 肺炎患者的回顾性队列研究。图4 显示了回顾性队列研究结果,图4A 表明接受甲基泼尼松龙治疗的患者血氧饱和度(SpO2)改善较快,图4B 显示接受甲基泼尼松龙治疗的患者的 ICU 住院时长普遍低于没有接受甲基泼尼松龙治疗的患者,图4C 表明接受甲基泼尼松龙治疗的患者总体住院时间较短。在严重的 COVID-19 肺炎患者中,早期低剂量短期使用甲基强的松龙会有较好的临床效果,因此应在急性呼吸窘迫综合征发生前予以考虑使用甲基泼尼松龙,由于试验的不足仍需要未来的随机对照试验来证实这些发现,并进一步研究预后情况。
3.5 抗生素类药物重定位
阿奇霉素属于半合成的大环内酯类抗生素,广泛用于敏感细菌所引起的下列感染:支气管炎、肺炎等下呼吸道感染,皮肤和软组织感染,急性中耳炎,鼻窦炎、咽炎、扁桃体炎等多种细菌性上呼吸道感染疾病。除了其抗菌活性外,这种大环内酯还显示出抗病毒和免疫调节活性。阿奇霉素在治疗COVID-19 过程中有多种作用机制,主要是减少 IL-1β、IL-6、IL-8、IL-12、IFN-γ、IP-10、TNF-α 和 GM-CSF 等促炎细胞因子和趋化细胞因子的产生,还可作用于COVID-19 与呼吸细胞的结合,在细胞内积累导致 pH 增加,可损害反式高尔基体网络(TGN)和溶酶体的功能[38]。使用阿奇霉素最常见的不良反应是胃肠道反应(恶心和腹痛)、中枢和周围神经系统反应(头痛或头晕)、肝毒性和抗菌素耐药性等,由于肝脏是阿奇霉素清除的主要途径,所以阿奇霉素用于明显肝病患者时应慎重。

图4 甲基泼尼松龙治疗重症 COVID-19 肺炎患者的临床结果比较(A:静止状态下 SpO2的动态变化,*P < 0.05;
B:ICU 住院时间;
C:住院时间)
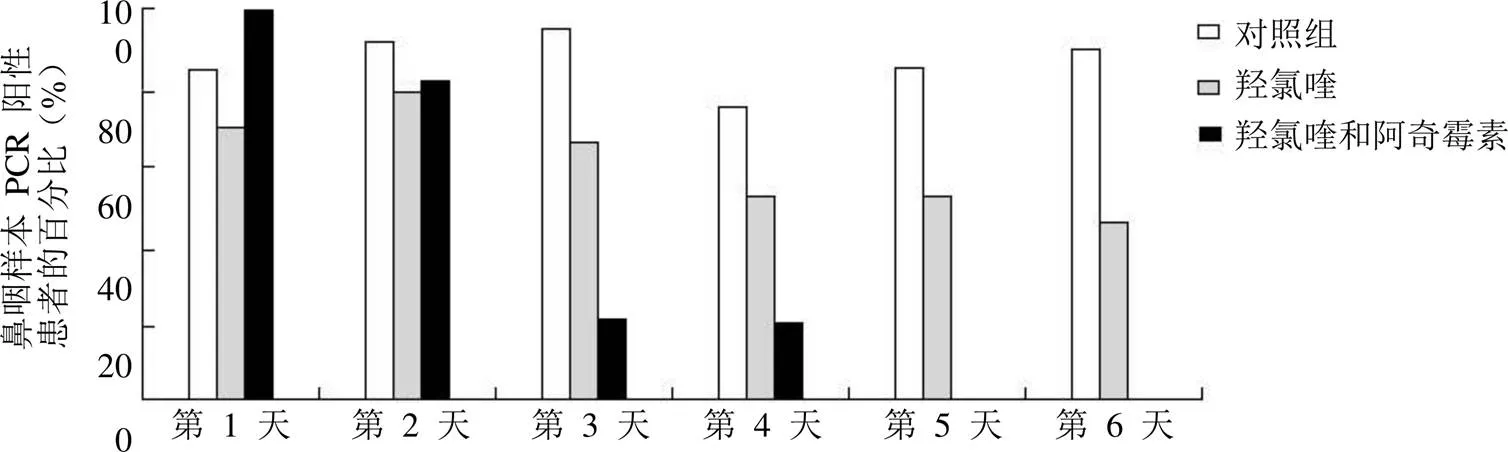
图5 从纳入到纳入第 6 天的 PCR 阳性鼻咽样本百分比
除阿奇霉素之外,强力霉素、伊维菌素、3% 盐酸四环素等抗生素都已用于实验研究对抗 COVID-19,均显示出有一定的疗效。
3.6 抗凝剂类药物重定位
氨甲环酸(TXA)主要用于全身纤溶亢进或局部纤溶亢进所致的出血,以及手术中或手术后异常出血。竞争性阻抑纤溶酶原在纤维蛋白上吸附,从而抑制纤溶酶原的激活。主要不良反应为食欲不振、恶心、呕吐、胃灼烧等,有血栓的患者或有可能出现血栓的患者慎用。最新报告提出,内源蛋白酶纤溶酶通过在病毒的蛋白 S 部分切割新插入的弗林蛋白酶位点而作用于SARS-CoV-2 病毒,从而导致传染性和毒力的增加。而患有高血压、糖尿病、冠状动脉疾病、脑血管疾病、肺疾病和肾功能不全的患者通常血浆纤溶酶、纤溶酶原水平升高,这可能是新冠肺炎合并症患者预后较差的原因。所以,抑制纤溶酶原向纤溶酶的转化,可能是一种有效对抗 COVID-19 的方法。常用药物氨甲环酸可抑制这种转化,所以氨甲环酸可用于 COVID-19 的治疗。主要不良反应为食欲不振、恶心、呕吐、胃灼烧等,有血栓的患者或有可能出现血栓的患者慎用。
3.7 其他类药物重定位
氯喹和羟氯喹是弱的双质子碱,氯喹一直是治疗和预防疟疾的一线药物,羟氯喹对抗恶性疟原虫的活性远远低于氯喹。这些药物的作用途径与病毒类似,集中在内体,从而增加了内体液的pH 值,而内体的酸性 pH 有助于负责蛋白水解和新生蛋白质翻译后修饰的病毒酶达到最佳活性。因此,破坏酸性 pH 值会阻止病毒的复制和生命周期[39]。人们探索了氯喹、羟氯喹再利用来对抗人类免疫缺陷病毒(HIV)和其他与炎症相关的病毒,并发现氯喹、羟氯喹可以有效地抑制其生命周期[40]。对于 SRAS-CoV-2,使用氯喹需要高剂量,但据报道过量的氯喹会导致中毒和死亡[41],相比之下,羟氯喹更安全,毒性降低 40%[42],氯喹、羟氯喹治疗剂量的不良反应包括视网膜病变、肌病、心电图改变、头痛、头晕和胃肠道不适等[43-45]。
有研究已经验证了氯喹、羟氯喹可能有助于治疗 COVID-19[46]。Gautret 等[47]对每天服用600 mg 羟氯喹的 COVID-19 感染者进行了一项临床试验研究,结果发现,在这些COVID-19 受试者中,羟氯喹与病毒载量降低和病毒消失相关,并且合用阿奇霉素可以增强其效果。图5 显示了在仅接受羟氯喹治疗的 COVID-19 患者、接受羟氯喹和阿奇霉素联合治疗的 COVID-19 患者以及 COVID-19 对照患者中,从纳入到纳入后第 6 天的鼻咽样本 PCR 阳性患者的百分比。
3.8 传统中药治疗 COVID-19 效果
在新冠肺炎预防和救治的过程中,中草药煎剂和中成药制剂被普遍使用,常用的草药有黄芪、黄芩、柴胡、贯众、连翘、杏仁等,恢复期的患者还用了人参等补益药。湖北省发布的有生黄芪 10 g、炒白术 10 g、防风 10 g、贯众 10 g、金银花 10 g、佩兰 10 g、陈皮 6 g 组方的七味汤又称二号方,可用于 COVID-19 的预防和轻症患者的治疗[48]。
连花清瘟是国家卫生健康委诊疗方案第四版推荐的中药治疗新冠肺炎的重要药物,其主要功效是清瘟解毒,宣肺泄热,用于治疗流行性感冒。曾在多年前的病毒性流感治疗中取得了不错的效果,这次对 COVID-19 也有较好疗效。临床前药理试验证明该品对多种病毒性、细菌感染均有抑制作用[49],对新冠肺炎患者有较好地改善发热、咳嗽、乏力等症状的作用。临床观察显示,治疗 7 d 之后,患者三种症状消失率分别为 80.00%、75.70%、76.70%[50]。表 3 显示了新冠肺炎患者服用连花清瘟 3天、5 天、7 天时发热、咳嗽、乏力症状的消失率。
表3 新冠肺炎患者服用连花清瘟后主要症状消失率(%)
发热乏力咳嗽 3天47.5035.1020.00 5天62.5059.5050.00 7天80.0075.7076.70
血必净注射液是和连花清瘟胶囊一同被国家药品监督管理局批准用于新冠肺炎治疗的中成药。不同的是,血必净可用于 COVID-19 重症和危重症的救治。血必净由红花、赤芍、川芎、丹参、当归等有效成分组成,起活血化瘀的作用,可改善重症和危重症患者的症状。
本文梳理了现有研究治疗 COVID-19 有结果的 21 项临床试验,排除重复药物后整理了 23 种治疗 COVID-19 药物重定位的药物,还包括了传统中药。结果显示伊维菌素、瑞德西韦、多西环素、甲基泼尼松龙等药物及生物恢复性血浆具有显著的抗 COVID-19 的疗效,并且联合用药比单独用药的效果更加明显,同时也发现羟氯喹对预防 COVID-19 并无太大作用,临床并不建议使用羟氯喹作为预防药物。很多临床使用的治疗药物是根据药物重定位的方法找到突破口,除此之外,还有既往治疗 MERS 和 SARS 及其他新型流感病毒的经验,对抗病毒治疗药物均适用。
目前面对药物重定位最大的困难就是信息杂乱,不能全面而系统地进行临床试验,费时耗力。药物重定位的方法之一以靶向为目标,可以结合生物信息学技术,利用计算机建模,分析现有的海量临床数据和生物信息学数据,更加快速高效地进行药物重定位研究,发现更多可用的治疗药物。
[1] Gu JF. The latest progress in research on clinical therapeutic agents of COVID-19. Chin J New Drug, 2021, 30(2):154-161. (in Chinese)
顾觉奋. 新型冠状病毒肺炎临床治疗药物最新研究进展. 中国新药杂志, 2021, 30(2):154-161.
[2] Li F, Li W, Farzan M, et al. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor. Science, 2005, 309(5742):1864-1868.
[3] Liu S, Xiao G, Chen Y, et al. Interaction between heptad repeat 1 and 2 regions in spike protein of SARS-associated coronavirus: implications for virus fusogenic mechanism and identification of fusion inhibitors. Lancet, 2004, 363(9413):938-947.
[4] Quan YN, Wang YX, Li YP. Research progress on the development of therapeutic agents against human coronaviruses. Chin Med Biotechnol, 2020, 15(2):97-108, 143. (in Chinese)
全彦妮, 王宜轩, 李艳萍. 人冠状病毒治疗药物研究进展. 中国医药生物技术, 2020, 15(2):97-108, 143.
[5] Tai W, He L, Zhang X, et al. Characterization of the receptor-binding domain (RBD) of 2019 novel coronavirus: implication for development of RBD protein as a viral attachment inhibitor and vaccine. Cell Mol Immunol, 2020, 17(6):613-620.
[6] Mahmud R, Rahman MM, Alam I, et al. Ivermectin in combination with doxycycline for treating COVID-19 symptoms: a randomized trial. J Int Med Res, 2021, 49(5):3000605211013550.
[7] Kalil AC, Patterson TF, Mehta AK, et al. Baricitinib plus remdesivir for hospitalized adults with Covid-19. N Engl J Med, 2021, 384(9): 795-807.
[8] Beigel JH, Tomashek KM, Dodd LE, et al. Remdesivir for the treatment of Covid-19 - final report. N Engl J Med, 2020, 383(19): 1813-1826.
[9] Jahngir MU, Mbbs MSG, Kirmani JF, et al. Narrative review of chloroquine and hydroxychloroquine for treatment of Coronavirus disease 2019. Health Care Res J, 2021, 2(1):15-26.
[10] Abella BS, Jolkovsky EL, Biney BT, et al. Efficacy and safety of hydroxychloroquine vs placebo for pre-exposure SARS-CoV-2 prophylaxis among health care workers a randomized clinical trial. JAMA Intern Med, 2021, 181(2):195-202.
[11] Gorial FI, Mashhadani S, Sayaly HM, et al. Effectiveness of ivermectin as add-on therapy in COVID-19 management (pilot trial). medRxiv, 2020. Preprint
[12] Hassandarvish P, Tiong V, Mohamed NA, et al. In vitro virucidal activity of povidone iodine gargle and mouthwash against SARS-CoV-2: implications for dental practice. Br Dent J, 2020. Online ahead of print.
[13] Jagannathan P, Andrews JR, Bonilla H, et al. Peginterferon Lambda-1a for treatment of outpatients with uncomplicated COVID-19: a randomized placebo-controlled trial. Nat Commun, 2021, 12(1):1967.
[14] Goldman JD, Lye DCB, Hui DS, et al. Remdesivir for 5 or 10 days in patients with severe Covid-19. N Engl J Med, 2020, 383(19):1827- 1837.
[15] Spinner CD, Gottlieb RL, Criner GJ, et al. Effect of remdesivir vs standard care on clinical status at 11 days in patients with moderate COVID-19: a randomized clinical trial. JAMA, 2020, 324(11):1048- 1057.
[16] Cohen JB, Hanff TC, William P, et al. Continuation versus discontinuation of rennin-angiotensin system inhibitors in patients admitted to hospital with COVID-19: a prospective, randomised, open-label trial. Lancet Respir Med, 2021, 9(3):275-284.
[17] Shouman W. Use of ivermectin as a prophylactic option in asymptomatic family close contacts with patients of COVID-19. (2020-05-31). https://clinicaltrials.gov/ProvidedDocs/61/NCT04422561/ Prot_SAP_000.pdf
[18] Ibrahim D, Dulipsingh L, Zapatka L, et al. Factors associated with good patient outcomes following convalescent plasma in COVID-19: a prospective phase II clinical trial. Infect Dis Ther, 2020, 9(4):913- 926.
[19] Chaccour C, Casellas A, Blanco-Di Matteo A, et al. The effect of early treatment with ivermectin on viral load, symptoms and humoral response in patients with non-severe COVID-19: A pilot, double-blind, placebo-controlled, randomized clinical trial. EClinicalMedicine, 2021, 32:100720.
[20] Cremer PC, Abbate A, Hudock K, et al. Mavrilimumab in patients with severe COVID-19 pneumonia and systemic hyperinflammation (MASH-COVID): an investigator initiated, multicentre, double-blind, randomised, placebo-controlled trial. Lancet Rheumatol, 2021, 3(6): e410-e418.
[21] Earhart AP, Holliday ZM, Hofmann HV, et al. Consideration of dornase alfa for the treatment of severe COVID-19 acute respiratory distress syndrome. New Microbes New Infect, 2020, 35:100689.
[22] Casey JD, Johnson NJ, Semler MW, et al. Rationale and design of ORCHID: a randomized placebo-controlled clinical trial of hydroxychloroquine for adults hospitalized with COVID-19. Ann Am Thorac Soc, 2020, 17(9):1144-1153.
[23] Tandon R, Sharp JS, Zhang F, et al. Effective inhibition of SARS-CoV-2 entry by heparin and enoxaparin derivatives. J Virology, 2020, 95(3):e01987-20.
[24] Lescure FX, Honda H, Fowler RA, et al. Sarilumab in patients admitted to hospital with severe or critical COVID-19: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med, 2021, 9(5):522-532.
[25] Salton F, Confalonieri P, Meduri GU, et al. Prolonged low-dose methylprednisolone in patients with severe COVID-19 pneumonia. Open Forum Infect Dis, 2020, 7(10):ofaa421.
[26] Boulware DR, Pullen MF, Bangdiwala AS, et al. A randomized trial of hydroxychloroquine as postexposure prophylaxis for Covid-19. N Engl J Med, 2020, 383(6):517-525.
[27] Xu X, Chen P, Wang J, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci, 2020, 63(3):457-460.
[28] Croxtall JD, Perry CM. Lopinavir/Ritonavir: a review of its use in the management of HIV-1 infection. Drugs, 2010, 70(14):1885-1915.
[29] RECOVERY Collaborative Group. Lopinavir–ritonavir in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet, 2020, 396(10259): 1345-1352.
[30] Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on AC and TMPRS and is blocked by a clinically proven protease inhibitor. Cell, 2020, 181(2):271-280.
[31] Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature, 2003, 426(6965):450-454.
[32] Tan WSD, Liao W, Zhou S, et al. Targeting the renin-angiotensin system as novel therapeutic strategy for pulmonary diseases. Curr Opin Pharmacol, 2018, 40:9-17.
[33] Xu MD, Yao YT, Wu Y, et al. Association of angiotensin converting enzyme inhibitors/angiotensin receptor blockers treatment and prognosis of patients with cornavirus disease 2019 and hypertension. Chin J Hypertens, 2021, 29(2):126-132. (in Chinese)
徐梦丹, 姚玉婷, 吴莹, 等. 血管紧张素转换酶抑制药/血管紧张素受体阻滞药治疗与新型冠状病毒肺炎合并高血压患者预后的相关性. 中华高血压杂志, 2021, 29(2):126-132.
[34] Mihai C, Dobrota R, Schrder M, et al. COVID-19 in a patient with systemic sclerosis treated with tocilizumab for SSc-ILD. Ann Rheum Dis, 2020, 79(5):668-669.
[35] Luo P, Liu Y, Qiu L, et al. Tocilizumab treatment in COVID-19: a single center experience. J Med Virol, 2020, 92(7):814-818.
[36] Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JJAMA Intern Med, 2020, 180(7):934-943.
[37] Wang Y, Jiang W, He Q, et al. A retrospective cohort study of methylprednisolone therapy in severe patients with COVID-19 pneumonia. Signal Transduct Target Ther, 2020, 5(1):57.
[38] Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: a clinical-therapeutic staging proposal.
J Heart Lung Transplant, 2020, 39(5):405-407.
[39] Al-Bari MAA. Targeting endosomal acidification by chloroquine analogs as a promising strategy for the treatment of emerging viral diseases. Pharmacol Res Perspect, 2017, 5(1):e00293.
[40] Boelaert JR, Piette J, Sperber K. The potential place of chloroquine in the treatment of HIV-1-infected patients. J Clin Virol, 2001, 20(3): 137-140.
[41] de Olano J, Howland MA, Su MK, et al. Toxicokinetics of hydroxychloroquine following a massive overdose. Am J Emerg Med, 2019, 37(12):2264.e5-2264.e8.
[42] McChesney EW. Animal toxicity and pharmacokinetics of hydroxychloroquine sulfate. Am J Med, 1983, 75(1A):11-18.
[43] Alving AS, Eichelberger L, Craige B, et al. Studies on the chronic toxicity of chloroquine (sn-7618). J Clin Invest, 1948, 27(3 Pt 2): 60-65.
[44] Looareesuwan S, White NJ, Chanthavanich P, et al. Cardiovascular toxicity and distribution kinetics of intravenous chloroquine. Br J Clin Pharmacol, 1986, 22(1):31-36.
[45] Hickley NM, Al-Maskari A, McKibbin M. Chloroquine and hydroxychloroquine toxicity. Arch Ophthalmol, 2011, 129(11):1506- 1507.
[46] Meo SA, Klonoff DC, Akram J. Efficacy of chloroquine and hydroxychloroquine in the treatment of COVID-19. Eur Rev Med Pharmacol Sci, 2020, 24(8):4539-4547.
[47] Gautret P, Lagier JC, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents, 2020, 56(1): 105949.
[48] Liu SL, Liu W. An overview on therapeutic drugs of COVID-19 and its mechanism. Practical J Med Pharm, 2021, 38(2):180-183. (in Chinese)
刘淑磊, 刘卫. 新型冠状病毒肺炎治疗药物及其作用机制概述. 实用医药杂志, 2021, 38(2):180-183.
[49] Qi GD, Qi W, Jiang Q, et al. The efficacy of Lianhua Qingwen combined with western medicine scheme on COVID-19 general type patients: a systematic review. Clin J Traditional Chin Med, 2020, 32(7):1195-1199. ( in Chinese)
漆国栋, 漆伟, 江琼, 等. 连花清瘟结合西医方案对新冠肺炎普通型患者疗效的系统评价. 中医药临床杂志, 2020, 32(7):1195-1199.
[50] Cheng DZ, Li Y. Clinical effectiveness and case analysis in 54 NCP patients treated with Lanhuaqingwen granules. World Chin Med, 2020, 15(2):150-154. (in Chinese)
程德忠, 李毅. 连花清瘟颗粒治疗54例新型冠状病毒肺炎患者临床分析及典型病例报道. 世界中医药, 2020, 15(2):150-154.
10.3969/j.issn.1673-713X.2022.04.001
罗一夫,Email:luoyifu2013@163.com;
张治然,Email:zzr6602@sina.com
2022-03-28
猜你喜欢 氯喹定位肺炎 来势汹汹的肺炎青少年科技博览(中学版)(2021年4期)2021-08-30磷酸氯喹科学导报·学术(2020年19期)2020-07-09欧洲多国禁用特朗普“神药”环球时报(2020-05-29)2020-05-29停药了!特朗普结束服用羟氯喹环球时报(2020-05-26)2020-05-26一分钟了解新型冠状病毒感染的肺炎小读者之友(2020年4期)2020-05-1570年老药氯喹带来“新希望”文萃报·周五版(2020年9期)2020-03-05My Heroes阅读(快乐英语高年级)(2020年8期)2020-01-08看,这个肺炎最大“祸因”新民周刊(2019年40期)2019-10-28少儿智能定位鞋服成新宠海峡姐妹(2018年2期)2018-04-12把握新定位、新要求 推动人大工作创新发展人大建设(2018年12期)2018-03-21推荐访问:研究进展 药物 定位推荐文章