不同方法构建小鼠过敏性结膜炎免疫耐受模型的比较
来源:优秀文章 发布时间:2022-12-02 点击:
白梦天,李 韵,胡竹林
近年来,过敏性结膜炎的发病率逐年上升,该趋势在经济发达的国家和地区更为明显[1-2]。遗传背景的差异难以较好解释该流行病学特点。目前的观点认为,过敏性结膜炎发病率增高主要与工业化进展加剧、城市环境污染以及全球气候变暖有关[3-4]。但结合日常诊疗实际,发现多数过敏性结膜炎患者均有较好的生活条件和洁净舒适的工作环境,因此我们猜想,是否“过度洁净”的环境反而增加了过敏性结膜炎的发病率。“卫生假说”指出,不洁的居住环境、较差的生活条件、家庭成员多以及经济水平低的国家和地区过敏性哮喘、湿疹等发病率较低,这可能与更易暴露于微生物、寄生虫以及动植物有关[5],而在生命早期阶段反复暴露于变应原(尘螨、花粉以及微生物等)可显著降低成年后发生过敏性疾病的风险[6]。
抗原特异性治疗(antigen-specific immunotherapy,AIT)正是基于“卫生假说”而提出的,是诱导免疫耐受状态而针对过敏性疾病病因的治疗方式。通过多次口服或皮下注射低剂量特异性抗原,不仅能够抑制Th2、Th17细胞功能,还能够诱导和活化调节性T细胞(regulatory T cells,Treg)和Breg引发机体产生特异性免疫耐受,从而减轻机体过敏症状[7]。已有研究证实,皮下免疫疗法可缓解哮喘症状[8],舌下含服法可改善过敏性鼻结膜炎症状[9],口服法可改善自身免疫性脑脊髓炎[10]、葡萄膜炎[11]、哮喘[12]症状。但该方法疗程长,且不同个体对治疗的效果有明显差异,分析可能是由于患病后较难诱导免疫耐受状态,或成年人难以诱导和维持免疫耐受状态。
基于此,我们认为,个体的免疫耐受状态,取决于其首次暴露于致敏原时淋巴细胞发育情况以及细胞因子的生理环境,根据该情况和环境的差异表现出不同的免疫状态,从而避免或减轻过敏性结膜炎的发生。目前,关于过敏性结膜炎免疫耐受的研究更多的是对已经发病的个体进行免疫耐受治疗,临床上关于过敏性结膜炎的治疗仍以脱离过敏原,减轻炎症反应为主,而未过多关注生命早期的生活环境对疾病的影响。故本研究先给予新生小鼠持续抗原刺激,待其成年后以相同抗原再刺激,观察小鼠眼部情况和全身炎症反应有无减轻,初步探索生命早期与过敏性结膜炎的关系。以期从“卫生假说”和免疫耐受的角度更深入地认识和理解过敏性结膜炎,从而为过敏性结膜炎的预防和诊治提供新的思路。
1.1材料
1.1.1实验动物SPF级Balb/c新生小鼠50只,雄性23只(体质量:1周龄时4.12±1.83g;
3周龄时9.83±2.03g;
7周龄时19.74±2.93g;
8周龄时22.43±3.02g),雌性27只(体质量:1周龄时4.42±0.73g;
3周龄时9.92±2.04g;
7周龄时17.04±1.73g;
8周龄时20.83±2.53g)。所有小鼠购买自昆明医科大学实验动物中心[SCXK(滇)K2015-0002],实验地点为中国医学科学院昆明动物研究所[SYXK(滇)K2017-0008]。本实验方案通过昆明医科大学动物伦理委员会审核(No.kmmu 2019002)。本实验遵从动物实验的3R原则,在动物饲养中给予人道主义关怀。
1.1.2主要试剂和仪器豚草花粉(ragweed,short,RW),Greer Labs公司(美国);
卵清蛋白(ovalbumin,OVA),Sigma公司(美国);
屋尘螨(house dust mite,HDM),Greer Labs公司(美国);
氢氧化铝佐剂(aluminum hydroxide adjuvant),Thermo公司(美国);
RNAiso Plus, TaKaRa公司(日本);
PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa公司(日本);
TB GreenTMPremix Ex TaqTMⅡ,TaKaRa公司(日本);
mice IL-17 ELISA Kit,ELK Biotechnology公司(武汉)。QuantStudio 12K flex实时荧光定量PCR系统,ABI公司(美国);
手术显微镜,蔡司公司(德国)。
1.2方法
1.2.1动物模型的建立本课题组前期工作已完成动物模型建立的条件和方法的摸索及验证,均达到实验要求[13-14]。Balb/c新生乳鼠50只随机分为空白对照组、OVA+皮下注射组、OVA+雾化吸入组、OVA+灌胃组、RW+皮下注射组、RW+雾化吸入组、RW+灌胃组、HDM+皮下注射组、HDM+雾化吸入组、HDM+灌胃组(n=5只/组)。除空白对照组外,1周龄时,各组将相应抗原(5mg/kg)溶解于10μL氢氧化铝佐剂中,并通过相应暴露方式处理小鼠,隔日1次,直至3周龄,其中雾化吸入组小鼠在鼠笼中放置雾化装置,并加入40mL双蒸水,每次雾化30min;
7周龄时,各组小鼠给予相应抗原(25mg/kg)腹腔注射1次;
8周龄时,各组再次给予相应抗原10mg/kg溶解于氢氧化铝佐剂10μL中滴双眼,连续滴3d。末次滴眼20min后行眼前段照相,24h后处死小鼠(注射大剂量戊巴比妥钠),小心分离双眼结膜组织并放置于1.5mL离心管中进行总RNA提取、反转录后,RT-qPCR法检测结膜重组人正常T细胞表达和分泌因子(RANTES)、IL-17 mRNA表达水平;
心脏采血后行ELISA检测血清IL-17浓度变化情况。
1.2.2小鼠血清的制备腹腔注射0.2%戊巴比妥钠彻底麻醉小鼠,全身酒精消毒,转入无菌操作台内,仰卧固定于手术台上。用消毒后的剪刀沿小鼠左侧3~4肋间剪开胸壁,暴露心脏。将1mL针头刺入右心,小心吸取血液后注入1.5mL离心管中,于4℃冰箱中放置24h。3 500r/min离心15min,可见血清呈淡黄色位于离心管最上层。用移液器小心吸取血清于新的1.5mL离心管中,放置于-80℃储存备用。
1.2.3RT-qPCR法检测结膜组织中IL-17和RANTESmRNA表达TRIzol法进行结膜组织总RNA提取,逆转录为 cDNA,模板3μL, 总 体 系 为 20μL。引物序列:IL-17正向引物:5’-TTTAACTCCCTTGGCGCAAAA-3’,反向引物:5’-CTTTCCCTCCGCATTGACAC-3’;
RANTES(CCL5)正向引物:5’-TGCCTAAAGTGTCACATTTTGCTCA-3’,反向引物:5’-CTAAGGAGTGATACACCTCGTAGTTG-3’;
β-actin正向引物:5’-GGCTGTATTCCCCTCCATCG-3’,反向引物:5’-CCAGTTGGTAACAATGCCATGT-3’。
1.2.4ELISA法检测血清IL-17浓度按试剂盒使用说明进行操作,450nm处空白对照调零后测每孔吸光度(A)值。
横坐标为标准品浓度,纵坐标为A值,将各标准品的坐标点连线,绘制成标准曲线,根据待测标本的A值在曲线上查找对应浓度,并乘以稀释倍数后得出相应浓度。
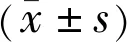
2.1眼前段照相观察各组小鼠眼表变化情况眼前段照相结果显示,OVA+雾化吸入组、OVA+灌胃组、RW+灌胃组、HDM+雾化吸入组表现为遇强光睁眼困难,其中HDM+雾化吸入组结膜囊内还可见大量黏液性分泌物;
RW+雾化吸入组、HDM+灌胃组小鼠可见角膜及球结膜处丝状黏液性分泌物伴倒睫;
OVA+皮下注射组、RW+皮下注射组小鼠可见结膜囊内少量黏液性分泌物,眼睑轻度水肿,睁眼情况较好、未见明显倒睫(图1)。
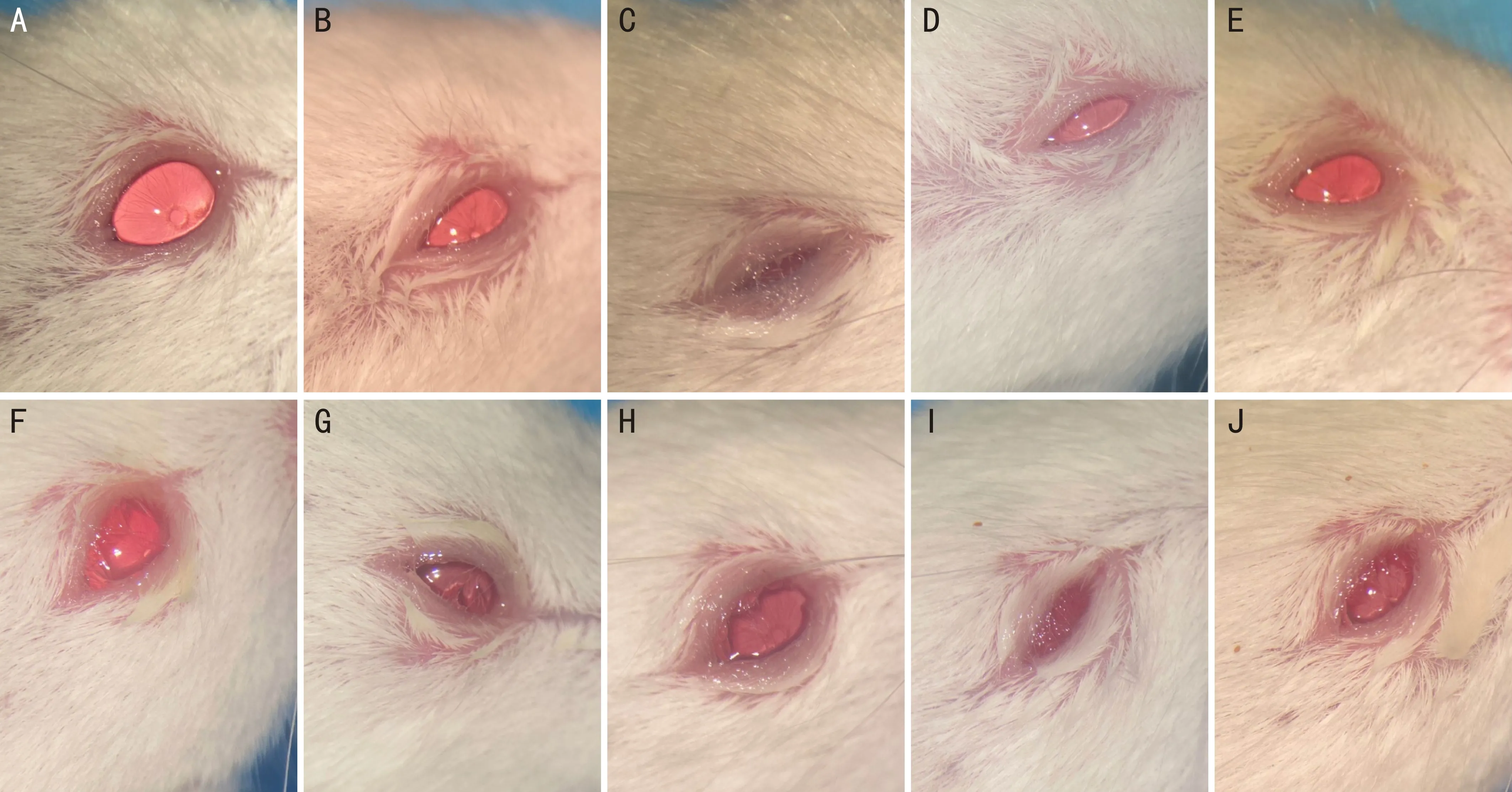
图1 各组小鼠眼前段照相情况 A:空白对照组;
B:OVA+皮下注射组;
C:OVA+雾化吸入组;
D:OVA+灌胃组;
E:RW+皮下注射组;
F:RW+雾化吸入组;
G:RW+灌胃组;
H:HDM+皮下注射组;
I:HDM+雾化吸入组;
J:HDM+灌胃组。
2.2小鼠结膜组织中IL-17和RANTESmRNA的表达情况各组小鼠结膜IL-17 mRNA相对表达水平差异有统计学意义(F=4.82,P=0.03)。各处理组小鼠结膜IL-17 mRNA相对表达水平均较空白对照组增高,差异均有统计学意义(P<0.05),其中RW+灌胃组增高最显著(t=14.92,P=0.0008);
RW+皮下注射组增高程度最低(t=3.18,P=0.037)(图2A)。各组小鼠结膜RANTES mRNA表达水平差异有统计学意义(F=7.18,P=0.01)。各处理组小鼠结膜RANTES mRNA相对表达水平均较空白对照组增高,差异均有统计学意义(P<0.05),其中RW+灌胃组增高最显著(t=31.59,P<0.001)(图2B)。上述结果提示,小鼠在生命早期阶段多次皮下注射OVA和RW后,结膜组织中IL-17和RANTES mRNA相对表达水平增高的程度低于其他处理方式。

图2 各组小鼠结膜组织IL-17和RANTES mRNA相对表达水平 aP<0.05, bP<0.01 vs 空白对照组。
2.3ELISA检测血清IL-17浓度各组小鼠血清IL-17浓度差异有统计学意义(F=43.14,P<0.001)。与空白对照组相比,除OVA+雾化吸入组(t=1.86,P=0.116)和RW+皮下注射组(t=1.82,P=0.118)外,其余处理组小鼠血清IL-17浓度均增高,差异均有统计学意义(P<0.05),其中OVA+灌胃组(25.75±4.25pg/mL)、RW+灌胃组(26.16±5.08pg/mL)和HDM+雾化吸入组(26.70±5.79pg/mL)升高显著(图3)。上述结果提示,小鼠在生命早期阶段多次雾化吸入OVA和多次皮下注射RW后,血清中IL-17浓度增高的程度低于其他处理方式。

图3 各组小鼠血清中IL-17浓度 aP<0.05, bP<0.01 vs 空白对照组。
目前,环境因素对于过敏性结膜炎的影响日益受到关注,而从“卫生假说”和免疫耐受的角度审视生命早期环境因素对于过敏性结膜炎的影响,对于更深入地认识过敏反应机制、制定新的预防和治疗策略可能具有深远的现实意义。因此,如在小鼠生命早期开始给予抗原暴露,且能构建较为稳定的免疫耐受状态以减轻成年后对过敏原的反应性,则有利于针对临床上如何避免形成易过敏体质、重新认识过敏性结膜炎的发生和发展以及制定新的预防和诊治方法提供了一定的现实参考意义。故本研究将所有亲代小鼠终生饲养于独立通气笼具(individual ventilated cages,IVC)系统中,确保新生小鼠仅能经特定的暴露方式暴露于特定抗原下,以保证实验环境的可控制性。
IL-17不仅可发挥自身的促炎作用,还能与Th2发挥协同促炎作用[15]。研究显示,IL-17缺陷小鼠的Th2细胞反应显著降低,并且气道嗜酸性粒细胞数目和活性下降[16]。此外,IL-17通过上调IL-13活性以激活STAT-6而参与过敏反应,这是IL-17同Th2细胞协同反应的首个被发现的机制[17]。C-C家族趋化因子RANTES可分别来自于血小板、单核细胞、嗜酸性粒细胞、上皮细胞,其通过募集T细胞、树突状细胞(dendritic cells,DCs)、嗜酸性粒细胞、肥大细胞在过敏反应中发挥重要作用,其与免疫性疾病的严重程度相关[18-19]。在过敏性哮喘患者的肺组织和支气管肺泡灌洗液中均有RANTES高表达,而抑制RANTES功能后,呼吸道嗜酸性粒细胞数量下降,气道炎症显著改善[20]。RANTES与过敏性结膜炎的关系也得到证实。Leonardi等[21]用TNF-α刺激人结膜成纤维细胞24h后,RANTES和Th2细胞因子浓度均显著增加。此外,末次滴眼激发6h后,棕色挪威大鼠(brown Norway rats,BN)结膜组织中未检测到RANTES mRNA表达,而24h后,RANTES mRNA在结膜组织大量表达[22]。我们既往研究中利用小剂量RW多次皮下注射构建免疫耐受小鼠,其结膜组织中RANTES mRNA及蛋白表达水平、脾细胞悬液中IL-17浓度均低于阳性对照组(过敏性结膜炎组),而睁眼情况、结膜水肿程度以及黏液分泌情况同阳性对照组相比均显著改善,但不同条件下构建的免疫耐受状态是否存在差异仍不得而知[14]。本研究在不同暴露方式下,发现小鼠眼表状态均出现异常,结膜组织RANTES和IL-17 mRNA相对表达水平和血清IL-17浓度均上升,但经皮下注射的小鼠眼表状态更为稳定,且RANTES和IL-17的表达受抑制程度均高于灌胃和雾化吸入,提示经皮下注射的小鼠免疫耐受程度较高。但不同抗原之间的差异难以直接观察,故我们将重点讨论不同暴露方式与过敏性结膜炎免疫耐受模型之间的关系。
小鼠胃肠道中的共生微生物及酶类既可发挥免疫调节功能(分泌趋化因子、细胞因子等),又可对进入胃肠道的蛋白质、脂肪等物质进行酶解,破坏原有的结构和功能,但同时会产生新的蛋白质、多糖和多肽等物质,这些新物质亦具有免疫原性[23-24]。此外,随着母乳喂养的结束,母乳中免疫球蛋白介导的被动免疫将减弱,肠道固有层和上皮层内的B细胞和T细胞数目将逐渐达到成人水平,因此,随着年龄的增长,稳定和持久的免疫耐受状态将难以构建[25]。Longo等[26]将60名5岁对牛奶过敏的儿童随机分为试验组和对照组,在1a时间内,试验组从小剂量开始给予,并逐渐增加牛奶剂量;
而对照组完全不给予牛奶,结果发现,试验组11名儿童对牛奶耐受,16名可接受少量牛奶,3名仍对其过敏;
而对照组仍全部对牛奶过敏,因此认为口服小剂量牛奶可诱导对牛奶过敏的儿童产生免疫耐受。本研究结果表明,经灌胃后的小鼠眼表体征较明显,IL-17和RANTES表达受抑制程度较低,表明免疫耐受状态相对较差。分析原因可能有以下几点:(1)标准尺寸的灌胃针难以进入乳鼠食管,大量抗原物质无法进入胃肠道;
(2)乳鼠胃容积很小且食管肌肉发育不完善,部分抗原经食管反流后被排出体外。
呼吸道诱导免疫耐受状态的解剖学基础为鼻相关淋巴组织,其中皱襞细胞(M细胞)可特异性摄取部分抗原,从而诱导免疫耐受[27]。Li等[28]给予4~5周龄A/J小鼠呼吸道滴入超敏肌钙蛋白(cardiac troponin I,cTnI) 诱导免疫耐受状态成功后构建实验性自身免疫性心肌炎动物模型,结果显示心肌细胞浸润和纤维化程度、左心室功能部分恢复,血清IL-10浓度升高。其还发现,单次大剂量较多次小剂量可诱导更佳的免疫耐受状态,且随着抗原刺激间隔时间的延长,免疫耐受状态的持续时间和稳定性会下降。但Jiang等[29]利用呼吸道滴入光感受器间视黄醇结合蛋白(interphotoreceptor retinoid binding protein,IRBP)诱导自身免疫性葡萄膜炎小鼠模型时却发现,多次小剂量比单次大剂量诱导的免疫耐受状态更稳定。尽管呼吸道存在内屏障以限制抗原,但经雾化处理后的抗原可缓慢入血,因此血液中抗原浓度低,需反复抗原刺激以维持免疫耐受状态。吸入性免疫耐受状态的维持更需要抗原持续性刺激,一旦停止吸入抗原,其免疫耐受状态将逐渐消退甚至消失,故需通过反复吸入抗原维持其状态[30]。因此,经雾化吸入的小鼠眼部体征及促炎因子表达高于经皮下注射小鼠的可能原因为腹腔注射和雾化吸入的时间间隔较长,免疫耐受状态减弱。如缩短雾化吸入和腹腔注射、滴眼之间的时间间隔,应当能减轻小鼠眼表体征和促炎因子表达水平。
皮下注射的抗原可被细胞外基质缓慢吸收入血,并显著延长注射抗原的Cmax持续时间。此外,间质淋巴管可直接将分子量>20×103Da的分子吸收,因此可直接进入淋巴系统[31]。Carton等[32]将主要组织相容性复合体(major histocompatibility complex,MHC)予以荧光标记后,将其与CD40结合可见大量DCs迅速移行至注射部位,且在二次注射时皮下淋巴结的中T细胞更易活化和增殖且记忆性T细胞可持续转移至附近淋巴结。因此,持续注入皮下的抗原几乎可完全被吸收而直接进入血液循环和淋巴循环,从而诱导出较稳定的免疫耐受状态。
由于结膜属于全身共有黏膜系统,其与呼吸道黏膜、消化道黏膜以及皮下黏膜组织具有相似的病理生理学机制,因此,某个部位的免疫状态改变将引发远端黏膜组织免疫状态的改变[33-35]。尽管黏膜共有免疫是复杂的全身性免疫反应,但该现象在临床中却十分常见。如在日常工作中,从“卫生假说”、免疫耐受及黏膜共有免疫的角度理解过敏性结膜炎,可能会为其预防和诊治提供新的思路和方式。本研究结果支持机体的免疫耐受状态可在结膜组织中得到反映,但不同部位的黏膜组织对于刺激的反应效能以及抗原的处理能力存在差异。
总之,本研究是以“卫生假说”为理论基础,即在生命早期阶段接触适量的宠物、蛋白类制品以及微生物对于机体的免疫调控发挥了保护性作用。目前针对过敏性结膜炎的治疗仍以脱离过敏源,抑制炎症反应为主,而较少关注生命早期环境对疾病的影响。因此,从“卫生假说”和免疫耐受的角度理解过敏性结膜炎的发生和发展,既有利于个人调整生活习惯以预防过敏性结膜炎,又可为过敏性结膜炎的公共预防和临床治疗提供新的思路。
猜你喜欢 结膜炎结膜周龄 新型冠状病毒感染相关蛋白ACE2和TMPRSS2在人结膜组织中的表达及意义中华实验眼科杂志(2022年8期)2022-09-07育成期饲粮代谢能水平对开产时如皋黄鸡生长发育的影响畜牧兽医学报(2022年7期)2022-08-05急性结膜炎患者如何护理?人人健康(2020年4期)2020-05-25眼睛痒并非都是慢性结膜炎文萃报·周二版(2020年15期)2020-04-30老泪纵横可能是结膜松驰症文萃报·周二版(2019年1期)2019-09-10你可能不知道,眼睛也会长结石!师道(2019年12期)2019-01-06用胫长和体重双重标准培育蛋鸡农家科技下旬刊(2017年7期)2017-08-22“817”小型肉4鸡不同组合杂交优势分析山东农业科学(2016年4期)2016-11-19褐壳蛋鸡农村百事通(2016年6期)2016-05-14漫谈结膜炎的治疗家庭用药(2009年1期)2009-02-03推荐访问:结膜炎 小鼠 耐受推荐文章