Herkinorin预处理减轻缺血性卒中模型大鼠脑损伤
来源:优秀文章 发布时间:2023-04-28 点击:
宋婉晴,李俊发,崔 旭*
1.首都医科大学附属北京同仁医院 麻醉科,北京 100730;
2.首都医科大学 神经生物学系,北京 100069
脑缺血/低氧损伤是缺血性卒中常见的病理生理过程,发病率、致死致残率高, 目前临床上仍缺乏有效的治疗方法[1]。缺血/低氧预处理(ischemic-hypoxia preconditioning,I/HPC)是指在短时间内给予机体亚致死性缺血/低氧刺激后,可显著提高机体对继发严重缺血/低氧事件耐受性的方法。
I/HPC可以用药物预处理促进内源性物质释放或作用于信号通路来模拟。Herkinorin作为半合成阿片受体激动剂,可通过调节短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion,tMCAO)致缺血性卒中小鼠脑皮层半影区内蛋白激酶C(protein kinase C,PKC)膜转位水平,来发挥脑保护作用[2-3]。早期研究显示,Herkinorin通过抑制NF-κB/NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)通路,减轻氧-糖剥夺(oxygen-glucose deprivation,OGD)神经元缺血损伤[4]。本研究拟在大鼠tMCAO模型上,进一步探讨Herkinorin对NLRP3的调节作用及其可能机制。
1.1 材料
1.1.1 实验动物:SPF级SD大鼠,体质量 200~220 g,雌雄各半 [南京大学动物模式中心提供,动物合格证号:SCXK(苏)2015-0001]。
1.1.2 实验试剂:Herkinorin、TTC染液(Sigma-Aldrich公司);
蛋白抽提试剂盒(Sangon公司);
PVDF膜(0.45 μm,Millipore公司);
TUNEL染色试剂盒、细胞凋亡试剂盒(南京凯基生物科技发展有限公司);
GAPDH抗体、IL-1β抗体、NLRP3抗体、p-p65抗体和p65抗体(Abcam公司);
β-抑制蛋白2(β-arrestin2)抗体、IκBα抗体、phos-IκBα抗体、Na-K ATPase抗体和caspase-1抗体(CST公司)。
1.2 方法
1.2.1 大鼠的分组及处理:采用随机数字表法,将大鼠分为假手术组(sham)、模型组(tMCAO)、Herkinorin组(Herkinorin),每组6只。模型(tMCAO)组及Herkinorin组大鼠进行造模处理-左侧大脑中动脉阻塞2 h后再灌注24 h。Herkinorin组大鼠造模前腹腔给药Herkinorin(10 mg/kg)1周,每天1次,缺血过程中给药1次,sham组及tMCAO组给予等体积1% DMSO。再灌注24 h后,对所有大鼠进行神经功能评分、TTC染色、TUNEL染色、Western blot检测和免疫共沉淀(co-immunoprecipitation,Co-IP)。
1.2.2 神经功能评分:评分标准:0分-神经功能正常;
1分-轻度神经功能缺损:提尾时,动物的左前肢屈曲;
2分-中度神经功能缺损:将动物置于光滑平面上行走,行走时向左侧转圈;
3分-中度神经缺损:静止状态下,向左侧倾斜;
4分-意识减退,肢体无自发活动;
5分-对刺激无应答或死亡。
1.2.3 TTC染色检测脑梗死百分比及脑水肿率:取大鼠全脑视交叉及其前后各2 mm处的脑组织,置于含有2% TTC的磷酸缓冲溶液中,37 ℃避光温孵10 min后取出脑片,用数码相机拍照,通过Image pro-plus 6.0计算梗死百分比如下:梗死百分比(%)=苍白区质量/(苍白区质量+非苍白区质量)×100%。将染色后的脑组织置于105 ℃烘箱烘干,24 h后称重(干重)。脑水肿率计算公式如下:脑组织含水量(%)=(1-脑组织干重/脑组织湿重)×100%;
脑水肿率(%)=[各组脑组织含水量(%)-sham组脑组织含水量(%)]/sham组脑组织含水量(%)×100%。
1.2.4 TUNEL染色检测细胞凋亡:取缺血半影区脑组织制成石蜡切片,置于电热恒温干燥箱中,60 ℃烘烤3 h,用TUNEL试剂盒检测细胞凋亡,按照说明书标记后用苏木精复染,用相差显微镜随机选择一个视野使用400×倍视野下拍照,细胞凋亡率(%)=TUNEL阳性细胞数/总细胞数×100%。
1.2.5 Western blot检测蛋白质表达: 取缺血半影区脑组织,制备全细胞蛋白质样品、定量、电泳和转膜后,分别加入一抗和二抗,用ECL发光显色。将PVDF膜放入数码凝胶图像分析仪进行曝光,所得图片采用Image J 件进行扫描。以GAPDH为内参蛋白,计算IκBα、p65、p-p65、pro-IL-1β、IL-1β、pro-caspase1、caspase1 p20、NLRP3的表达水平。
1.2.6 免疫共沉淀(co-immunoprecipitation,Co-IP)检测IκBα与β-arrestin2结合:取缺血半影区脑组织,Co-IP检测IκBα与β-arrestin2结合水平。
1.3 统计学分析
2.1 Herkinorin预处理改善缺血性卒中鼠神经功能评分
与sham组相比, tMCAO组大鼠神经功能评分显著增加(P<0.01);
而与tMCAO组相比,Herkinorin组大鼠神经功能评分明显下降(P<0.01)(图1D)。
2.2 Herkinorin预处理降低缺血性卒中鼠脑梗死百分比和脑水肿率
与sham组相比,tMCAO组大鼠脑梗死百分比与脑水肿率增加(P<0.01);
与tMCAO组相比,Herkinorin组大鼠脑梗死百分比与脑水肿率下降(P<0.01)(图1A~C)。
2.3 Herkinorin预处理降低缺血性卒中鼠脑细胞凋亡水平
与sham组相比,tMCAO组大鼠脑组织缺血半影区中的细胞凋亡水平增加(P<0.01);
与tMCAO组相比,Herkinorin组大鼠脑组织缺血半影区中的细胞凋亡水平下降(P<0.01)(图1E~F)。

A.TTC staining; B.brain infarct area percentage; C.cerebral edema rate; D neurological scores; E, F.TUNEL staining; *P<0.05 compared with sham group;
#P<0.05 compared with tMCAO group
2.4 Herkinorin预处理对缺血性卒中鼠脑半影区内IκBα、p65、p-p65、pro-IL-1β、IL-1β、pro-caspase1、caspase1 p20和NLRP3蛋白水平的影响
与sham组相比,tMCAO组大鼠脑组织缺血半影区内IκBα和p65蛋白水平下降(P<0.01,图2A~C);
p-p65(图2A,D)、IL-1β(图2A,E~F)、caspase1 p20(图2A,G~H)和NLRP3(图2A,I)蛋白水平增加(P<0.01)。与tMCAO组相比,Herkinorin组大鼠脑组织缺血半影区内IκBα和p65蛋白水平增加(P<0.01,图2A~C);
p-p65(图2A,D)、IL-1β(图2A,E~F)、caspase1 p20(图2A,G~H)和NLRP3(图2A,I)蛋白水平下降(P<0.01)。
2.5 Herkinorin预处理提高缺血性卒中鼠脑半影区内IκBα与β-arrestin2的结合水平
与sham组相比,tMCAO组大鼠脑缺血半影区内IκBα与β-arrestin2结合水平下降(P<0.01);
但与tMCAO组相比,Herkinorin预处理可提高鼠脑缺血半影区内IκBα与β-arrestin2的结合水平(P<0.01)(图2J)。
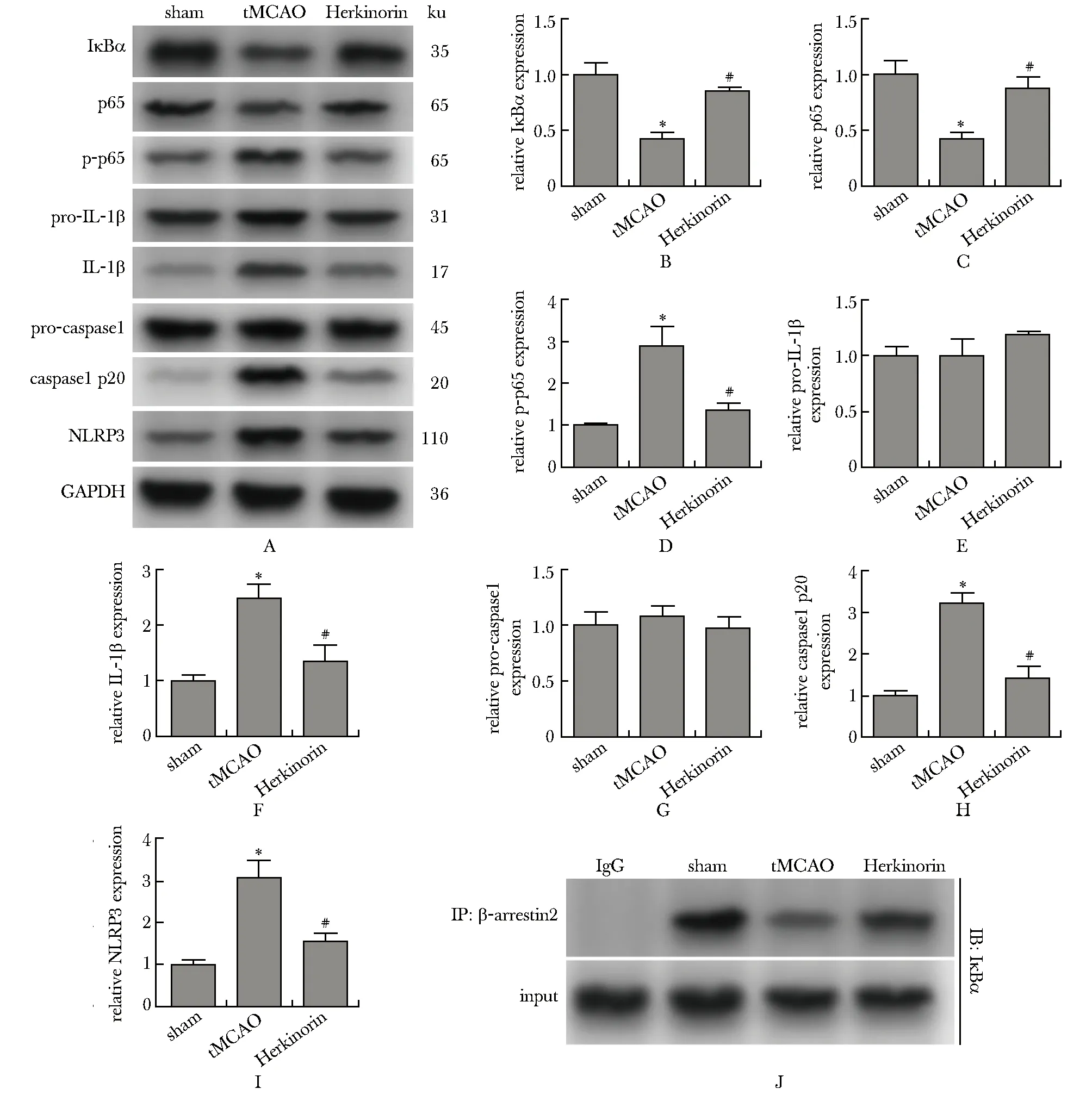
A, B.expression of IκBα; A, C.expression of p65; A, D.expression of p-p65; A, E.expression of pro-IL-1β; A, F.expression of IL-1β; A, G.expression of pro-caspase1; A, H.expression of caspase1 p20; A, I.expression of NLRP3; J.interaction of IκBα and β-arrestin2
Herkinorin是以salvinorin A为模板合成的阿片受体激动剂,其与β-arrestins亲和力低,在激动阿片受体的同时较少募集β-arrestins,不导致受体内化,这一特性使Herkinorin既具备传统阿片类药物的治疗作用,又大大减少了药物耐受、便秘、呼吸抑制等不良反应[2]。
NLRP3异常活化关系到多种疾病的发生发展。NLRP3的激活与卒中后神经细胞死亡及行为缺陷密切相关,抑制NLRP3激活可减轻神经元缺血/再灌注损伤[5-7]。
NF-κB通常以p50-p65异二聚体的形式与其抑制性蛋白IκBα结合而呈非活化状态,其通过复杂的分子调节机制参与机体的慢性炎性反应[8]。研究显示, 杨梅花青素通过TLR4/NF-κB信号通路抑制NLRP3激活,从而减轻脑缺血/再灌注损伤[9];
环境刺激通过抑制NF-κB信号通路降低NLRP1/NLRP3活性,从而减轻脑缺血/再灌注损伤[10]。
前期研究发现Herkinorin降低大鼠OGD神经元中caspase-1、IL-1β的活化程度及NLRP3的表达水平,而μ阿片受体(μ opioid receptor,MOR)抑制剂β-funaltrexamine可以逆转此作用。Herkinorin可明显抑制NF-κB通路的活化,降低p65的磷酸化水平,上调IκBα的表达,而MOR基因敲除后Herkinorin上述能力消失。这说明Herkinorin可能通过MOR途径降低OGD神经元中p65磷酸化水平,抑制NF-κB/NLRP3通路表达。而本研究在tMCAO大鼠中进一步验证了此作用机制。
阿片受体是G蛋白偶联受体(G protein-coupled receptors,GPCRs)。GPCRs激活后,细胞外信号通过两个信号通路传递到细胞内:G蛋白通路和β-arrestins通路。在G蛋白通路中, GPCRs活化后募集β-arrestins,β-arrestins促进GPCRs和G蛋白解偶联及受体内化,阻止下游效应因子激活,介导受体脱敏;
在β-arrestins通路中,β-arrestins与Src、Raf-I、Akt、ERKl/2、JNK3、Mdm2和IκBα等信号分子形成复合物,调控MAPK、P53、NF-κB信号通路[11-12]。前期研究发现,Herkinorin处理大鼠OGD神经元后,IκBα与β-arrestin2结合量增加,IκBα泛素化水平降低。而β-arrestin2基因敲除后,Herkinorin抑制NF-κB通路活化,降低p65磷酸化水平,上调IκBα表达,降低 IκBα泛素化的能力消失。这说明Herkinorin抑制NF-κB通路活化可能是通过增加β-arrestin2与IκBα结合、降低IκBα泛素化实现的。本研究也发现, Herkinorin可增加IκBα与β-arrestin2的结合,稳定IκBα并抑制NF-κB激活,这表明IκBα与β-arrestin2在Herkinorin对tMCAO大鼠的神经保护机制中发挥了重要作用。
综上所述,Herkinorin可能通过抑制NF-κB/NLRP3通路减轻tMCAO大鼠脑缺血/再灌注损伤,这可能是通过增加IκBα与β-arrestin2结合实现的。
猜你喜欢脑组织预处理缺血性缺血性二尖瓣反流的研究进展心肺血管病杂志(2019年9期)2019-12-09针灸在缺血性视神经病变应用中医眼耳鼻喉杂志(2019年3期)2019-04-13基于预处理MUSIC算法的分布式阵列DOA估计制导与引信(2017年3期)2017-11-02小脑组织压片快速制作在组织学实验教学中的应用中国组织化学与细胞化学杂志(2017年1期)2017-06-15芒果苷对自发性高血压大鼠脑组织炎症损伤的保护作用中成药(2017年6期)2017-06-13缺血性脑卒中恢复期的中蒙医康复治疗中国民族医药杂志(2016年5期)2016-05-09浅谈PLC在预处理生产线自动化改造中的应用工业设计(2016年11期)2016-04-16DNA双加氧酶TET2在老年痴呆动物模型脑组织中的表达及其对氧化应激中神经元的保护作用吉林大学学报(医学版)(2015年4期)2015-12-17络合萃取法预处理H酸废水环境科技(2015年6期)2015-11-08内皮祖细胞在缺血性脑卒中诊治中的研究进展医学研究杂志(2015年11期)2015-06-10推荐访问:缺血性 预处理 减轻推荐文章