胚系BRCA,1/2基因变异与乳腺癌患者临床特征的关系
来源:优秀文章 发布时间:2023-04-10 点击:
黄 斐 陈馨宁 郁 俐 姜惠琴 史庭燕 沈敏娜 张春燕,3△ 潘柏申,3 王蓓丽,3 郭 玮,3,4
(1复旦大学附属中山医院检验科,2妇瘤科 上海 200032;
3复旦大学附属中山医院厦门医院检验科 厦门 361015;
4复旦大学附属中山医院吴淞医院检验科 上海 200940)
DNA损伤是导致肿瘤的诱因之一,DNA双链断裂(DNA double-strand break,DSB)是最严重的损伤形式。在正常情况下,机体通过损伤修复通路来维持基因组的完整性和稳定性,其中同源重组(homologous recombination,HR)是DSB的主要修复方式。乳腺癌易感基因1(breast cancer gene 1,BRCA1)和乳腺癌易感基因2(breast cancer gene 2,BRCA2)是参与HR的重要基因。BRCA1/2基因变异会造成蛋白功能缺陷,导致基因组不稳定。携带胚系BRCA1/2基因变异(germlineBRCA1/2 mutations,gBRCAm)的个体终生罹患乳腺癌的风险显著增加[1-2]。同时携带gBRCAm的乳腺癌患者对聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂更敏感[3-5]。携带gBRCAm的乳腺癌患者预后较差,无进展生存期和总生存期均低于未携带变异患者[6]。美国国家综合癌症网络指南建议对乳腺癌患者进行常规gBRCAm检测[2,7-8]。
BRCA1/2基因变异位点和类型较多,随机分布于整条基因序列,无明确热点。目前,多采用二代测序(next-generation sequencing,NGS)和多重连接依赖性探针扩增技术(multiplex ligationdependent probe amplification,MLPA)检测gBRCAm。BRCA1/2基因变异存在地域、种族和癌种的异质性,因此研究乳腺癌患者的BRCA1/2基因变异谱对风险评估、诊疗管理具有重要的意义。本文采用NGS检测146例未经筛选的乳腺癌患者的gBRCAm,分析乳腺癌gBRCAm类型和分布情况,并探讨其与临床特征的关系。
研究对象选取2019年6月至2021年4月于复旦大学附属中山医院就诊的146例乳腺癌患者。入组标准:经活检或手术病理确诊为乳腺癌。排除标准:(1)合并其他原发肿瘤;
(2)转移乳腺癌;
(3)伴有其他全身性严重疾病的患者。其中男性患者2例,女性患者144例,中位年龄为(53.7±13.3)岁。本研究获得复旦大学附属中山医院伦理委员会批准(批件号:B2021-056),且获得患者知情同意。
胚系BRCA 1/2基因变异检测采集146例患者EDTA-K2抗凝全血,采集到的2 mL全血按血液DNA核酸提取试剂盒(厦门艾德生物医药股份有限公司)说明书流程提取基因组DNA。采用Qubit dsDNA HS试剂(美国ThermoFisher公司)检测DNA浓度,保证投入量为50 ng。根据BRCA1/2基因突变检测试剂盒(厦门艾德生物医药股份有限公司)要求建库。采用Qubit dsDNA HS和DNA 1000试剂(美国Agilent公司)对文库质检,要求浓度>0.5 ng/μL,片段分布在260~400 bp,无明显引物二聚体及杂峰。使用Miseq Dx和Miseq V2芯片测序(美国Illumina公司)。采用艾德“人类1/2基因高通量测序数据分析软件”(v1.1.4)ADXHS-gBRCACNV模块分析测序数据,获得gBRCAm预分类结果。所有样本满足平均有效测序深度>300,测序质量>75%,比对率85%,覆盖度100%。本检测包括BRCA1基因(NM_007294.3)外显子2、3、5~24以及BRCA2基因(NM_000059.3)外显子2~27及外显子-内含子连接区、UTR区(非翻译区)和启动子区的点突变和插入缺失突变。根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)遗传解读原则,基于人群数据、计算数据、功能数据、共分离数据等证据将变异分为5类,包括良性、疑似良性、意义不明确、疑似致病和致病变异,本文提及的gBRCAm为疑似致病和致病变异。对检出的疑似致病或致病变异进行一代测序验证。采用MLPA对分析软件输出的大片段重排(large rearrangement,LR)进行验证。
临床资料收集乳腺癌患者一般临床资料和组织病理资料,包括发病年龄、确诊时肿瘤发生部位、前哨和腋窝淋巴结状态、组织学分级、雌激素受体(estrogen receptor,ER)、孕酮受体(progesterone receptor,PR)和 人 表 皮 生 长 因 子 受 体-2(human epidermal growth factor receptor-2,HER-2)。
统计学方法数据分析采用SPSS 23.0软件。计数资料以率表示。采用χ2检验和Fisher精确检验比较gBRCAm在乳腺癌中的分布,探讨其与临床特征的关系。所有均为双侧检验,以P<0.05为差异有统计学意义。
胚系BRCA 1/2基因变异在乳腺癌中的分布在146例乳腺癌患者中,检出18例患者携带gBRCAm,人群变异频率为12.3%,其中8例发生BRCA1基 因 变 异,10例 发 生BRCA2基 因 变 异。在癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中乳腺癌患者携带gBRCAm频率为5.3%[9]。本研究中乳腺癌患者携带gBRCAm的频率显著高于TCGA数据库报道(P=0.023),且携带BRCA1和2基因变异频率分别为5.5%和6.9%,分布无明显偏向(图1)。

图1 不同研究中乳腺癌患者携带gBRCAm的频率Fig 1 Prevalence of gBRCAm from patients with breast cancer in different studies
胚系BRCA 1/2基因变异分布和类型特征94.4%(17/18)的变异发生于外显子,仅5.6%(1/18)的变异发生于内含子剪接区。16.7%(3/18)的肿瘤患者携带的变异发生于BRCA1基因的外显子11,38.9%(7/18)的肿瘤患者携带的变异发生于BRCA2基因的外显子11,乳腺癌患者携带的变异多见于BRCA2基因的外显子11。在检出的18个不同变异中,移码突变是最主要的变异类型(61.1%),无义突变、大片段重排和剪接突变比例分别为16.7%、11.1%和5.5%,检出1例(5.5%)同义突变(图2A)。BRCA1基因中检出5种不同类型的变异,而BRCA2基因中仅检出3种不同类型的变异(图2B)。在BRCA1和BRCA 2基因上各检出1例LR携带者,均为大片段缺失。在检出的变异中,乳腺癌患者携带BRCA2基因c.5682C>G的频率最高,但未发现热点或潜在始祖突变,其中NM_000059.3:c.6043_6055del13C为新发现变异,未见其他文献和ClinVar数据库(http://www.ncbi.nlm.nih.gov/clinvar)报道。变异在蛋白功能和结合域的分布如图3A和3B所示,大部分变异发生于BRCA 1和BRCA 2蛋白的重要功能区和结构域上。
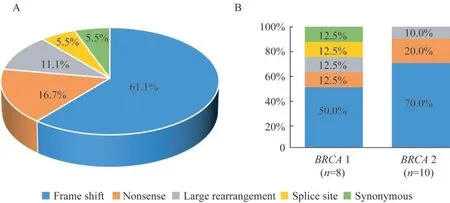
图2 乳腺癌患者胚系BRCA 1/2基因变异类型和分布Fig 2 Variation type and distribution of gBRCAm in breast cancer patients
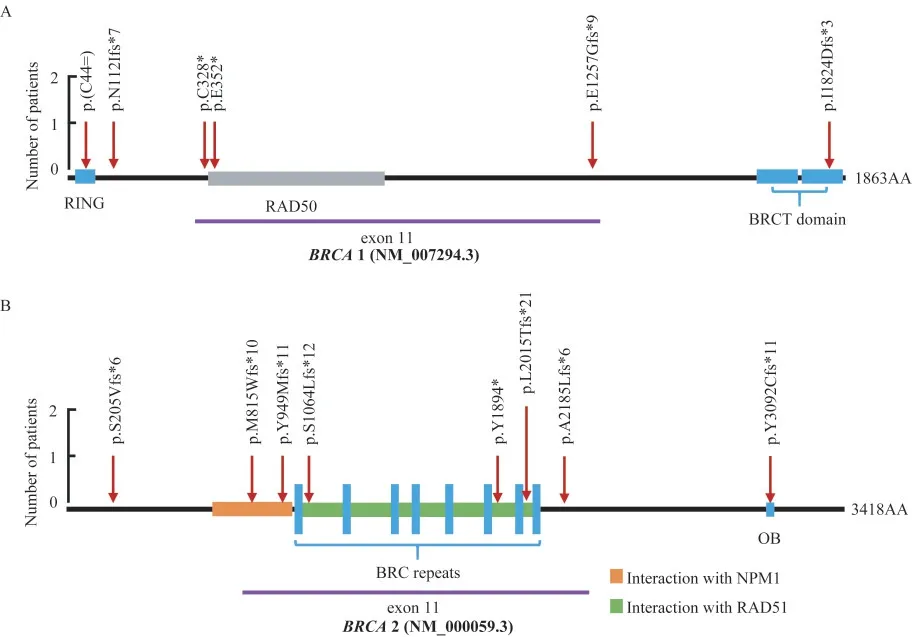
图3 胚系BRCA 1/2基因变异在蛋白功能和结合域的分布Fig 3 Distributions of gBRCAm in functional domains and protein binding regions
胚系BRCA 1/2基因变异与乳腺癌临床和病理特征的关系146例乳腺癌患者中,收集到94例患者的一般临床资料和组织病理资料。在不同乳腺癌人群中胚系BRCA1/2基因变异情况存在差异,胚系BRCA1/2基因变异多见于早发乳腺癌(P<0.001)、肿瘤家族史(P=0.008)、双侧乳腺癌(P=0.001)和三阴型乳腺癌(P=0.025),且BRCA1基因变异与三阴型乳腺癌发生密切相关(P=0.007,表1)。进一步分析发现胚系BRCA1/2基因变异与肿瘤分级(P=0.031)、PR状态(P=0.040)和HER2状态(P=0.039)相关,但与前哨和腋窝淋巴结转移(P=0.048和0.085)和ER状态(P=0.260)无关(表2)。在ER和PR阳性组中,携带BRCA2基因变异的乳腺癌患者显著多于携带BRCA1基因变异的患者(P=0.041和P=0.026)。BRCA1基因变异携带患者中,三阴型和Luminal B型分别为75%和25%,而BRCA2基因变异携带患者中,57.1%为Luminal B型,28.6%为Luminal A型,14.3%为HER2表达型。
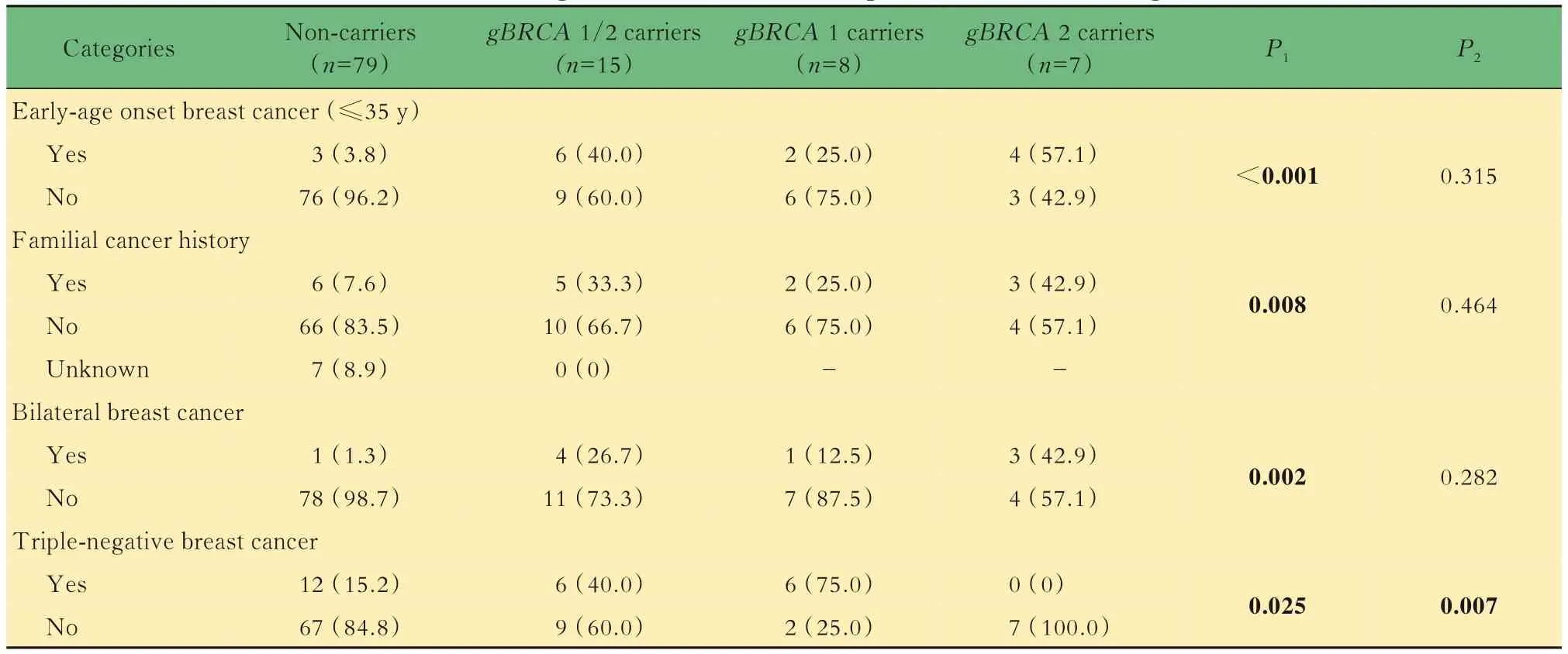
表1 不同乳腺癌人群中胚系BRCA 1/2基因变异情况Tab 1 Status of gBRCAm in breast cancer patients in different categories [n(%)]

表2 乳腺癌患者胚系BRCA 1/2基因变异与肿瘤病理特征的关系Tab 2 Associations of clinicopathological characteristics with gBRCAm in breast cancer patients [n(%)]
BRCA1/2基因属于抑癌基因,其编码蛋白参与DNA损伤修复、基因转录调控和细胞周期调节等多种细胞生命活动过程。基因功能缺陷会增加乳腺癌的发生风险。目前国内有多项针对乳腺癌患者BRCA1/2基因变异的研究,但不同研究中的BRCA1/2基因变异特征以及其与临床特征间的关系存在一定差异[10-15],这与入组患者的疾病背景差异有关,因此本中心希望通过区域性数据的积累和研究,建立区域化的BRCA1/2基因变异特征数据库。本研究采用NGS检测146例未经筛选的乳腺癌患者gBRCAm,分析乳腺癌gBRCAm类型和分布情况,研究其与临床特征的关系,为患者的精准诊疗积累相关人群数据。
本研究中乳腺癌患者携带gBRCAm频率为12.3%,高于数据库报道和其他国内未经筛选的乳腺癌人群[10-13]。94.4%变异发生于外显子区域,移码变异、无义变异和大片段重排是最常见的致病和疑似致病的变异类型。检出的大部分变异处于BRCA 1和BRCA 2蛋白的重要功能区和结构域。BRCA 1蛋白由N末端RING区(外显子2~7)、多蛋白结合点和功能区(外显子11~13)和C末端BRCT区(外显子16~24)[16]。本研究中16.7%变异发生于BRCA1基因的外显子11,该区域发生的变异可能影响BRCA 1蛋白参与DNA修复、细胞周期或核定位的功能,与早发乳腺癌和卵巢癌相关[14]。BRCA 2蛋白由DNA结合区、3个寡核苷酸结合区、塔 区、8个BRC重 复 区、N末 端PALB 2结 合 区 和C末 端RAD 51结 合 区 构 成[16]。38.9%变 异 发 生 于BRCA2基因的外显子11,该区域发生的变异可能影响同源重组过程中其与RAD 51蛋白的相互作用[14]。研究显示BRCA1基因发生LR多于BRCA2基因[17],而本研究中在BRCA1基因和BRCA2基因各发生了1例LR,由于入组患者人数少未发现这种偏向。BRCA1基因发生LR多于BRCA2基因的主要原因在于Alu介导的HR是导致LR的主要机制,且BRCA1基因中Alu密度高于BRCA2基因[18-19]。女性罹患乳腺癌的风险随BRCA1/2基因变异类型、发生位置改变而改变[20]。
本研究中40%携带gBRCAm的乳腺癌患者确诊的平均年龄在35岁以下,低于未携带变异患者。低分化级别乳腺癌、三阴型乳腺癌和双侧乳腺癌患者多携带gBRCAm,在不同淋巴结状态的患者中差异 无 统 计 学 意 义,与 其 他 研 究 报 道 一 致[10,15]。BRCA1基因变异在三阴型乳腺癌的比例高达33.3%;
激素受体表达在携带gBRCAm的乳腺癌中差异较大。研究报道,BRCA1基因抑制ER在乳腺癌和前列腺癌细胞中的表达[21],因此本研究中BRCA1基因变异倾向于ER、PR阴性表达,而BRCA2基因变异倾向于ER、PR阳性表达,而HER-2在亚组分析中倾向于阴性表达。
综上,本研究通过NGS检测中国区域性人群未经筛选的乳腺癌患者gBRCAm特征,研究gBRCAm与乳腺癌临床特征的关系。本研究纳入乳腺癌患者例数较少,gBRCAm组和不同突变亚组的例数较少,可能造成研究结果的偏倚;
本研究为单中心研究,无法全面勾勒中国人群gBRCAm,仅能作为区域性特征的研究,因此需要多中心研究积累中国人群数据库。我们正在不断累积乳腺癌患者gBRCAm的数据,深入研究不同癌肿的变异图谱,并联合患者不同治疗方式进行全面分析,以期为肿瘤患者个体精准诊疗和癌症风险评估等奠定基础。
作者贡献声明黄斐样本检测,数据统计,论文构思、撰写和修订。陈馨宁,郁俐样本检测。姜惠琴,史庭燕患者入组,临床资料收集。沈敏娜样本收集。潘柏申,王蓓丽,郭玮研究指导。张春燕实验设计,论文修改和指导。
利益冲突声明所有作者均声明不存在利益冲突。
猜你喜欢外显子变异测序外显子跳跃模式中组蛋白修饰的组合模式分析电子科技大学学报(2022年5期)2022-10-29外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2020年4期)2021-01-18变异危机趣味(数学)(2020年4期)2020-07-27变异支部建设(2020年15期)2020-07-08中草药DNA条形码高通量基因测序一体机验收会在京召开中国现代中药(2019年5期)2019-07-03基因测序技术研究进展科海故事博览·下旬刊(2019年6期)2019-04-16外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2018年4期)2018-11-06变异的蚊子百科知识(2015年18期)2015-09-10人类组成型和可变外显子的密码子偏性及聚类分析湖北农业科学(2014年11期)2014-09-10形的变异与的主题雕塑(1996年4期)1996-07-12推荐访问:乳腺癌 变异 基因