甲磺酸阿帕替尼对人乳腺癌紫杉醇耐药性的逆转作用
来源:优秀文章 发布时间:2023-03-10 点击:
曾会会,余小婷,胡婷,王娟,汪婷婷,郑荣生
(蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233004)
乳腺癌是威胁女性生命健康最常见的恶性肿瘤,成为2020年全球癌症发病率的主要原因,也是全球第五大癌症死亡原因[1]。化疗在乳腺癌综合治疗中占有极其重要的地位,紫杉醇作为乳腺癌化学治疗中的一线药物广泛应用临床,但紫杉醇耐药问题已经成为乳腺癌患者治疗的主要挑战。因此,深入探究乳腺癌紫杉醇耐药的机制,寻找低毒有效的逆转紫杉醇耐药的药物,提高转移性乳腺癌生存期具有重要意义。
紫杉醇来源于红豆杉科植物中获取的天然物质,通过阻止微管蛋白重聚合而起到抗肿瘤作用的。然而,紫杉醇在乳腺癌治疗过程中诱导肿瘤细胞发生突变、旁路信号通路的激活等多途径共同作用产生耐药性[2]。根据目前研究发现,三磷酸腺苷结合盒转运体(ATP binding cassette transporter,ABC )的过度表达、β-微管蛋白结合区和微管蛋白突变的改变、凋亡蛋白(如Bcl2和P53)的功能降低、以及细胞因子表达的改变与紫杉醇耐药性有关[3]。最新研究表明酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)与肿瘤细胞的多药耐药(multi drug resistant,MDR)表型相互作用,显著抑制P-gp活性,增加多药耐药肿瘤细胞对化疗的敏感性[4]。甲磺酸阿帕替尼是我国自主研制的一种小分子TKI,高度选择性竞争血管内皮细胞生长因子受体-2(vascular endothelial growth factor receptor,VEGFR-2)的ATP结合位点,阻断下游信号传导,从而抑制肿瘤血管的生成。阿帕替尼目前批准用于晚期胃腺癌患者,但在肝癌[5]、非小细胞肺癌[6]、食管癌[7]、乳腺癌[8]等临床研究中也获得一定的疗效。阿帕替尼在逆转多药耐药、抑制肿瘤血管、增强化疗和放射治疗疗效等方面具有显著的优势[9]。本研究探索阿帕替尼逆转乳腺癌紫杉醇的耐药性及可能机制,从而为解决临床乳腺癌紫杉醇耐药提供新的思路。
1.1 细胞株、主要试剂及仪器
MCF-7人乳腺癌细胞株由蚌埠医学院中心实验室保存,MCF-7/Taxol细胞株由本实验室构建。紫杉醇注射液及阿帕替尼购自北京索莱宝科技有限公司,CKK-8试剂盒购自翌圣生物科技股份有限公司;
Annexin V-FITC/PI双染细胞凋亡及细胞周期检测试剂盒购自兰杰柯科技有限公司;
山羊抗兔IgG-HRP购自天津三箭生物技术股份有限公司;
E-Cadherin、N-Cadherin抗体购自北京博奥森生物技术有限公司;
P-gp、BCRP抗体购自美国Abcam公司。流式细胞仪购自美国BD公司;
酶标仪购自上海闪谱公司。
1.2 细胞培养条件
MCF-7细胞使用RPMI1640培养基,在37 ℃、5% CO2饱和湿度的培养箱中无菌培养。细胞传代用含0.25%胰蛋白酶进行消化。
1.3 构建人乳腺癌MCF-7/Taxol细胞株
采用低浓度加量持续诱导法诱导MCF-7细胞[10]。复苏MCF-7细胞,常规条件下培养2~3代。紫杉醇对亲本细胞MCF-7的半数抑制浓度(half-inhibitory concentration IC50)的0.1作为起始浓度,待每个紫杉醇浓度处理细胞稳定生长后再逐步提高药物浓度,CCK-8法检测紫杉醇对耐药株细胞的IC50,计算耐药指数(resistance factor RF),RF=IC50(MCF-7/Taxol)/IC50(MCF-7)。成功构建耐药细胞,停药2个月,细胞稳定成长,委托上海轩玮生物科技服务中心给予MCF-7/Taxol细胞进行STR鉴定。
1.4 CCK-8法检测紫杉醇对MCF-7及MCF-7/Taxol细胞的毒性
收集对数生长期的亲本MCF-7及MCF-7/Taxol细胞接种于96孔板,稀释细胞至数量为1×104~1×105个/毫升左右,每孔加入100 μL细胞混悬液,待细胞贴壁24 h后吸去上清液,分为3组,实验组在每孔中加入含有不同浓度的紫杉醇培养液,对照组加入不含药物的培养液;
空白组是不含细胞和药物的培养液。每组设3个平行孔。继续培养48 h后,每孔加入10 μL CCK-8试剂溶液,37 ℃孵育2 h。在多功能酶标仪450 nm波长处测量各个孔吸光值(OD值)。计算各组细胞抑制率(inhibitory concentration IR),IR=1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。实验重复3次,Graphpad prism 9软件计算各组细胞IC50。
1.5 CCK-8法检测阿帕替尼对MCF-7/Taxol细胞的毒性及耐药逆转作用
分别加入2.5、5、10、20、40、80 μmol/L阿帕替尼加入亲本MCF-7细胞;
2.5、5、10、20、40、80、160、320 μmol/L加入MCF-7/Taxol耐药细胞株。计算各组细胞IR,选取阿帕替尼一高一低2个逆转浓度联合紫杉醇,计算联合阿帕替尼前后紫杉醇对MCF-7/Taxol细胞IC50的变化。
1.6 流式细胞术检测细胞凋亡率
利用Annexin V-FITC/PI双染法检测MCF-7/Taxol各组细胞凋亡率的变化。实验分4组,空白对照组(A组),紫杉醇无毒剂量组(B组),阿帕替尼低毒浓度剂量组(C组),紫杉醇无毒剂量联合阿帕替尼低毒浓度剂量组(D组)处理MCF-7/Taxol细胞48 h后,分别收集各组细胞,加入适量不含EDTA的胰酶消化细胞。用PBS洗涤细胞3次后收集细胞,按照细胞凋亡检测试剂盒说明书,取100 μL的重悬细胞中加入5 μL Annexin V-FITC轻轻混均,室温避光孵育10 min,上机前5 min加入10 μL碘化丙啶混匀,再加入400 μL PBS重悬细胞上机。导出实验数据后用FlowJo软件分析各组细胞的凋亡率,实验重复3次。
1.7 流式细胞术检测细胞周期分布
实验分组同细胞凋亡检测分组一致,收集各组的细胞沉淀,弃上清液,按照细胞周期检测试剂盒说明书,用预冷PBS洗涤2次,加入25 μL碘化丙啶染色液和10 μL RNaseA,混合均匀。再加入0.5 mL碘化丙啶染色液,轻轻混合重悬细胞沉淀,37 ℃避光孵育30 min上机,应用Modfit软件分析各组细胞周期分布变化情况。
1.8 Western Blot检测MCF-7/Taxol细胞内相关蛋白的变化
实验分组同细胞凋亡检测分组一致,处理MCF-7/Taxol细胞48 h后,用预冷的PBS洗3次,尽量吸干残液后加入含有PMSF的细胞裂解液150 μL,低温裂解10 min后,将液体转移到1.5 mL EP管中,加入5×Loading buffer(按4∶1的比例),100 ℃煮沸10 min。上样进行SDS-PAGE胶制作,通过电泳,转膜至PVDF膜上,将膜浸在封闭液中37 ℃封闭;
将膜取出直接放入一抗E-Cadherin(1∶1000稀释)、N-Cadherin(1∶1000稀释)、P-gp(1∶2000稀释)、BCRP(1∶1000稀释)、β-actin(1∶1000稀释),4 ℃过夜;
PBST洗膜,每次5 min,洗4次;
将膜转入HRP标记的山羊抗兔IgG二抗(1∶20 000稀释)中,37 ℃孵育40 min;
PBST洗膜,每次5 min,洗5次;
用化学发光法(ECL)显影,实验重复3次。
1.9 统计学方法
采用SPASS 22.0软件进行统计学分析,计量资料呈正态分布,以均数±标准差表示,组间比较采用ANOVA方法单因素方差分析,以P<0.05为差异具有统计学意义。
2.1 构建MCF-7/Taxol细胞株及耐药指数的测定
通过不断增加紫杉醇浓度,成功构建MCF-7/Taxol细胞株,该细胞株可以在600 nmol/L紫杉醇浓度中稳定生长,其RF=88。撤药2个月后,MCF-7/Taxol细胞进行STR分型结果显示来源于MCF-7细胞系,不存在交叉污染现象。紫杉醇作用于MCF-7/Taxol的IC50=(659.9±22.27)nmol/L,见图1A;
对同步传代的MCF-7细胞的IC50=(17.81±2.27)nmol/L,见图1B。RF=37,表明MCF-7/Taxol细胞株具有耐药性。根据实验结果选取100 nmol/L作为紫杉醇无毒剂量浓度。

图1 不同浓度紫杉醇作用于MCF-7/Taxol及MCF-7的细胞增殖抑制率
2.2 阿帕替尼对MCF-7及MCF-7/Taxol细胞毒性的影响
将不同浓度的阿帕替尼作用于MCF-7和MCF-7/Taxol细胞株,CCK-8实验结果分析阿帕替尼对MCF-7细胞的IC50=(20.83±0.41)μmol/L,见图2A,MCF-7/Taxol细胞的IC50=(35.06±0.94)μmol/L,见图2B;
根据结果数据显示阿帕替尼对MCF-7/Taxol不具有耐药性。

图2 不同浓度阿帕替尼作用于MCF-7及MCF-7/Taxol的细胞增殖抑制率
2.3 阿帕替尼对MCF/Taxol细胞逆转的影响
选取对耐药株细胞抑制小于10%的浓度作为逆转剂在体外实验中的联用浓度。选取阿帕替尼2.5 μmol/L和5 μmol/L作为逆转剂量,与不同浓度的紫杉醇联用,其MCF-7/Taxol分别为IC50=(344.7±9.32)nmol/L见图3A、IC50=(174.1±6.11)nmol/L见图3B,逆转倍数分别是1.9倍和3.7倍。实验结果表明阿帕替尼作用于MCF-7/Taxol细胞株具有逆转耐药作用,并且5 μmol/L比2.5 μmol/L逆转作用明显增加,后续实验选取5 μmol/L的阿帕替尼作为低浓度逆转剂量。

图3 不同浓度阿帕替尼作用于MCF-7/Taxol细胞增殖抑制率
2.4 阿帕替尼对MCF-7/Taxol细胞凋亡的影响
本实验分为4组,A组未加任何药物的空白对照组;
B组加入100 nmol/L紫杉醇;
C组加入5 μmol/L阿帕替尼;
D组加入100 nmol/L紫杉醇联合5 μmol/L阿帕替尼。各组药物作用于MCF-7/Taxol细胞48 h后,流式细胞术分析其结果,见图4。阿帕替尼联合紫杉醇组细胞总凋亡率为(20.42±1.17)%,与空白对照组(10.17±0.05)%、紫杉醇组(12.4±0.07)%、阿帕替尼组的细胞凋亡率(13.98±0.25)%比较,细胞凋亡率升高;
紫杉醇组,阿帕替尼组及联合组进行两两比较,细胞凋亡率均有升高(P<0.05),见图5。

A:空白对照组;
B:紫杉醇组;
C:阿帕替尼组;
D:紫杉醇联合阿帕替尼组

对比空白对照组aP<0.05;
对比紫杉醇组bP<0.05;
对比阿帕替尼组cP<0.05
2.5 阿帕替尼对MCF-7/Taxol细胞周期的影响
各组细胞周期分布的变化见图6。与空白对照组比较,紫杉醇组、阿帕替尼组、阿帕替尼联合紫杉醇组G0/G1期分布减少,其差异具有统计学有差异(P<0.05);
与空白对照组比较,紫杉醇组、阿帕替尼联合紫杉醇组G2/M期分布增加(P<0.05),阿帕替尼组G2/M期差异不明显(P>0.05);
与紫杉醇组、阿帕替尼组G2/M期比较,阿帕替尼联合紫杉醇组G2/M期增加(P<0.05),见图7。

A:空白对照组;
B:紫杉醇组;
C:阿帕替尼组;
D:紫杉醇联合阿帕替尼组
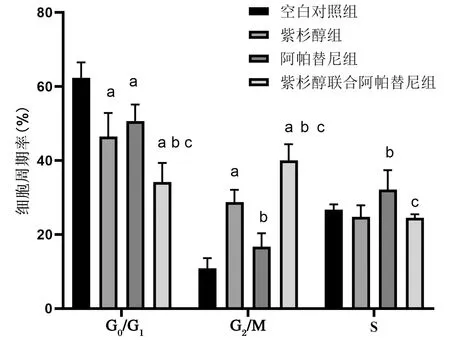
对比空白对照组aP<0.05;
对比紫杉醇组bP<0.05;
对比阿帕替尼组cP<0.05
2.6 阿帕替尼对MCF-7/Taxol细胞内相关蛋白的影响
Western Blot实验结果显示,阿帕替尼联合紫杉醇组作用MCF-7/Taxol细胞48 h后,与空白对照组、紫杉醇组、阿帕替尼组比较,P-gp蛋白和BCRP蛋白表达变化不明显(P>0.05)。进一步探究阿帕替尼逆转紫杉醇耐药是否与上皮间质转化有关。阿帕替尼联合紫杉醇处理MCF-7/Taxol细胞48 h后,与空白对照组、紫杉醇组、阿帕替尼组比较,MCF-7/Taxol细胞内E-cadherin蛋白和N-cadherin蛋白变化不明显(P>0.05),见图8。
紫杉醇是乳腺癌治疗最常见的化疗药物,但紫杉醇耐药是复发转移性乳腺癌治疗的主要障碍。ABC转运体的过度表达是导致紫杉醇耐药最常见机制之一,其中P-gp、BCRP蛋白是ABC转运蛋白中常见的耐药蛋白,通过将多种化疗药物直接排出肿瘤细胞体外产生耐药性[11]。因此,ABC转运蛋白小分子抑制剂是克服传统抗肿瘤药物耐药的一种新的策略。国外学者研究表明TKI药物(如波齐替尼、拉帕替尼)具有抑制P-gp外排功能,逆转卵巢癌多药耐药[12]。阿帕替尼与其他小分子TKI相比具有更高的抑制血管生成活性,通过抑制膜结合的ABC转运蛋白的外排功能来逆转多药耐药[13]。但阿帕替尼是否逆转乳腺癌紫杉醇耐药及机制研究报道少见。
阿帕替尼是一种小分子TKI,临床研究数据[14]显示晚期乳腺癌患者可从小剂量阿帕替尼治疗中获益。基础实验[15]证明阿帕替尼具有抑制乳腺癌MCF-7细胞增殖并诱导其凋亡的能力。最近研究[16]表明阿帕替尼联合白蛋白紫杉醇协同诱导乳腺癌细胞凋亡。根据CCK-8实验结果显示低毒浓度的阿帕替尼联合紫杉醇药物处理MCF-7/Taxol细胞株后,紫杉醇的IC50值下降,表明阿帕替尼具有逆转紫杉醇耐药的作用。流式细胞术结果提示阿帕替尼促进MCF-7/Taxol耐药株的凋亡,联合紫杉醇增加耐药株细胞的凋亡率。阿帕替尼不影响MCF-7/Taxol细胞周期变化,但联合紫杉醇药物增加MCF-7/Taxol细胞G2/M期分布。本实验结果表明阿帕替尼和紫杉醇的联合治疗具有协同作用,通过调节MCF-7/Taxol耐药株细胞凋亡和周期变化,一定程度上增加了紫杉醇对耐药株细胞抗肿瘤作用的敏感性。
逆转多药耐药的方式[17]不仅通过抑制ABC转运体的外排功能,也通过下调ABC转运体的表达来完成。本实验通过Western Blot实验验证低毒浓度的阿帕替尼对MCF-7/Taxol细胞外排性转运体P-gp和BCRP蛋白表达的影响,结果提示阿帕替尼不是通过下调紫杉醇耐药株细胞中 P-gp和BCRP蛋白的表达来逆转耐药。张圣村等学者表明[18]阿帕替尼可能是一种P-gp底物竞争性抑制剂,可能通过与紫杉醇竞争性结合ABC转运蛋白的ATP催化位点,抑制紫杉醇药物外流,诱导多药耐药逆转,从而增加化疗敏感性。上皮-间充质转化(epithelial-mesenchymal transformation,EMT)是肿瘤细胞从上皮样转化为间充质样表型或部分间充质表型,对肿瘤细胞迁移、侵袭和化疗的耐药性方面具有潜在的作用[19]。国内学者研究表明EMT在乳腺癌紫杉醇耐药机制中发挥重要作用,MCF-7/Taxol细胞发生EMT且具有较强的耐药和侵袭转移能力[20]。本研究结果发现阿帕替尼作用于MCF-7/Taxol细胞,EMT相关蛋白E-cadherin蛋白和N-cadherin蛋白变化不明显,显示阿帕替尼逆转紫杉醇乳腺癌耐药的发生与上皮间质转化过程可能不相关。
综上所述,本研究结果证明阿帕替尼具有逆转紫杉醇耐药的作用,通过联合紫杉醇药物促进 MCF-7/Taxol耐药株的凋亡和细胞周期分布于G2/M期,增强紫杉醇药物敏感性,是一种有潜力的逆转多药耐药药物。但是阿帕替尼逆转乳腺癌紫杉醇耐药的机制仍需进一步的研究验证,为今后临床应用提供更充分的实验依据。
猜你喜欢 阿帕替尼阿帕细胞株 阿帕替尼联合化疗治疗晚期非小细胞肺癌临床疗效与安全性系统评价中国药学药品知识仓库(2022年10期)2022-05-29甲磺酸阿帕替尼对结肠癌HCT-116细胞增殖、凋亡及PI3K/Akt信号通路的影响河北医药(2020年2期)2020-03-13斑蝥素酸镁对人肝癌细胞株SMMC-721转录组的影响中成药(2018年3期)2018-05-07阿帕替尼联合紫杉醇治疗晚期化疗耐药HER—2阴性胃癌的临床效果评价中外医疗(2017年35期)2018-03-07阿帕替尼联合FOLFOX化疗方案治疗晚期胃癌的疗效观察中国实用医药(2017年28期)2017-10-19阿帕替尼联合替吉奥二线治疗晚期胃癌的临床观察中国当代医药(2017年23期)2017-09-20贝伐珠单抗联合阿帕替尼治疗结直肠癌的疗效分析中国实用医药(2017年12期)2017-06-06稳定敲低MYH10基因细胞株的建立医学研究杂志(2015年11期)2015-06-10Rab27A和Rab27B在4种不同人肝癌细胞株中的表达中国当代医药(2015年16期)2015-03-01稳定抑制PAK2蛋白表达的HUH—7细胞株的建立中国医药导报(2015年27期)2015-02-28推荐访问:紫杉醇 耐药性 乳腺癌