尿酸酶缺失大鼠的血细胞和血液流变学变化*
来源:优秀文章 发布时间:2023-02-11 点击:
万绪莲,李律宇,李 丹,罗光云,李 宁,云 宇,段为钢△
(1.云南中医药大学,云南 昆明,650500;
2.云南中医药大学第三附属医院,云南 昆明 650500;
3.昆明医科大学,云南 昆明 650500)
高尿酸血症已经成了危害人类健康的“第四高”[1],与痛风、高血压、糖尿病等疾病高度关联[2-3]。为了研究高尿酸血症的发病机制以及相关疾病的防治新策略,我们前期以SD大鼠为试验大鼠,采用CRISPR/Cas9技术成功研制了尿酸酶缺失大鼠(Kunming-DY大鼠)[4]。该大鼠血尿酸明显升高,与成年男性血尿酸相似或略高,可以稳定繁殖,成年后的1年生存率可达90%[4-5],尽管具有轻度的多器官损伤[6]。由于该大鼠无尿酸酶活性,其尿酸代谢与人进一步相似,可以避免造模剂带来的干扰,有望为高尿酸血症和相关疾病的防治研究提供更好的模型动物[5],同时该模型动物在研究高尿酸血症方面表现出一定的优势[7-9]。为此,本研究以45 d日龄SD大鼠为对照,特观察同龄尿酸酶缺失大鼠血细胞和血液流变学变化。
1.1 实验材料与仪器 雄性尿酸酶缺失大鼠(Kunming-DY大鼠)由实验室自制,按照SFP标准繁育。雄性SD大鼠(生产许可证号:SCXK(滇)K2015-0002)由昆明医科大学按照SPF标准繁育。尿酸检测试剂盒(磷钨酸法)(南京建成生物工程研究所)、氨丁三醇(Tris碱,>99.9%)(德国 BioFroxx公司)、全自动动物血细胞分析仪(型号:PE-3070VET)(深圳市普康电子有限公司)、全自动动物血液流变仪(型号:HL5000)(康宇医疗器械有限公司)、酶标仪(型33号:K6600-A)(北京凯奥科技发展有限公司)。
1.2 实验方法
1.2.1 动物分组 随机选取10只40 d日龄的SD大鼠(WT)和7只尿酸酶缺失大鼠(Uox-/-),适应性饲养到第45 d日龄称重置于代谢笼记录24 h出入量。实验后置于固定器从尾部采抗凝血(EDTA-K2抗凝)0.2 mL用于血细胞分析。动物用乌拉坦(1.0 g/kg)麻醉后从腹主动脉采抗凝血(肝素抗凝)3 mL用于血液流变学检测,同时采不抗凝血0.5 mL用于血尿酸检测。
1.2.2 血细胞检测 按照说明书操作开启全自动动物血细胞分析仪,选择大鼠模块,将采到的EDTA-K2抗凝血混匀后直接进样检测,收集检测数据。2 h内完成血样收集和血细胞检测。
1.2.3 血液流变学检测 按照说明书操作开启全自动动物血液流变仪,选择大鼠模块,将采到的肝素抗凝血混匀后置于预定的进样盘,自动检测,收集检测数据。2 h内完成血样收集和血液流变检测。
1.2.4 尿酸检测 血液样品凝固后于3 000 r/min,离心5 min制备血清,制备的血清直接用于尿酸检测。尿酸的含量测定方法则按照厂家提供的说明书进行。

2.1 尿酸酶缺失大鼠的血尿酸水平、体质量和出入量变化 45 d日龄尿酸酶缺失大鼠的血尿酸明显高于野生型SD大鼠(图1A),但体质量略低于同龄野生型大鼠(图1B),且差异均有统计学意义(P<0.05),这与我们的前期研究结果一致。
不考虑体质量因素时,45 d日龄的尿酸酶缺失大鼠的24 h进食量无明显变化(图1C),但24 h饮水量(图1D)和24 h排尿量(图1E)明显增加,同时24 h排便量却有所减少(图1F)。考虑到体质量因素时,校正后的指标尿酸酶缺失大鼠24 h进食量则明显增加(图1G),且24 h饮水量(图1H)和24 h排尿量(图1I)进一步增加,同时24 h排便量却无明显差异(图1J)。见图 1。

图1 尿酸酶缺失大鼠的血尿酸水平、体质量和出入量变化
2.2 尿酸酶缺失大鼠的血细胞指标变化 45 d日龄尿酸酶缺失大鼠的白细胞、淋巴细胞、中性粒细胞和中间细胞(主要包含单核细胞、嗜酸性粒细胞和嗜碱性粒细胞)数目明显低于野生型SD大鼠(图2A);
但尿酸酶缺失大鼠的淋巴细胞比例高于野生型SD大鼠,中性粒细胞略低,而中间细胞比例无明显变化(图2B)。
与野生型SD大鼠相比,45 d日龄尿酸酶缺失大鼠的红细胞数目无明显改变(图2C),红细胞压积和红细胞分布宽度CV(变异系数)无明显改变(图2D);
但血红蛋白浓度、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度以及红细胞分布宽度SD(标准差)明显减小(图2D)。
与野生型SD大鼠相比,尿酸酶缺失大鼠血小板数目、大血小板数目(图2E),血小板分布宽度和血小板压积(图2F)无明显改变;
但血小板体积和大血小板比率明显减小(图2F)。见图2。

图2 尿酸酶缺失大鼠的血细胞指标变化
2.3 尿酸酶缺失大鼠的血液流变学指标变化 与野生型SD大鼠相比,45 d日龄尿酸酶缺失大鼠全血高切、中切和低切黏度以及血浆黏度均减小(图3A),但相应的相对黏度增加(图3B),相应的还原黏度则进一步显著增加(图3C)。
与野生型SD大鼠相比,45 d日龄尿酸酶缺失大鼠的血液屈服应力减小(图3D),相应的低切、中切和高切流阻减少(图3E)。与血细胞检测结果类似,尿酸酶缺失大鼠的血沉减慢(图3F),其方程K值也减小(图3G);
红细胞压积(图3H)、红细胞刚性指数(图3I)和红细胞内黏度(图3J)减小,而红细胞聚集指数、红细胞变形指数和红细胞电泳指数(图3I)则增加。见图3。
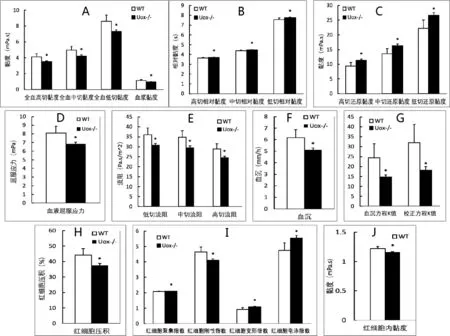
图3 尿酸酶缺失大鼠的血液流变学指标变化
野生型SD大鼠正常表达尿酸酶,表达丰度最高部位是肝脏。与传统的基因敲除不同,Kunming-DY大鼠是基于封闭群大鼠,即SD大鼠,采用CRISPR/Cas9技术敲除尿酸酶基因2~4号外显子区域[4]。先获得杂合子,通过不断交配获得纯合子,纯合子再相互交配选种获得性状较为稳定的尿酸酶缺失大鼠。
尿酸酶缺失后,该大鼠的血尿酸明显升高,但比文献报道的基于近交系C57/6J小鼠研制的尿酸酶缺失小鼠要明显的低[10],成年后的1年生存率达90%以上,虽然表现出生长略有减慢,多饮多尿现象,但表型基本健康,也能正常繁育[4-6,11]。这些现象也在本研究中得到重现,说明该大鼠生长略有减慢,多饮多尿现象能够稳定重现。
本研究发现,与同龄野生SD大鼠不同,尿酸酶缺失大鼠的白细胞数量偏少,且淋巴细胞比例增高,说明该大鼠可能存在慢性感染。尿酸酶缺失大鼠的红细胞数量无明显变化,但血红蛋白、红细胞体积、红细胞血红蛋白含量及浓度以及红细胞分布宽度SD明显减少,说明该大鼠具有营养性贫血倾向,可能存在一定的铁利用障碍,具有小细胞低色素特征的“贫血”倾向。尿酸酶缺失对血小板数量影响较小,但血小板体积和大血小板比率均减少,说明该大鼠的血小板功能更倾向于成熟,有利于止血。
从血液流变学指标看,尿酸酶缺失后,大鼠的全血黏度、血液屈服应力、血液流阻、血沉均出现明显下降。由于血液黏度主要受红细胞影响,变小的红细胞有利于全血黏度下降。由于红细胞内的血红蛋白浓度也是下降的,因此红细胞内的黏度也由此减小。与相关黏度指标下降不同,尿酸酶缺失大鼠的还原黏度是增加的。全血还原黏度是指单位红细胞压积时的全血黏度值,考察的是单位红细胞压积对全血相对黏度的贡献。这提示在尿酸酶缺失大鼠中,单位红细胞压积对血液的黏度贡献是增加的。由于红细胞内的血红蛋白含量有所减小,红细胞的刚性也有所减弱。因为红细胞体积变小,红细胞的流动性有所改善,在电场的作用下更容易发生迁移。本研究结果表明雄性尿酸酶缺失大鼠在45 d日龄时,血尿酸水平明显升高,且具有多饮多尿现象,但其白细胞数量略有减少,多个血液流变学指标也总体改善。
猜你喜欢 血细胞血尿酸日龄 血尿酸高了怎么办?中老年保健(2022年4期)2022-08-22临床检验中血细胞形态学观察与分析中国药学药品知识仓库(2022年9期)2022-05-23社区管理精神病人全血细胞分析锦州医科大学报(2022年2期)2022-05-07SGLT2抑制剂对血尿酸影响的研究进展现代临床医学(2021年2期)2021-03-29甲氨蝶呤治疗类风湿性关节炎发生全血细胞减少不良反应分析现代临床医学(2021年2期)2021-03-29施氏魮(Barbonymus schwanenfeldii)外周血液及造血器官血细胞发生的观察河南科学(2020年3期)2020-06-02不同初配日龄对二元杂种母猪繁殖成绩的影响养猪(2020年1期)2020-02-1926日龄肉鸡腹胀后死亡怎么办今日农业(2019年11期)2019-08-15不同去势日龄对保育猪生长性能的影响国外畜牧学·猪与禽(2018年11期)2018-05-14不同程度神经功能缺损的脑梗死患者血尿酸与预后的相关性研究安徽医科大学学报(2015年9期)2015-12-16推荐访问:血细胞 尿酸 流变