纳米载药体系在肿瘤耐药治疗中的应用研究进展
来源:优秀文章 发布时间:2023-02-08 点击:
张新雨,冯亚婵,张皓杰,杜 朝,郭学玲,王英泽
(河北科技大学食品与生物学院,河北石家庄 050018)
据世界卫生组织(WHO)统计,全球人口死亡原因中癌症死亡人数约占90%,而癌症死亡原因的50%~60%为肿瘤多药耐药(multidrug resistance,MDR)所致,且人数呈逐年增加的趋势[1]。据研究报道,针对肿瘤的常规治疗方法——化疗虽已取得了长足的进步,然而由于缺乏靶向性和有限的生物利用率,化疗的疗效在临床上仍然面临严峻挑战。更重要的是,长期服用化疗药物可导致肿瘤产生MDR,且可增强其他各种细胞毒性药物的反应阈值,对随后使用的各种细胞毒性药物反应无效[2-3]。因此,肿瘤耐药是大多数肿瘤治疗的主要障碍。MDR是一种高度异质性疾病状态,当肿瘤细胞对一种抗癌药物产生耐药性,就会对一系列具有不同结构或作用机制的药物产生交叉耐药性,这是肿瘤患者发生复发转移的关键因素[4-5],因此,运用药物靶向治疗策略克服肿瘤耐药性,对提高临床疗效、进而降低患者复发率显得非常重要。
笔者从肿瘤耐药机制出发,对纳米载药体系在逆转肿瘤耐药方面的研究现状进行综述,介绍肿瘤耐药相关的分子机制,例如ABC转运蛋白家族、酶系统介导的多药耐药等,指出纳米载体的尺寸效应及易修饰等特点可用于设计和构建纳米载药体系,阐明纳米载药体系在增强化疗药物的溶解度、增加给药靶向性、降低给药毒性等方面的应用,重点介绍其在逆转肿瘤耐药方面的技术优势及研究进展。
肿瘤耐药是限制肿瘤治疗效果及术后恢复的主要原因。化疗期间肿瘤细胞的多药耐药可能与多种因素有关,诸如药物摄入量的减少或外排量的增加,遗传因素(基因突变、扩增或表观遗传变化),凋亡通路阻断,外源性物质代谢增强,肿瘤微环境变化等(见图1)。
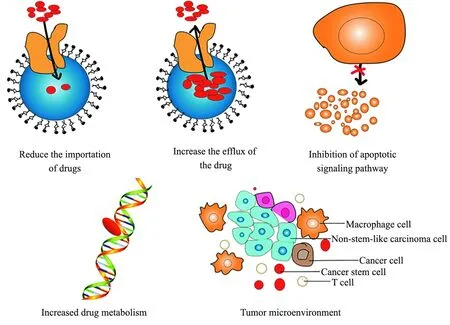
图1 肿瘤耐药机制[6-7]Fig.1 Mechanisms of tumor drug resistance[6-7]
这些机制中的每一种都有可能导致药物治疗效果的降低[6]。因此,从分子机制层面上,探究逆转肿瘤耐药的分子标志物以及分子靶点是肿瘤治疗的研究重点[7](见表1)。ABCG2 同样在多种恶性肿瘤中高表达,HUO等[8]通过构建polyMAG-ABCG2-siRNA磁性纳米颗粒降低肿瘤细胞中ABCG2的表达,从而增加乳腺癌耐药细胞对阿霉素(DOX)的敏感性。

表1 肿瘤耐药机制
1.1 ABC转运蛋白家族介导的多药耐药
ABC转运蛋白作为细胞膜上磷脂、亲脂性药物、胆固醇和其他小分子的转运蛋白,主要负责调控各种化合物的分布、吸收和外排。ABC转运蛋白可以分为7个亚型,在肿瘤细胞中参与耐药的主要包括:P-糖蛋白(P-glycoprotein,P-gp/ MDR-1,也称ABCB1) ,多药耐药蛋白(multidrug resistance related protein,MRP-1,也称ABCC1) ,乳腺癌耐药蛋白(breast cancerresistance protein,BCRP,也称 ABCG2)[9]。研究发现,这些蛋白在多种肿瘤耐药细胞中高表达,ABC转运蛋白的跨膜结构域与药物结合后,ATP结构域活化水解并释放能量,同时在 Mg2+的作用下 ABC 转运蛋白的形态也被改变,药物发生细胞毒作用前即被转移至肿瘤细胞外,可降低细胞内药物浓度,导致耐药性的产生。ROBEY等[10]和姚血明等[11]研究阐述了ABC转运蛋白超家族主要包括P-gp,ABCG2等。在临床上,P-gp在癌干细胞、实体瘤、血液瘤中均有发现。SUI等[12]研究表明肿瘤细胞膜P-gp的过表达是肿瘤耐药的主要机制,并构建了PAMAM-DOX -siMDR-1/siP-gp纳米复合物,通过下调MDR-1/P-gp 增加了DOX的药物敏感性,进而诱导肿瘤细胞凋亡。WATT等[13]发现,拉帕替尼通过对ABC转运蛋白MDR-1和BCRP的抑制从而减弱EGFR/HER2信号转导,进而提高乳腺癌MCF-7细胞对DOX的敏感性,增加DOX在肿瘤细胞内的积累。P-gp可以利用水解ATP时释放的能量,顺浓度梯度,将带有正电荷的疏水亲脂性的药物释放到细胞外,导致细胞内药物浓度低于细胞外,从而减少化疗药物对特定部位的渗透。在多种化疗药物的研究中发现,肿瘤细胞中P-gp的过度表达与紫杉醇、奥拉帕利和长春花碱等耐药性的增强存在显著关联性[12-16]。HUANG等[17]也阐明纳米粒子释放到细胞质中的药物易受P-gp介导的外排。因此,药物外排的增加被认为是癌细胞对化疗药物产生耐药性的关键机制之一。
1.2 酶系统介导的多药耐药
酶系统介导的耐药也是造成肿瘤耐药机制之一,其中主要涉及到3种酶。①谷胱甘肽转移酶,研究表明其催化GSH与各种亲电子的化疗药物结合,使其水溶性增加,药物分解加快、毒性减弱,或通过抑制 RAS-MAPK 通路活化蛋白激酶间接增强药物耐药性。LEE等[18]发现,非极性化合物6-[(7-硝基-2,1,3-苯并恶二唑-4-基硫代)]己醇(NBDHEX),是谷胱甘肽 S-转移酶 (GST) 的抑制剂。此外,MRP1 输出泵能够输送疏水阴离子,包括与谷胱甘肽(glutathione,GSH)、葡糖苷酸和硫酸盐结合的药物甚至未经修饰的抗癌剂。NBDHEX可以与还原型谷胱甘肽相结合,在 GST活性位点形成稳定的复合物。因此,通过NBDHEX 和 GSH 之间的阴离子加合物作为 MRP1 转运蛋白的底物,使NBDHEX与GSH复合物从细胞中排出,导致细胞内药物浓度降低从而产生了耐药性。②拓扑异构酶Ⅱ,研究表明其通过形成药物-Topo-DNA 复合物,从而抑制 Topo 的表达或磷酸化水平的升高,使酶含量减少、活性减弱,从而导致药物作用靶点减少,产生耐药。③Ca2 +依赖性蛋白激酶体系,如MAPK,PKC等,PKC广泛分布于各种组织细胞,介导信号转导并调控基因表达,与肿瘤发生和耐药相关。
1.3 凋亡调控介导的多药耐药
在肿瘤凋亡途径中,突变型p53基因、Bcl-2/neu,NF-κB、肿瘤坏死因子(tumor necrosis factor,TNF)等影响因素的变化都会使肿瘤细胞对药物的敏感性下降,从而抑制肿瘤细胞的凋亡,引起肿瘤产生耐药性。BERTRAM等[19]利用维奈妥拉(Venetoclax)或依鲁替尼(Ibrutinib)单一给药和联合给药抑制抗凋亡蛋白Bcl-2和酪氨酸激酶BTK,能在体外有效地杀死DLBCL细胞。结果显示,联合治疗的效果优于单药治疗,且联合治疗能有效克服细胞的获得性耐药,这一现象可能与降低Bcl-2家族成员Bcl-X和Bcl-2A1的表达有关。
1.4 DNA损伤修复能力增强介导的多药耐药
对多种抗癌药物产生耐药性的另一种可能性是肿瘤细胞修复DNA损伤能力的增强。临床使用化疗药物如顺铂、DOX等均可对DNA造成损伤,导致抑制肿瘤细胞增殖或促进凋亡,起到良好的治疗效果,但DNA反复损伤可诱导DNA修复系统活性异常活跃,导致肿瘤细胞中酶蛋白的合成增加,使肿瘤药物作用减弱,从而产生耐药性。DNA的修复途径主要有:核苷酸切除修复、碱基切除修复、错配修复、双键断裂修复。其中参与核苷酸切除修复(NER)途径的DNA修复内切酶XPF和DNA切除修复蛋白ERCC1,对于有效修复交联剂和铂基试剂诱导的DNA损伤至关重要[20]。XPF和ERCC1蛋白的过度表达与癌细胞顺铂耐药性的增强之间存在显著相关性[21]。DNA错配修复途径的降低也可以导致耐药性的增加,在多种肿瘤中发现,hMLH1基因启动子的高甲基化导致参与错配修复途径的MLH1蛋白表达降低。5-氟-2-脱氧胞苷和胞苷类似物地西他滨可以逆转这种高甲基化,并通过恢复错配修复功能增加细胞对顺铂的敏感性[22-23]。DNA双链断裂修复也同样影响肿瘤细胞对化疗药的耐药性,研究发现,RAD51是一种负责DNA 双链断裂修复的蛋白,在多发性骨髓瘤细胞中发现RAD51过度表达。此外,体内RAD51的高表达与化疗耐药性和患者存活率低有关。化合物B02可中断RAD51与单链DNA的结合,从而提高肿瘤细胞对多种DNA损伤剂的敏感性,如盐酸DOX[24]。
1.5 低氧诱导因子-1α介导的多药耐药
缺氧是实体瘤的一个重要特征,肿瘤细胞因快速增殖而长期处于低氧的环境中,发生血管异常或产生抗癌药物阻断剂如热休克蛋白、蛋白酶等,导致抗癌药物难以在低氧处发挥作用[25],因此,低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)在肿瘤耐药机制中的作用也越来越受到关注。研究发现[26],HIF-1α可以显著增加ABC转运蛋白(MDR1,MRP1,BCRP)的表达,从而诱导细胞耐药性的产生。另外,从乳腺癌中发现,HIF-1α可以通过介导肿瘤细胞自噬,增强MCF7细胞对他莫昔芬的耐药性[27]。通过靶向HIF-1α介导的信号转导可以逆转肿瘤细胞耐药。XU等[28]研究发现,在低氧条件下,miR-338-5p在大肠癌细胞过表达,并直接靶向调控白介素-6 (Interleukin-6,IL-6)和 HIF-1α的表达,采用HIF-1α抑制剂PX-478可以抑制体内HIF-1α/miR-338-5p/IL-6反馈环而增强大肠癌对奥沙利铂(OXA)的敏感性。LIU等[29]发现通过抑制HIF-1α可以下调MDR1/P-gp的表达,从而逆转结直肠癌细胞对DOX、长春新碱、5-氟尿嘧啶和伊立替康的耐药性。
总之,ABC转运蛋白家族、酶系统、细胞凋亡、DNA损伤修复和HIF-1α等的结构或功能的改变与肿瘤多药耐药机制密切相关。与肿瘤耐药相关的重要分子机制已被广泛研究,包括ABC转运蛋白超家族、体内酶系统 、细胞凋亡、自噬、胚胎干细胞等可导致药物外排增加、解毒机制增强、DNA修复故障、细胞死亡抑制。受基因和信号调控通路相互影响,这些机制从某一方面并不能清楚地解释肿瘤的多药耐药机制,随着对转录组和蛋白质组研究的进一步推进,可从多维度解释多药耐药的调控机制,为临床逆转肿瘤耐药性的研究提供参考。
纳米材料是指在三维空间中至少有一维处于纳米尺度范围(1~100 nm)或以此为基本单元构成的材料。随着科技的发展,纳米载药体系在肿瘤治疗中得到广泛的应用。
2.1 纳米载体的种类
纳米粒载药能够调节释药的速度并且改变药物在体内的分布;
纳米乳药物载体可以提高难溶性药物的溶解度,并且提高药物的生物利用度;
磁性纳米载体可以减少药物的毒副作用,增强药物特定的靶向性。赵文萃等[30]研究表明磁性纳米颗粒可在交变磁场作用下靶向释药,顺磁性或超顺磁性纳米氧化铁颗粒还能够产热,提升肿瘤细胞温度并杀死肿瘤细胞。目前常使用的纳米颗粒载体包括脂质体、固体脂类、聚合物、介孔二氧化硅以及无机纳米颗粒(见图2)。

图2 纳米颗粒种类[30-33]Fig.2 Types of nanoparticles[30-33]
1)脂质体 是一种可生物降解的纳米颗粒,由两性磷脂双分子层构成,通过胞饮和内吞作用将包裹的药物释放到细胞内。使用脂质体释放药物可以提高药物的代谢和药效。SAHA等[31]研究表明,激酶抑制剂与合理选择的脂质支架结合,能有效逆转肿瘤耐药,从而提高抗癌效果。
2)固体脂类纳米颗粒 因其疏水核心被磷脂单分子层覆盖,所以比脂质体更加稳定,且毒性小于聚合物和介孔二氧化硅纳米颗粒。XU 等[32]研究发现,紫杉醇固体脂类纳米复合物(PTX-SLNs)在MCF7/ADR中表现出明显的抗肿瘤活性,这种逆转可能通过固体脂类纳米颗粒SLNs在MDR细胞中逃避外排泵的摄取,也可能是由于SLNs在MDR细胞中使用了不同的内吞途径。
3)聚合物纳米颗粒 可以组装成纳米微球或纳米胶囊并通过表面修饰等对反应进行调整和控制,如促进生物分布、药代动力学控制、药物包覆等。
4)介孔二氧化硅纳米颗粒 可以为转载的药物提供物理屏障,防止药物变性或降解,宜运送大量药物并可通过构建多种条件来精确调控药物靶向释放。WESCH等[33]研究发现,miR-375与中空介孔二氧化硅纳米颗粒(HMSN)的协同作用导致肝癌细胞对DOX的摄取显著增加,并阻止了肝癌细胞的生长。
5)无机纳米颗粒 包括由金属、金属氧化物和金属硫化物制备的一系列产品。无机纳米颗粒表面结构易于修饰改造,可有效克服网状内皮系统对药物输送的障碍,且在大多数温度和pH值条件下都比较适用。最新的文献报道描述了金纳米棒和纳米多孔载体的使用,这些载体集成了一个天然光路,可在约650 nm处进行光激活,从而将载体药物有效地释放到细胞中,通过纳米光子机制诱导耐药乳腺癌细胞死亡[33]。
2.2 纳米载药体系在肿瘤治疗中的应用
目前纳米载药体系在肿瘤治疗中的应用主要包括光热治疗、光动力治疗、声动力治疗以及免疫治疗。治疗性的纳米颗粒通过减少药物在正常组织中的聚集,提高药物在病理部位的积累和释放,以提高肿瘤的治疗效果,降低副作用。
2.2.1 光热治疗
与正常组织相比,肿瘤细胞对高热敏感,大部分肿瘤细胞都有一个致死温度的临界点为42.5~43.0 ℃,以此温度处理肿瘤细胞可以增加其细胞膜的通透性。通过纳米技术将具有高光热转换率的新型材料聚集到肿瘤细胞周围,经外部光源的照射,通过热能杀死肿瘤细胞。赵文萃等[30]研究表明,热疗可以促使纳米颗粒进入细胞,提升细胞内药物的富集率。ZHANG等[34]研究证实基于氧化铁纳米技术通过光热治疗手段,将光能转换为热能,大幅度提升肿瘤部位的温度,增强了DOX对肿瘤细胞的杀伤力。
2.2.2 光动力学治疗
光动力治疗(photodynamic therapy,PDT)是利用光照射并激活光敏药物在肿瘤组织的聚集,产生活性氧分子诱导肿瘤细胞凋亡、坏死或自噬,从而达到治疗肿瘤的一种方式。目前,光动力治疗已经被各国批准用于部分浅层肿瘤,包括皮肤肿瘤、肺部肿瘤、妇科肿瘤等,并在临床中取得了良好的治疗效果。郭璐[35]研究发现,选择吸收光谱位于绿光区域的半导体聚合物PFDTBT、匹配的光敏剂分子二氢卟吩e6(Chlorin e6,Ce6)和光开关分子 BTE,在激发光源照射条件下能显著发挥光动力学治疗的效果(ON),在非激发光源照射条件下不能发挥光动力学治疗的效果(OFF),从而达到消融肿瘤组织并减少光过敏反应的目的。
2.2.3 声动力学治疗
由光动力学治疗发展而来的声动力学疗法(sonodynamictherapy,SDT)是一种采用声敏剂和超声的协同效应杀伤肿瘤细胞的治疗方式,其在软组织中的穿透深度可达10 cm,具有低毒、靶向、无创等优点。纳米载药体系的快速发展为声敏剂的修饰、递送以及提升SDT效果带来新的契机。例如二氧化钛纳米颗粒、金纳米颗粒、石墨烯及富勒烯等已被证明可有效提升SDT的效果[36]。此外,为了改善现有声敏剂的治疗效果,科研工作者常将SDT与其他治疗方法联用,从而增加声敏剂的空化作用,改善肿瘤缺氧微环境,利用外源激光或超声波刺激以及肿瘤组织自身特殊的微环境实现控制药物释放,达到较好的肿瘤治疗效果。例如,ZHANG 等[37]利用硫酸软骨素(CS)、产生活性氧(ROS)的声敏剂大黄酸(Rh)和全氟碳(PFC)构建的新型CD44受体靶向氧化还原/超声响应载氧纳米平台可以促进全身免疫,并容纳多种疏水性药物,以增强化学SDT对B16F10黑色素瘤细胞的治疗效果。
2.2.4 免疫治疗
肿瘤的免疫治疗以靶向人体的免疫系统,通过激活或调动人体免疫系统功能从而增强机体的免疫力,依靠自身的免疫系统杀伤肿瘤细胞。目前,将纳米技术与免疫疗法相结合的研究层出不穷。有研究表明,细胞膜包被的仿生纳米颗粒可以避免被机体免疫系统清除,从而最大程度地集聚在肿瘤细胞中,具有良好的肿瘤治疗效果。CHEN等[38]使用红细胞膜包被聚乳酸-乙醇酸 (polylactic acid-glycolic acid,PLGA)纳米粒子,PLGA外层的红细胞膜蛋白提高了生物相容性并延长其在血液循环中的时间,同时纳米颗粒还可以联合SDT起到肿瘤免疫治疗的效果。例如,SI等[39]报道采用一种相变纳米颗粒(LIP-PFH)能在体内外抑制4T1细胞的增殖并促进其凋亡,导致肿瘤组织中CD4+和CD8+T细胞亚群显著增加,同时CD8+PD-1+T细胞减少,表明纳米颗粒介导SDT处理的乳腺癌细胞的抗肿瘤免疫应答作用效果增强。
综上所述,纳米载药体系包括脂质体、固体脂类、聚合物、介孔二氧化硅以及无机纳米颗粒等多种形式,以克服网状内皮系统对药物的输送障碍的优势,结合光热、光动力、声动力、免疫等方式对肿瘤进行治疗,达到靶向、无创、低毒等更高效的治疗效果。
在肿瘤治疗中,纳米技术作为新兴的治疗手段,可改善药代动力学,实现靶向给药,并减少毒副作用。纳米颗粒作为一种外源性物质,在体内运输的各个阶段都会遇到各种不同的阻碍,经静脉注射进入血液后,血浆中的各种蛋白质被吸附到纳米颗粒表面并进行标记,网状内皮系统和单核巨噬细胞会识别被标记的纳米颗粒并清除,甚至会形成血管栓塞或器官梗塞,可以通过改变纳米颗粒的本身特性如稳定性、表面电荷、表面功能团等,改善纳米颗粒在体内的循环能力,增加药物的聚集度和靶向性,最终实现逆转肿瘤耐药性。
通过对纳米载药体系的理性设计,可增大药物的溶解度,提升体系稳定性,增加靶向性能,增加成像诊断性能、水溶性、生物相容性等。通常情况下,智能化可控释放纳米载药体系能够对pH/声光热等刺激作出响应,在药物递送中表现出极具竞争力的应用前景。ALVAREZ-ARENAS等[40]研究表明,金属钆内包富勒烯Gd@C82(OH)22纳米颗粒通过促进药物内吞并调控肿瘤血管新生因子的表达,增强药物对肿瘤的杀伤力甚至可以逆转肿瘤的多药耐药现象。ROBLES-ESPINOZA[41]研究表明,纳米颗粒可以进行不同尺寸、多种表面修饰、不同形状、多种载荷方式的设计,具有光、热、声等多种刺激触发药物的释放方式。
3.1 纳米载药体系克服肿瘤耐药的治疗策略
3.1.1 增加药物在细胞内的聚集浓度
纳米颗粒黏附于肿瘤细胞膜上,造成局部浓度过高,产生浓度梯度,有利于药物从胞外向胞内扩散,增加细胞内药物浓度,起到逆转肿瘤耐药的效果。纳米颗粒通过内吞作用直接进入细胞,避开了细胞膜上膜蛋白的拦截作用,同时可以对各种纳米颗粒表面进行修饰,减少P-gp的拦截,使进入细胞内的药物浓度增加。
3.1.2 增加化疗药物的溶解性
维拉帕米、环孢素A、奎尼丁和他莫昔芬等化合药物具有很好的肿瘤治疗效果,但均具有极高的疏水性和难溶性,导致生物利用率降低。利用纳米载药体系,可以明显增加药物溶解度并保护药物生物活性。LI等[42]研究阐明与传统化疗药物相比,纳米载药体系可逃避免疫系统攻击,延长药物半衰期,提高药物利用率,且具有更高的靶向性和缓释性,从而实现肿瘤逆转耐药。ELSHIMALI等[43]研究应用PEO-PCL联合紫杉醇和他莫昔芬纳米药物处理多药耐药细胞株SKOV3TR,结果表明,肿瘤细胞中紫杉醇和他莫昔芬的药物浓度增加,且降低了紫杉醇的治疗剂量阈值。纳米载药体系提高难溶性药物溶出及生物利用度主要是基于其纳米尺寸效应,主要包括提高药物的溶解度、提高药物的溶出速度、生物黏附效应以增加胃肠滞留时间及多种吸收机制并存。
3.1.3 减弱肿瘤细胞对化疗药物的解毒作用
将纳米颗粒与药物偶联,将药物直接靶向肿瘤细胞核内,减少肿瘤细胞组织中高表达的谷胱甘肽转移酶对化疗药物活性的降低作用,减弱解毒作用,从而达到逆转耐药。PAN等[44]通过将 TAT 肽缀合到介孔二氧化硅纳米粒子 (MSNs-TAT) 表面构建的活性核靶向药物递送系统,有效逆转了癌细胞的多药耐药性。
TAT 肽的结合促进了 MSNs-TAT 的核内定位和封装药物直接在核质内的释放。结果表明,在多药耐药的 MCF-7/ADR 癌细胞中,DOX-MSNs-TAT载药体系能显著提高癌细胞内和核内阿霉素(DOX)的浓度,可显著逆转肿瘤细胞的耐药性。
3.1.4 通过抑制HIF-1的表达逆转肿瘤耐药
关于纳米载药体系在缺氧治疗中的应用也有广泛研究。沉默HIF-1α基因是抑制缺氧环境的方法之一。MENG等[45]研究了对活性氧(reactive oxygen species,ROS)响应的纳米平台对增加肿瘤的氧化和抑制HIF-1功能。基于二氧化锰的纳米材料将HIF-1α抑制剂和其他亲水性阳离子药物输送到肿瘤部位,在与肿瘤组织内过度表达的过氧化氢反应后,Mn2+和氧分子分别被释放,抑制HIF-1功能,明显减少肿瘤侵袭相关的信号分子的表达,以降低恶性转移的风险。除了直接抑制HIF-1的功能外,通过间接抑制HIF-1信号转导通路是另外一种策略。热休克蛋白90(HSP90)是HIF-1转录活性所必需的,抑制HSP90也可以下调HIF-1α的表达。PI3K/Akt/mTOR途径可以调节HIF-1α的表达,并且对该途径的抑制可下调HIF-1α的表达,从而增强MDR细胞对癌症治疗的敏感性[46]。
3.1.5 通过靶向凋亡克服肿瘤耐药
纳米载药体系通过递送Bcl-2和化疗药物靶向肿瘤细胞是克服肿瘤耐药性的替代方法。除了抑制抗凋亡部分外,纳米颗粒递送促凋亡化合物的活化也可用于对抗凋亡途径介导的耐药性。神经酰胺能够通过调节替代的pre-mRNA剪接来恢复野生型p53蛋白(一种重要的肿瘤抑制因子)的表达。在此过程中,纳米载药体系提供了一个更有效的平台,将神经酰胺递送到携带p53错义突变的癌细胞中[47]。此外,一些基于纳米颗粒的药物递送系统通过抑制外排泵以及促进细胞凋亡来发挥作用。樊凤阳[48]将细胞凋亡诱导药物ATRA负载在经修饰的纳米金刚石表面,得到了DND-ATRA纳米复合物的药物微团体,FACS 检测结果显示DND-ATRA纳米复合物诱导HL 60细胞凋亡率比单独使用ATRA提高了35%。
3.2 纳米载药体系表征优化提高生物相容性的治疗策略
较小的纳米颗粒能快速通过肾脏排泄掉,较大的纳米颗粒会被内皮网状系统清除。一般来说,粒径越小,越容易逃避内皮网状系统的清除,在体内循环时间越长。同时,纳米颗粒的形状对其在体内聚集程度和循环时间也有一定的影响,球形纳米颗粒更容易被巨噬细胞吞噬,纤维状纳米颗粒具有更长的循环时间。此外,负电荷的纳米颗粒易被网状内皮细胞清除,正电荷的纳米颗粒易被肺、肝脏和脾脏中的巨噬细胞清除。杨建苗等[49]研究表明,纳米药物体系通过大小、形状、亲/疏水性、电荷等修饰被广泛应用于光动力学治疗、光热治疗、免疫治疗中抑制肿瘤耐药。SCHLACHER[50]研究表明,电荷影响纳米颗粒的靶向功能使其易被巨噬细胞吞噬,导致肿瘤部位化疗药物含量降低。为了稳定纳米载药体系的带电性,常见的修饰方式有结合糖脂、肽段、小分子、低聚糖、抗体、细胞膜(白细胞、肿瘤细胞和红细胞)、叶酸、半胱氨酸、谷胱甘肽等,其中高分子聚合物聚乙二醇(polyethylene glycol,PEG)是一种具有强亲水能力的聚合物,用PEG对纳米颗粒进行修饰,可以显著降低纳米药物与血清蛋白的结合,降低免疫原性,减少被巨噬细胞的吞噬,延长循环时间,保持靶向性和稳定性。
综上所述,对纳米载药体系的理性设计,可增大药物溶解度,提升体系稳定性,增加药物在肿瘤细胞内的浓度,减弱肿瘤细胞的解毒作用,增加药物靶向性、水溶性、生物相容性,从而达到逆转肿瘤耐药性的目的。随着对耐药机制的深入研究,可以从耐药机制出发,对纳米载药体系进行针对性设计,拓宽逆转肿瘤耐药的方式。与此同时,纳米载药体系是否会引起进一步耐药性、生物安全性等问题仍值得进一步探究。
肿瘤以及肿瘤耐药的发生是由多种因素相互作用所致的[51],目前,逆转肿瘤耐药的手段主要有利用纳米载药系统如纳米颗粒、聚合物胶束和脂质体等来抵抗肿瘤细胞对药物的外排;
利用纳米载药系统联合多种抗癌药如紫杉醇、顺铂和姜黄素等提高药物的溶解度;
利用纳米载药系统自身的物理和化学性质,通过改变其尺寸、密度、电荷、表面修饰,从而影响药代动力学。纳米材料逆转肿瘤耐药的研究为肿瘤的治疗提供了新的思路,也为临床攻克患者多药耐药的难题提供了有力支撑。
近年来,通过对纳米载药系统设计和修饰达到增强靶向性、缓释、控释和降低给药毒性的效果,提高肿瘤细胞内药物聚集的研究不断深入。但在应用过程中仍需解决以下几个问题。
1)通过对纳米载药系统的设计和修饰提高细胞内药物浓度进行逆转耐药,是否会因为浓度的升高进一步引起肿瘤细胞的耐药还尚未可知。
2)对纳米载药系统的生物安全性仍需要进一步探究。如何优化纳米载药系统,使其更适合于人体,如何避免或降低可能出现的毒副反应,以及纳米颗粒的降解排泄等问题还需要全面探究。
3)纳米载药系统逆转肿瘤耐药的方法仍有待创新,结合免疫学、光动力学、声动力学等多种方法,提高纳米载药体系逆转肿瘤耐药的效率是后继研究的重点。
对上述问题的深入研究将为临床解决肿瘤治疗的难题提供新的依据和策略。
猜你喜欢 载药耐药性靶向 新型抗肿瘤药物:靶向药物中老年保健(2022年1期)2022-08-17Callispheres载药微球与传统支气管动脉化疗栓塞治疗不可切除的中央型鳞癌的临床疗效对比:一项回顾性研究中国临床医学影像杂志(2022年6期)2022-07-26如何判断靶向治疗耐药保健医苑(2022年5期)2022-06-10不孕不育女性支原体感染情况及耐药性分析健康体检与管理(2022年4期)2022-05-13长丝鲈溃烂症病原分离鉴定和耐药性分析当代水产(2021年8期)2021-11-04159株淋球菌对7种抗生素的耐药性实验研究皮肤病与性病(2021年3期)2021-07-30携IL-6单克隆抗体靶向微泡破坏技术在兔MI/RI损伤中的应用昆明医科大学学报(2021年2期)2021-03-29超临界流体技术在眼科生物医药领域的应用中国药学药品知识仓库(2021年17期)2021-01-11WHO:HIV耐药性危机升级,普及耐药性检测意义重大中国生殖健康(2019年12期)2019-01-07131I标记壳聚糖/明胶—拓扑替康载药膜对SK—OV—3腹腔荷瘤鼠的治疗效果中国现代医生(2018年30期)2018-12-06推荐访问:耐药 研究进展 纳米