单侧症状性颈动脉狭窄颈动脉内膜切除术或颈动脉支架成形术早期脑血流动力学变化及围手术期事件
来源:优秀文章 发布时间:2023-01-25 点击:
王文鑫 王革生 薛哲 孙正辉 马林
脑血管病是我国成人病死和病残的首位原因,我国每年新发脑卒中患者约270万例[1],其中,缺血性卒中占70%~80%,有1/4的缺血性卒中与颈动脉粥样硬化性狭窄(以下简称颈动脉狭窄)相关,颈动脉狭窄业已成为缺血性脑血管病的重要病因[2]。治疗方面,既往首选颈动脉内膜切除术(CEA),近年颈动脉支架成形术(CAS)应用越来越广泛,成为颈动脉内膜切除术的替代方法。研究表明,症状性颈动脉狭窄患者接受颈动脉支架成形术和颈动脉内膜切除术后长期预后和脑卒中复发风险相近[3],但前者罹患手术相关脑卒中的风险较高,尤其是老年患者,而并发心肌梗死、脑神经麻痹和手术部位血肿的风险较低[3-8]。基于此,本研究对比分析症状性颈动脉狭窄患者行颈动脉内膜切除术和颈动脉支架成形术围手术期脑血流动力学变化,并探讨其与围手术期事件的相关性,以为颈动脉狭窄患者个性化治疗提供依据。
一、临床资料
1.纳入标准 (1)颈动脉狭窄的判断参照北美症状性颈动脉内膜剥脱试验(NASCET)标准[9]:单侧颈动脉狭窄>50%,且对侧颈动脉及后循环动脉狭窄<50%、颅内动脉狭窄<50%。(2)均经DSA、颈部血管超声证实为中至重度(>50%)颈动脉粥样硬化性狭窄。(3)存在单侧肢体麻木无力、黑蒙、言语障碍等症状性颈动脉狭窄症状与体征。(4)所有患者及其家属均对手术方案和风险知情并签署知情同意书。
2.排除标准 (1)单侧颈动脉闭塞或双侧颈动脉狭窄>50%或颅内动脉狭窄≥50%。(2)有脑出血病史或2周内新发缺血性卒中。(3)症状性冠心病。(4)合并难治性高血压和糖尿病,且血压、血糖控制欠佳。(5)因其他基础疾病不宜行颈动脉内膜切除术或颈动脉支架成形术。(6)影像学图片质量较差影响结果分析或因故中断影像学检查。
3.一般资料 选择2018年1月至2020年6月在北京中医药大学东方医院和解放军总医院第一医学中心神经外科住院治疗的单侧症状性颈动脉狭窄患者共43例,其中,男性36例,女性7例;
年龄为46~77岁,平均(62.51±6.68)岁;
体重指数(BMI)17.40~36.21 kg/m2,平均(25.10±3.60)kg/m2;
既往合并高血压占65.12%(28/43)、冠心病占27.91%(12/43)、糖尿病占44.19%(19/43)、高脂血 症 占41.86%(18/43),缺血性卒中病史占53.49%(23/43),吸烟史占53.49%(23/43);
左侧颈动脉狭窄17例(39.53%),右侧26例(60.47%);
颈动脉狭窄程度>50%~69%者4例(9.30%),70%~90%者27例(62.79%),>90%者12例(27.91%);
入院时改良Rankin量表(mRS)评分1~3,平均1.65±0.65。由临床经验丰富的包括神经内科、神经外科、神经影像科在内的多学科共同决定手术方式,并与患者及家属达成共识,19例行颈动脉内膜切除术(CEA组),24例行颈动脉支架成形术(CAS组),两组患者一般资料比较,差异无统计学意义(均P>0.05,表1),均衡可比。
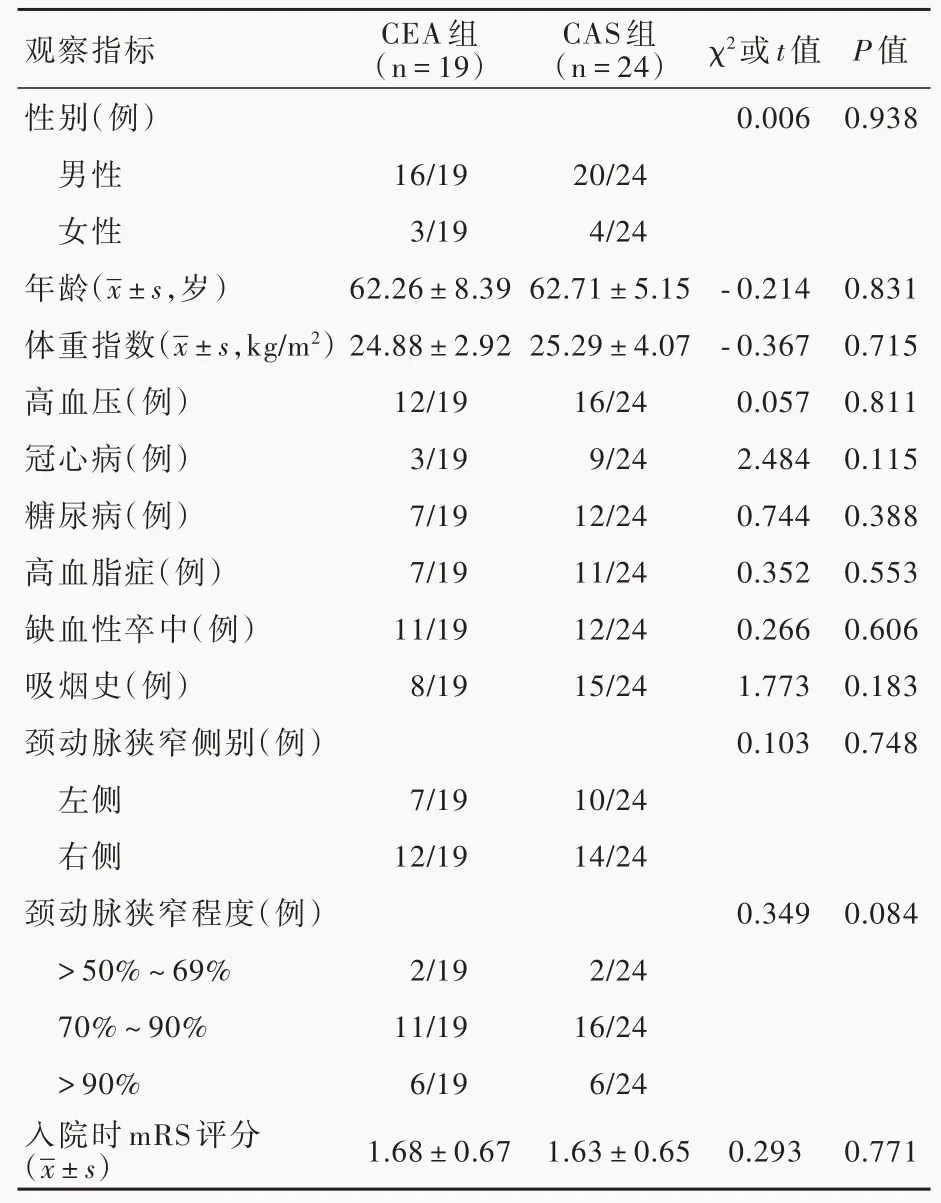
表1 CEA组与CAS组患者一般资料的比较Table 1. Comparison of baseline data between CEA group and CASgroup
二、研究方法
1.颈动脉内膜切除术 CEA组患者术前服用阿司匹林100 mg/d至少1周。患者仰卧位,气管插管全身麻醉,头向对侧轻度旋转。于胸锁乳突肌前缘做长度约5 cm的斜形切口,逐层切开皮下组织和颈阔肌,沿颈内静脉内侧解剖,显露颈动脉鞘,锐性剪开颈动脉鞘,游离颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)和甲状腺上动脉(STA),1%利多卡因1 ml封闭颈动脉窦,分别阻断颈外动脉、颈总动脉和颈内动脉,切开颈总动脉,以Pott剪延长切口,剪开颈动脉分叉部和近段前壁,剥离子分离斑块,近端剪断分离的斑块,继续分离颈内动脉斑块,直至终点,轻轻拉出,提起离断的斑块,向颈外动脉分离,取出斑块,剥离斑块期间持续以肝素生理盐水冲洗。检查无残留斑片,以6-0 Prolene线缝合切口,逐层缝合颈动脉鞘、肌肉、筋膜、皮下组织和皮肤。术后返回重症监护病房(ICU)。
2.颈动脉支架成形术 CAS组患者术前服用阿司匹林100 mg/d联合氯吡格雷75 mg/d至少1周。患者呈仰卧位,采用1%利多卡因局部麻醉,8F导引导管(美国Johnson&Johnson公司)在泥鳅导丝(日本Terumo株式会社)导引下送至颈总动脉距病变约2 cm处,撤出导丝,常规行术中DSA,选择最佳工作角度,确认手术方案,EV3保护伞栓塞保护器(Spider FX,美国EV3公司)提供远端滤过保护,将微导丝+保护伞组合送至颈内动脉C1段远端,撤出微导丝,并释放保护伞,撤出输送导管,球囊导管传入保护伞导丝尾端,快速交换推送至病变处,加压扩张,扩张满意后撤出球囊导管,快速交换将支架(17例采用Precise支架,美国Johnson&Johnson公司;
7例采用Protege支架,美国EV3公司)送至病变处,准确定位后释放,撤出支架输送系统,推送回收装置至保护伞处,回收保护伞。术后常规心电监测24 h,若循环不稳定则持续心电监测至循环稳定。
3.围手术期管理 (1)影像学检查及图像处理:本组所有患者均于术前3 d进行MRI检查,扫描序列包括T1WI、T2WI、DWI、三维T1-快速扰相梯度回波序列(3D-T1-FSPGR)和三维伪连续动脉自旋标记[3D-p CASL,标记后延迟时间(PLD)为2 s],并于术后第3和7天复查上述扫描序列。由同一位放射科技师采用AW 4.5工作站(美国GE公司)Function Tool后处理软件计算获得3D-p CASL脑血流量(CBF)图,导入计算机进行后处理,量化提取手术前后颈内动脉供血区CBF值[10-12]。首先,以加拿大蒙特利尔神经病学研究所(MNI)标准空间为模板对3D-T1-FSPGR图像进行空间标准化,所用软件为基于 Matlab(https://ww2.mathworks.cn/downloads/web_downloads/?s_iid=hp_ff_t_downloads)环境运行的SPM8软件(www.fil.ion.ucl.ac.uk/spm/software/Spm8);
然后,将获得的CBF参数图与标准化后的3D-T1-FSPGR图像进行配准,配准完成后,以6 mm半高全宽(FWHM)行高斯核平滑;
最后,采用DPABI软件(http://rfmri.org/content/dpabi-download)提取颈内动脉供血区三维空间CBF值。(2)血压管理:为减少脑高灌注综合征(CHS)发生及血压波动对CBF值的影响,所有患者术后常规控制血压,使收缩压维持于100~130 mm Hg(1 mm Hg=0.133 kPa)。若收缩压<90 mm Hg或平均动脉压(MAP)<50 mm Hg,静脉泵入多巴胺10 mg/h(根据血压调整泵入速度);
若心率<50次/min,静脉泵入异丙肾上腺素1 mg(0.06 mg/h,根据心率调整泵入速度)。
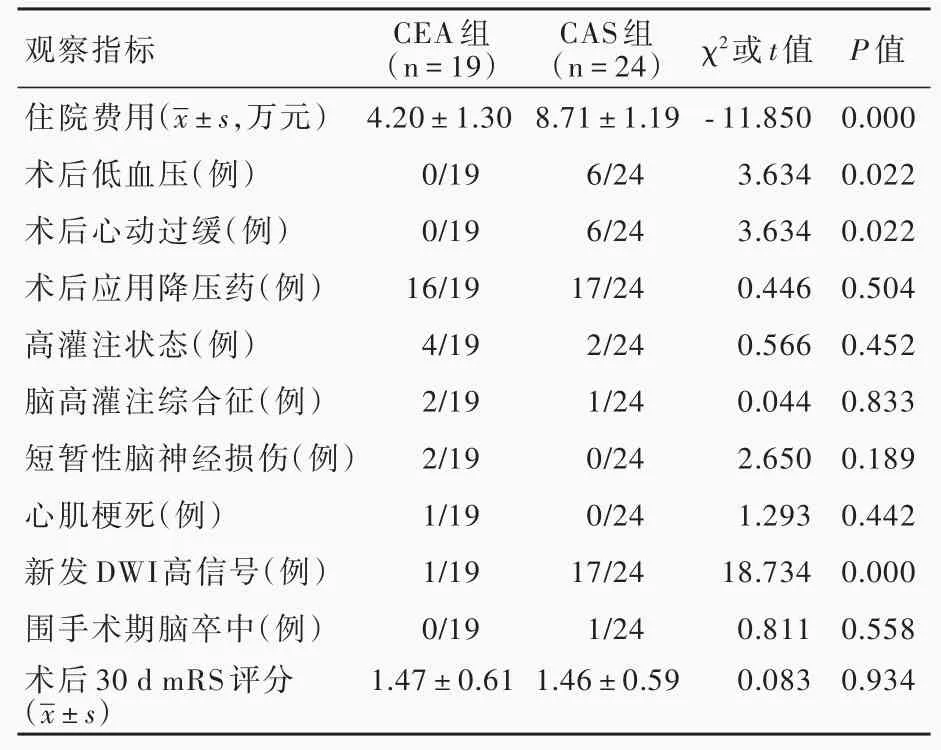
表2 CEA组与CAS组患者围手术期观察指标的比较Table 2. Comparison of perioperative observation items between CEA group and CAS group
4.围手术期观察指标 详细记录两组患者围手术期心率、血压、CBF值、脑卒中发生情况和住院费用,以及术后药物应用情况和高灌注状态、脑高灌注综合征、心肌梗死、脑神经损伤、新发DWI高信号发生情况。其中,心率每日测量4次(6∶00、12∶00、18∶00、24∶00),取平均值,比较两组患者术前1 d和术后第1~4天心率变化。血压每日测量4次(6∶00、12∶00、18∶00、24∶00),取平均值,比较入院时与出院时舒张压和收缩压的变化;
持续低血压定义为收缩压<90 mm Hg或平均动脉压<50 mm Hg,或者须血管活性药物维持时间>6 h[13]。高灌注状态定义为术后CBF值增加>100%。脑高灌注综合征定义为出现高灌注状态,临床表现为单侧头痛、眼痛、面痛,癫发作以及继发于脑水肿或脑出血的局灶性神经功能缺损,并除外梗死灶[14-15]。新发DWI高信号定义为术前无DWI信号改变的区域在术后出现新的DWI高信号,考虑为术后微栓塞。
5.统计分析方法 采用SPSS 20.0统计软件行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。呈正态分布的计量资料以均数±标准差(±s)表示,采用两独立样本的t检验;
两组患者手术前后心率、血压、CBF值的比较采用重复测量设计的方差分析,两两比较行LSD-t检验。呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,采用Mann-WhitneyU检验。以P≤0.05为差异具有统计学意义。
两组患者均顺利完成手术,手术成功率100%。两组患者围手术期观察指标比较,与CEA组相比,CAS组住院费用较高(P=0.000),术后发生低血压(P=0.022)、心动过缓(P=0.022)、新发DWI高信号(P=0.000)比例较高;
而术后降压药物应用、高灌注状态、脑高灌注综合征、心肌梗死、短暂性脑神经损伤、围手术期脑卒中和术后30 d mRS评分差异均无统计学意义(P>0.05,表2)。
CEA组与CAS组患者手术前后心率差异有统计学意义(P=0.000),不同观察时间点两组患者心率差异亦有统计学意义(P=0.048;
表3,4)。其中,CEA组患者术后第1天心率较术前明显升高(P=0.000),之后逐渐下降,术后第2和3天仍高于术前(P=0.000,0.003),术后第4天降至术前水平(P=0.393);
CAS组患者术后第1天心率较术前明显降低(P=0.000),之后逐渐升高,术后第2天仍低于术前(P=0.005),术后第3和4天升至术前水平(P=0.142,0.228;
表5)。
无论是颈动脉内膜切除术还是颈动脉支架成形术,患者收缩压差异无统计学意义(P=0.094),仅舒张压差异有统计学意义(P=0.012);
出院时收缩压(P=0.001)和收缩压(P=0.020)均低于入院时且差异有统计学意义(表6,7)。
CEA组与CAS组患者手术前后患侧(P=0.008)和健侧(P=0.000)CBF值差异均有统计学意义,不同观察时间点两组患者患侧(P=0.000)和健侧(P=0.000)CBF值差异亦有统计学意义(表8,9)。其中,CEA组术后第3天(P=0.000)和第7天(P=0.001)患侧CBF值均较术前升高,术后第3天健侧CBF值较术前升高(P=0.000)、第7天恢复至术前水平(P=0.103);
CAS组术后第3和7天患侧(P=0.000,0.000)和健侧(P=0.000,0.000)CBF值均较术前升高(表10)。
表3 CEA组与CAS组患者手术前后心率的变化(±s,次/min)Table 3. Changes of heart rate between CEA group and CAS group before and after operation(±s,time/min)

表3 CEA组与CAS组患者手术前后心率的变化(±s,次/min)Table 3. Changes of heart rate between CEA group and CAS group before and after operation(±s,time/min)
CEA,carotid endarterectomy,颈动脉内膜切除术;
CAS,carotid artery stenting,颈动脉支架成形术
?

表4 CEA组与CAS组患者手术前后心率比较的重复测量设计的方差分析表Table 4. Repeated measurement design analysis of variance table for the comparison of heart rate between CEA group and CASgroup before and after operation

表5 同一处理组不同观察时间点心率的两两比较Table 5. Pairwise comparison of heart rate at different observation times in same treatment group
本研究结果显示,单侧颈动脉狭窄患者颈动脉内膜切除术和颈动脉支架成形术后早期CBF值即发生变化,颈动脉内膜切除术后第3天CBF值上升幅度较颈动脉支架成形术大,这种现象可能与CBF的调节机制及颈动脉内膜切除术和颈动脉支架成形术手术方式有关。颈动脉狭窄患者的动脉壁膨胀性降低,同时斑块厚度也会妨碍动脉管腔压力的传递,从而导致压力感受性反射敏感性下降。采用颈动脉内膜切除术切除增厚的内膜及部分中膜,使动脉壁变薄变弱,在相同压力下,可以导致更多的膨胀,从而使得压力感受器刺激增加[16-17],脑血流量增加。但也有相反的观点,认为颈动脉内膜切除术引起压力感受性反射敏感性降低[18-20]。在颈动脉支架成形术过程中,由于球囊扩张和支架植入,压迫颈动脉窦的压力感受器,引发颈动脉窦压力反射,神经冲动发送至脑干,出现术中、术后血压和心率下降。同时支架植入后还可引起颈动脉壁顺应性和压力感受性反射敏感性改变[21-22]。
本研究CEA组患者入院时和出院时血压无明显差异;
而CAS组出院时收缩压明显低于入院时,提示对于单侧颈动脉狭窄患者,颈动脉内膜切除术对血压的影响较颈动脉支架成形术小。研究发现,与单纯药物治疗相比较,颈动脉支架成形术对术后1年患者血压的长期控制有明显改善作用[23-24],与本研究结果相符。此外有研究显示,支架植入术后6小时收缩压的降低可以预测术后1年收缩压的降低[23]。还有研究发现,尽管颈动脉支架成形术和颈动脉内膜切除术后血压和心率均保持相对稳定,但与术前相比,颈动脉支架成形术后第1年的降压药数量有所减少[25]。因此对于接受颈动脉支架成形术且口服多种降压药的患者,术后应密切监测血压,及时更改降压方案[25]。
本研究结果显示,两组患者手术前后心率差异具有统计学意义,不同观察时间点两组患者心率差异亦有统计学意义,其中,CEA组患者术后第1天心率较术前明显升高,之后逐渐下降,术后第2和3天仍高于术前,术后第4天降至术前水平;
CAS组患者术后第1天心率较术前明显降低,之后逐渐升高,术后第2天仍低于术前,术后第3和4天升至术前水平。颈动脉内膜切除术后第1天心率较高可能与此组患者全部行气管插管全身麻醉,术后常规回重症监护病房至少监护1天存在一定关系。但是其具体机制有待于进一步探索。
表6 CEA组与CAS组患者手术前后血压的变化(±s,mm Hg)Table 6. Changes of blood pressure between CEA group and CAS group before and after operation(±s,mm Hg)

表6 CEA组与CAS组患者手术前后血压的变化(±s,mm Hg)Table 6. Changes of blood pressure between CEA group and CAS group before and after operation(±s,mm Hg)
CEA,carotid endarterectomy,颈 动 脉 内 膜 切 除 术;
CAS,carotid artery stenting,颈动脉支架成形术
?

表7 CEA组与CAS组患者手术前后血压比较的重复测量设计的方差分析表Table 7. Repeated measurement design analysis of variance table for the comparison of blood pressure between CEA group and CAS group before and after operation
本研究颈动脉内膜切除术和颈动脉支架成形术后早期血压和心率动态变化趋势与CBF值基本相似,与颈动脉窦压力感受性反射敏感性变化相关。颈动脉内膜切除术后高血压、心率增快较多见,而颈动脉支架成形术后低血压、心动过缓较多见,这也能解释颈动脉内膜切除术后CBF值明显高于颈动脉支架成形术;
但至术后第7天CBF值、心率和血压基本趋于稳定,并且无长期并发症。大型随机对照临床试验显示,颈动脉支架成形术患者治疗后30天内发生脑卒中的风险高于颈动脉内膜切除术患者[5-7,26]。本研究CAS组术后有17例(70.83%)出现新发DWI高信号,而CEA组仅1例(5.26%),差异有统计学意义。此部分患者绝大多数无症状,仅CAS组1例出现视物眩晕、眼球震颤。新发DWI高信号产生的主要原因可能为颈动脉支架成形术中操作引起斑块破裂、脱落形成微栓子所致[27-28],也有学者认为是术后持续的微栓子脱落所致[29],其具体原因及机制目前尚不明确,待进一步探索。
表8 CEA组与CAS组患者手术前后双侧CBF值的变化[±s,ml/(100g·min)]Table 8. Changes of bilateral CBF values before and after operation between the CEA group and the CAS group[±s,ml/(100 g·min)]
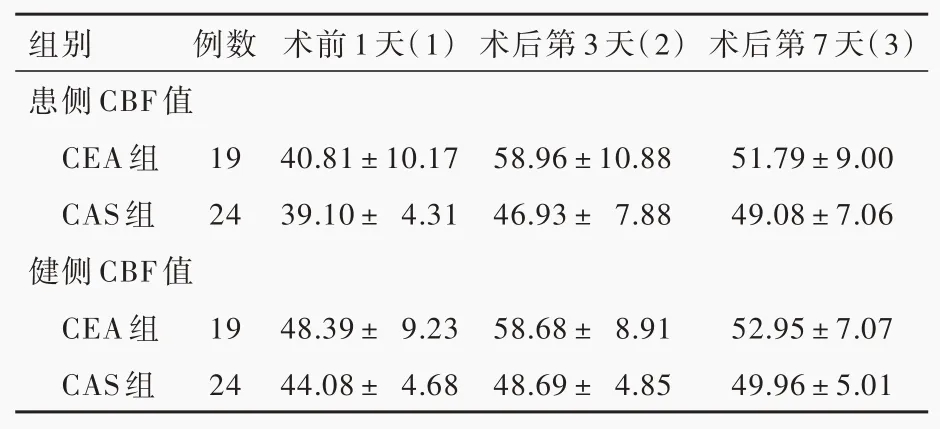
表8 CEA组与CAS组患者手术前后双侧CBF值的变化[±s,ml/(100g·min)]Table 8. Changes of bilateral CBF values before and after operation between the CEA group and the CAS group[±s,ml/(100 g·min)]
CBF,cerebral blood flow,脑血流量;
CEA,carotid endarterectomy,颈动脉内膜切除术;
CAS,carotid artery stenting,颈动脉支架成形术
?

表9 CEA组与CAS组患者手术前后双侧CBF值比较的重复测量设计的方差分析表Table 9. Repeated measurement design analysis of variance table for the comparison of bilateral CBF values between CEA group and CAS group before and after operation
尽管笔者研究团队术后常规控制血压,但仍发生脑高灌注综合征,其中,CEA组2例(10.53%)、CAS组1例(4.17%),经脱水、降压等对症处理,症状缓解,未出现脑出血等严重并发症。有文献报道,颈动脉内膜切除术后脑高灌注综合征发生率为0.4%~14%,而颈动脉支架成形术后脑高灌注综合征发生率为0.44%~11.7%[30],与本研究结果相符。此外,CEA组有2例(10.53%)出现短暂性脑神经损伤,出院时均已缓解。颈动脉内膜切除术与支架成形术进行血管重建试验(CREST)研究显示,颈动脉内膜切除术致脑神经损伤发生率为4.60%(53/1151),有33.96%(18/53)的患者在1个月随访时缓解,80.77%(42/52)的患者在1年随访时缓解,且1年随访时未发现脑神经损伤相关生活质量改变[31]。同时该项研究还发现,颈动脉内膜切除术患者心肌梗死发生率明显高于颈动脉支架成形术(2.3%对1.1%,P=0.03)[32-33]。本研究CEA组有1例(5.26%)出现心肌梗死,经治疗后缓解;
而CAS组无心肌梗死患者,可能与本研究样本量较小有关。基于此,我们应根据患者实际情况选择合适的治疗方案。同时,本研究还发现,颈动脉支架成形术患者的住院费用是颈动脉内膜切除术的2倍,提示在我国目前大部分地区医疗保险制度尚不完善的情况下,颈动脉内膜切除术仍是较好的选择。
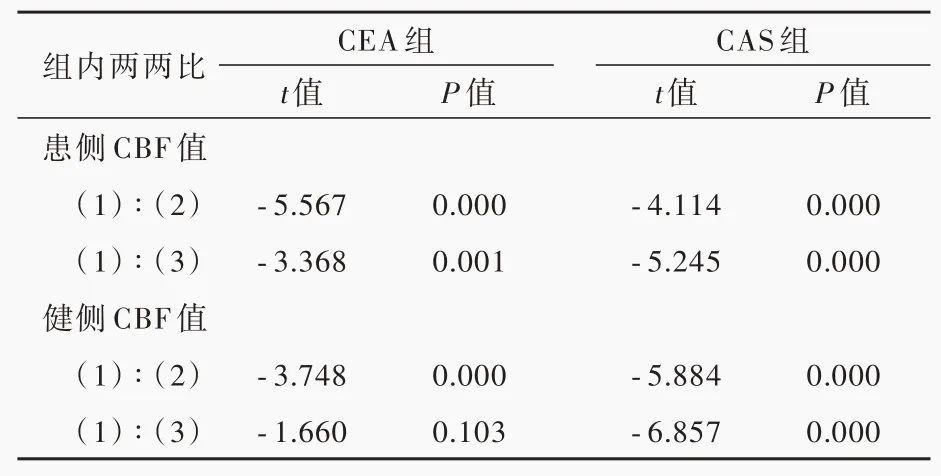
表10 同一处理组不同观察时间点双侧CBF值的两两比较Table 10. Pairwise comparison of bilateral CBF values at different observation times in the same treatment group
本研究尚存在一定的局限性:(1)样本量较小。(2)未对患者进行认知功能评价。(3)术后30天随访时,部分患者未至门诊复查MRI。(4)未进行长期随访(大多数患者来自外地,长期随访相对困难)。
综上所述,颈动脉内膜切除术和颈动脉支架成形术早期CBF值、心率和血压变化存在差异,应针对不同人群选择适宜的个体化治疗方案,以达到较好的治疗效果。与颈动脉支架成形术相比,颈动脉内膜切除术患者住院费用少,在经济欠发达、医疗保险制度不完善地区,对于同样适合颈动脉内膜切除术和颈动脉支架成形术患者,颈动脉内膜切除术可能仍是比较好的选择。
利益冲突无
猜你喜欢 成形术颈动脉内膜 牛子宫内膜炎病因与治疗今日畜牧兽医(2022年10期)2022-12-23MTHFR C677T基因多态性与颈动脉狭窄及其侧支循环形成的关系昆明医科大学学报(2022年2期)2022-03-29单纯慢性化脓性中耳炎患者行鼓膜成形术治疗的效果观察中国药学药品知识仓库(2022年1期)2022-03-23子宫内膜病变超声与病理类型的相关性分析*西部医学(2021年9期)2021-09-28经皮椎体成形术中快速取出残留骨水泥柱2例报道中华骨与关节外科杂志(2021年12期)2021-08-31基于深度学习的颈动脉粥样硬化斑块成分识别成都信息工程大学学报(2021年2期)2021-07-22超声评价颈动脉支架植入术后支架贴壁不良的价值血管与腔内血管外科杂志(2021年2期)2021-06-19椎体后凸成形术治疗老年骨质疏松脊柱压缩骨折中国药学药品知识仓库(2021年18期)2021-02-28经皮椎体后凸成形术的麻醉方式的现状及展望现代临床医学(2021年1期)2021-01-26异常子宫出血,是子宫内膜息肉惹的祸吗中国生殖健康(2020年7期)2021-01-18推荐访问:颈动脉 内膜 动力学