营养液浓度对盆栽蓝莓生长结果及果实品质的影响
来源:优秀文章 发布时间:2023-01-24 点击:
王华圣,杨海燕,吴文龙,闾连飞,樊苏帆,李维林
(1 南方现代林业协同创新中心/南京林业大学林学院,南京,210037;
2 江苏省中国科学院植物研究所,南京,210014)
蓝莓为杜鹃花科(Ericaceae)越桔属(Vaccinium)小浆果类果树[1]。全世界越桔属植物大约有400多种,主要分布在北美洲、欧洲、东北亚等北半球温带寒带气候区。目前,蓝莓产业在我国已经初具规模。有研究认为,在无土基质栽培模式下,合理的施肥可以促进蓝莓生长,提高蓝莓产量和品质,进而提升蓝莓种植的经济效益[2]。推测,无土基质栽培可能成为蓝莓产业发展的趋势。本研究以南高丛蓝莓品种“夏普蓝”(Sharpblue)为试验材料,研究在无土基质栽培模式下不同浓度霍格兰溶液对其生长发育、结果和果实品质的影响,筛选结果期最佳的营养液施用浓度,以期为蓝莓无土栽培中营养液的配制及合理使用提供参考。
1.1 研究材料及试验设计蓝莓南高丛类型品种“夏普蓝”2年生结果树,于2018年3月盆栽定植。盆栽基质为椰糠,每盆1株,盆的上口径27.5 cm、底径22 cm、高31 cm,每盆装约10 L椰糠。3月至4月上旬进行常规施肥管理,期间主要使用大量元素水溶性肥料(恒丰宝,N∶P∶K=1∶1∶1),每2天浇灌一次,每次每株500 mL。4月中旬停止施肥,直至5月初,期间根据基质失水情况,及时补充水分至基质含量达到70%左右。从5月初现蕾时开始分别以不同浓度霍格兰溶液进行浇灌,每2 d浇灌一次,每株每次浇500 mL,上午8:30—9:00浇灌,直至果实成熟,共60 d,期间不再施用其他肥料,并根据基质失水情况及时补充水分至基质含水量达到70%左右。设3个处理:50%、100%和150%霍格兰溶液。100%霍格兰溶液配方:Ca (NO3)2·4H2O 945 mg/L+KNO3505 mg/L+ NH4NO380 mg/L+ KH2PO4·2H2O 136 mg/L+ MgSO4·7H2O 493 mg/L,含N 112 mg/L、Ca 160 mg/L、N 70 mg/L、K 195 mg/L、N 28 mg/L、P 31 mg/L、K 39 mg/L、Mg 48 mg/L、S 64 mg/L。50%霍格兰溶液由100%霍格兰溶液配方各物质浓度减半形成。150%霍格兰溶液由100%霍格兰溶液配方各物质浓度增加50%形成。每处理5株(盆)一小区,重复3次,共15株(盆)。每15 d随机取样测定相关指标,即分别于处理第0 天、第15天、第30天、第45天和第60天进行取样。
1.2 测定方法植株生长量及产量:植株高度和冠幅用精度为1 cm的卷尺测定;
茎粗用精度为0.01 mm的数显游标卡尺测量;
每次采集成熟果实后,以单株为单位计数,用感量为10 mg的电子天平称量,直至果实全部成熟,累计计算单株结果数和产量。
叶片叶绿素含量:采用95%乙醇浸提法[3]测定。叶片除去粗大叶脉后,称取0.2 g鲜样放入研钵中加少许液氮研磨成粉,加入95%乙醇4 mL,将匀浆转入离心管,用95%乙醇定容至8 mL。取浸提液,在波长665 nm、645 nm和470 nm处测定吸光值。
叶片超氧阴离子自由基(O2·-)产生速率:采用羟胺氧化反应法[4]测定。称取叶片0.2 g,置于预冷的研钵中,加入2 mL 0.05 mol/L磷酸缓冲液(pH值7.8),在冰上研磨成匀浆,转入10 mL塑料离心管中,用0.05 mol/L磷酸缓冲液定容至8 mL,4 ℃、8 000 转/min离心10 min,取上清液待测。取待测液25 μL,加入25 μL 0.05 mol/L磷酸缓冲液稀释后,依次加入50 μL氯化羟胺、50 μL磺胺和50 μL萘胺,静置20 min后,测定波长530 nm处吸光值。
叶片丙二醛(MDA)含量:参照Heath和Packer的硫代巴比妥酸法[5]进行测定。称取0.25 g硫代巴比妥酸试剂溶于50 mL 10%三氯乙酸,制成试剂混合液。称取0.2 g叶片鲜样放入研钵中加少许液氮研磨成粉待测。取1 mL试剂混合液、1 mL待测液在试管中混合,封口后沸水浴30 min,冷却后测定波长532 nm和600 nm处吸光值。
叶片H2O2含量:采用H2O2试剂盒测定。
叶片SOD活性:参照Beyer和Fridsovich的黄嘌呤氧化酶法[6]进行测定。在试管依次加入1.5 mL 50 mmol/L磷酸缓冲液(pH值7.8)、0.3 mL 130 mmol/L甲硫氨酸、0.3 mL 750 μmol/L NBT、0.3 mL 100 μmol/L EDTA-Na、0.3 mL 20 μmol/L核黄素溶液、0.05 mL粗酶提取液、0.25 mL蒸馏水。充分混匀后,放置于4 000 lx的探照灯下反应20 min。以添加0.05mL 50 mmol/L的磷酸缓冲液(pH值7.8)为空白对照,用酶标仪测定波长560 nm下的吸光度。
叶片抗坏血酸(AsA)及还原型谷胱甘肽(GSH)含量:称取0.2 g叶片鲜样,加入4 mL 5%三氯乙酸,研磨成匀浆,转移到10 mL离心管中,4 ℃、8 000 转/min离心10 min,取上清液定容至5 mL,待测。AsA含量的测定参照陈建勋等[7]的方法,取待测液0.25 mL,分别加入0.2 mL 150 mmol/L磷酸缓冲液(pH值7.4)、0.2 mL蒸馏水,摇匀后依次加入10% 三氯乙酸(TCA)、44% H3PO4、4% 2,2’-联吡啶各0.4 mL和3%(m/v)FeCl30.2 mL,37 ℃水浴1 h,测定波长525 nm处吸光值。GSH含量的测定参照Anderson的方法[8],取待测液0.25 mL分别加入2.6 mL 150 mmol/L磷酸缓冲液(pH值7.7)、5,5’-二硫双(2-硝基苯甲酸)(DTNB) 0.18 mL,30 ℃下反应5 min,测定波长412 nm处吸光值。
果实大小:随机选取20个果实,用精度为10 mg的电子天平称量单果质量,用精度0.01 mm的数显游标卡尺测量横径和纵径,纵径与横径之比为果形指数。
果实硬度:采用日本竹村Cat No.9300(KM-5)型果实硬度计测定。测定时选择直径为5 mm的探头,以最大破裂的力度显示数值作为硬度值,单位为kg/cm2。随机选取15个待测果实测定,计算平均值。
果实可溶性固形物含量:采用WYT-A型手持糖度计测定。随机选取15个待测果实测定,计算平均值。
果实可滴定酸含量:采用自动电位滴定法[9]进行测定。称取4 g果实鲜样放入研钵,研磨成匀浆后加入35 mL蒸馏水,转入40 mL离心管中,超声辅助提取15 min,以蒸馏水定容至40 mL。量取20 mL试样于100 mL烧杯中,放置于ZD-2型自动电位滴定仪(南京科环分析仪器有限公司)上,记录滴定仪数显变化值及氢氧化钠溶液消耗量。
果实花色苷与多酚含量:称取4 g果实鲜样放入研钵,研磨成匀浆后加入35 mL 50%乙醇,超声辅助提取15 min,离心,上清液为多酚和花色苷提取液。总酚含量测定采用Folin-Ciocalteu法[10],取10 mL提取液,加入5 mL 0.2 mol/L Folin-Ciocalteu试剂,混匀后加入7.5%饱和碳酸钠溶液2 mL,常温下反应120 min,测定波长765 nm处吸光值。总花色苷测定采用pH示差法[11],取提取液于波长510 nm 和700 nm处测定吸光值,当pH值=1.0时两处均有最大吸收峰值;
当pH值=4.5时,花色苷转变为无色查耳酮形式,在波长510 nm处无吸收。
1.3 数据分析利用数据统计处理软件DPS 7.05进行单因素方差分析,多重比较采用Turkey法,检测水平为0.05。
2.1 植株生长量试验结果看出,不同浓度霍格兰溶液处理60 d,株高增量依次为150%处理>100%处理>50%处理,茎粗增量依次为150%处理≈100%处理>50%处理,冠幅增量依次为150%处理>100%处理≈50%处理组。综合看来,150%霍格兰溶液处理下植株生长量最大(见表1)。
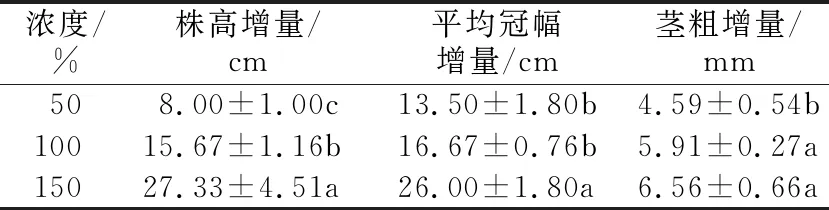
表1 不同浓度霍格兰溶液处理下蓝莓植株生长指标的增量
2.2 叶片叶绿素含量不同浓度霍格兰溶液处理第60天时,叶片叶绿素a、叶绿素b及叶绿素总量均表现为150%处理>100%处理≈50%处理(见表2)。

表2 不同浓度霍格兰溶液处理下蓝莓叶片叶绿素含量
2.3 叶片自由基与MDA含量不同浓度霍格兰溶液处理第60天时,叶片O2·-产生速率表现为50%处理>100%处理≈150%处理,H2O2含量表现为50%处理>100%处理>150%处理,MDA含量表现为50%处理≈100%处理>150%处理。综合来看,150%营养液浓度处理下,蓝莓表现出较强的抗氧化能力(见表3)。
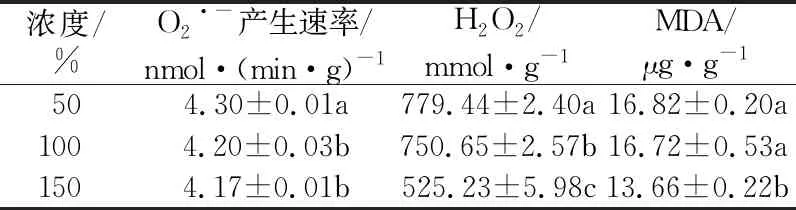
表3 不同浓度霍格兰溶液处理下蓝莓叶片自由基与MDA含量
2.4 叶片可溶性蛋白不同浓度霍格兰溶液处理60 d时,叶片可溶性蛋白表现为100%处理≈150%处理>50%处理(见图1)。

图1 不同浓度霍格兰溶液处理下蓝莓叶片可溶性蛋白含量
2.5 叶片SOD活性和GSH、AsA含量不同浓度霍格兰溶液处理60天时,叶片SOD酶活性表现为50%处理>100%处理>150%处理,各处理间叶片GSH含量无显著差异,叶片AsA含量表现为50%处理>150%处理≈100%处理(见表4)。

表4 不同浓度霍格兰溶液处理下蓝莓叶片SOD酶活性和GSH、AsA含量
2.6 果实产量不同浓度霍格兰溶液处理的单株结果数和单株产量均表现为150%处理≈100%处理>50%处理,蓝莓单株结果数量与产量呈显著正相关,150%处理与100%处理的产量相近,50%处理相比100%处理减产了25%。可见,霍格兰溶液浓度对单株结果数和单株产量有显著影响(见表5)。

表5 不同浓度霍格兰溶液处理下蓝莓的单株产量
2.7 果实膨大着果初期各处理的果实发育(横径、纵径、果形指数和单果质量)无显著差异,15 d后开始显现差异。第45天时,单果质量表现为150%处理≈100%处理>50%处理;
第60天时,100%处理单果质量仍显著大于50%处理。第45天时,果形指数表现为150%处理>100%处理≈50%处理;
第60天时,150%处理果形指数显著小于50%处理,50%处理果实更接近圆形(见表6)。

表6 不同浓度霍格兰溶液处理下蓝莓的果实大小及形状
2.8 果实品质第45天和第60天时,蓝莓果实硬度皆有随营养液浓度增高而增大的趋势,其中,150%处理显著高于50%处理。
第45天时,150%处理的果实可溶性固形物含量达到了12.48%,显著高于100%处理和50%处理;
第60天时,150%处理仍显著高于50%处理。
第45天时,果实可滴定酸含量表现为150%处理<100%处理<50%处理;
第60天时,150%处理仍显著低于50%处理。
第45天时,果实固酸比表现为150%处理>50%处理;
第60天时,果实固酸比表现为100%处理>50%处理。可见,相比50%处理,150%处理与100%处理的蓝莓果实口感偏甜些。
第45天和第60天时,果实花色苷含量均表现为150%处理>100%处理>50%处理。
第45天时,果实多酚含量表现为150%处理>50%处理>100%处理;
第60天时,表现为150%处理>100%处理>50%处理。
综上所述,在试验浓度范围内,蓝莓果实综合品质表现为随霍格兰溶液浓度增加而提升(见表7)。

表7 不同浓度霍格兰溶液处理下蓝莓果实的品质
本研究发现,150%霍格兰溶液处理更好地促进了蓝莓结果树的营养生长,株高、茎粗和冠幅增量显著大于50%霍格兰溶液处理。适宜的水肥条件能够提高植物叶片叶绿素含量与光合作用效率[12]。本研究发现,150%霍格兰溶液处理下蓝莓叶片叶绿素及可溶性蛋白含量均显著高于50%霍格兰溶液处理。这与王少希等[13]和孙美[14]发现高浓度霍格兰溶液处理下果树株高、主干茎粗、叶绿素含量和可溶性蛋白均高于低浓度处理的结论一致。150%霍格兰溶液处理下蓝莓叶片中O2·-产生速率、MDA和H2O2含量均最小,植株抵抗逆境的能力最强。总体来看,在150%霍格兰溶液处理下,蓝莓植株具有更好的生长势和更强的抗氧化能力。
无土栽培条件下合理的营养液配施对提高果实产量和品质具有重要作用[15-16]。150%霍格兰溶液处理下蓝莓单株结果数多、产量高,其次为100%霍格兰溶液处理,蓝莓结果数和产量均与霍格兰溶液浓度呈正相关。果实硬度是评价果实食用品质、贮藏性能、加工品质的一项重要指标[17]。150%霍格兰溶液处理下蓝莓果实硬度最高,说明较高浓度霍格兰溶液能够提高果实硬度。霍格兰溶液浓度对蓝莓盛果期和终果期果实的果形指数有影响,但无一致规律。可溶性固形物、可滴定酸、多酚和花色苷含量决定果实的营养价值和口感风味[18]。本研究发现,总体上看,蓝莓果实内在品质与霍格兰溶液浓度呈正相关,150%霍格兰溶液更有利于蓝莓果实品质的形成。
综合分析认为,高浓度霍格兰溶液有利于蓝莓树体生长发育、结果和果实品质形成,在蓝莓结果期应以150%霍格兰溶液为宜。
猜你喜欢 缓冲液蓝莓单株 通径分析在芸豆品种筛选中的应用探讨南方农业(2022年17期)2022-10-21无为市太平山枫香树不同单株叶片性状多样性分析安徽农学通报(2022年6期)2022-04-07SEMA3A、SEMA3B蛋白免疫组化染色中抗原修复方法的优化临床与实验病理学杂志(2021年10期)2021-12-13新型醋酸纤维素薄膜电泳缓冲液的研究中国科技纵横(2021年24期)2021-03-02苏格兰:种植者呼吁推广本地蓝莓中国果业信息(2020年8期)2020-12-16提取缓冲液对桑叶中生理生化指标测定的影响*蚕桑通报(2020年1期)2020-07-10西北地区芝麻单株产量与农艺性状的相关性与通径分析种子(2020年4期)2020-05-20福鼎大白茶有性系后代优良单株品比试验初报广西农学报(2019年1期)2019-07-18西海岸的蓝莓名片商周刊(2017年5期)2017-08-22甜甜的蓝莓果作文周刊·小学一年级版(2017年26期)2017-08-10推荐访问:蓝莓 盆栽 浓度