基于网络药理学及分子对接研究三七总皂苷治疗肾纤维化的作用机制
来源:优秀文章 发布时间:2022-12-06 点击:
龚铭炯 白俊其 徐 文 宫 璐 丘小惠 黄志海 张 靖
(广州中医药大学第二临床医学院,广东省中医药科学院,中国中医科学院广东分院,广州,510006)
肾纤维化(Renal Fibrosis,RF)是慢性肾脏病进展到终末期肾衰的共同特征,包括原发性或继发性肾小球疾病、肾小管、肾间质、血管疾病等,表现为肾间质和肾实质的损伤,多是由于肾脏受到炎症、物理损伤、药物损害后,导致多种细胞因子和活性物质的产生、炎性细胞浸润、成纤维细胞活化、上皮细胞向间充质细胞转分化、细胞外基质(Extracellular Matrix,ECM)过度沉积等,重者引起组织结构破坏而发生器官硬化[1]。
三七(RadixNotoginseng)为我国传统名贵中药,用于治疗疾病已有悠久的历史,主要用于冠心病、心绞痛等心脑血管系统疾病的治疗[2]。三七药材中主要含有达玛烷型四环三萜母核结构的皂苷类成分,其中以人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re、三七皂苷R1、人参皂苷Rd的含量较高[3]。近年来,三七药材及三七总皂苷(PanaxNotoginsengSaponins,PNS)在治疗RF方面具有较好的临床疗效[4-5]。药理学研究发现,其作用机制主要包括:减少炎症细胞的聚集,下调肾组织中RF相关性因子表达,抑制整合素、纤维化标志物转化生长因子(Transforming Growth Factor,TGF)-β1的表达,抑制肾小管上皮细胞转分化,抑制人肾间质肌成纤维细胞的增殖,调节并减少ECM的积聚等[6]。
中药网络药理学整合系统生物学、高通量筛选、多向药理学、计算生物学和网络分析等多种技术手段,以整体观、系统观的角度探寻“疾病-基因-靶标-药物”间的关联性,是一种寻找中药复方潜在药效物质和作用靶点,提高药物发现效率的新策略,契合中药多成分、多途径、多靶点的协同作用特点及整体观[7-10]。分子对接则是通过预测及模拟评价受体大分子及药物分子之间的结合模式和亲合力,可应用于基于特定靶标的中药及复方的药效物质筛选研究[11]。
药物经传输途径入血、代谢、分布并产生生物效应,因此入血成分才是最终的“效应成分”,它是药效物质传递体系的最终环节[12]。本课题组前期利用液相质谱联用技术对三七药材的化学成分进行系统性分析[13]。本研究采用网络药理学预测方法及分子对接技术,基于从入血成分-靶点对应性分析,找寻中药有效性表征的化学成分构成,对PNS的潜在质量标志物进行研究,阐明PNS治疗RF的药效物质基础及作用机制,为制定反映内在质量的控制标准奠定科学的依据。
1.1 材料
1.1.1 动物 选取8周龄雄性SD大鼠10只,体质量(220±20)g,由南方医科大学实验动物中心提供,许可证号:SYXK(粤)2018-0094。饲养温度(25±2)℃,相对湿度(50±5)%,自由饮水及饮食。本研究经广东省中医院实验动物伦理委员会批准(伦理审批号:2019056)。
1.1.2 药物 对照品人参皂苷Rb1(批号:110704-201827)、Rg1(批号:110703-201832)、Re(批号:110754-201827)与三七皂苷R1(批号:110745-201820)购自中国食品药品检定研究院。三七皂苷R2、人参皂苷Rf、Rh1、Rg2、Rb2、Rb3和Rd由中国科学院上海药物研究所朱大元教授提供。PNS为实验室自制,三七总皂苷含量>90%。取适量,加水溶解,配制成2.3 g/L溶液。
1.1.3 试剂与仪器 甲醇(Merck公司,德国,货号:SHBN6011);
乙腈(Merck公司,德国,货号:I1153107122);
超纯水由水纯化系统(锐思捷水纯化技术有限公司,型号:RODI-220B1)制得;超高压液相色谱仪(Thermo-fisher公司,美国,型号:Accela),通过电喷雾离子源(Electrospray Ionization,ESI)与四级杆-静电场轨道阱高分辨质谱仪(Thermo-fisher公司,美国,型号:Q-Exactive)连接;高速冷冻离心机(Sigma公司,德国,型号:3K15);电子天平(Mettler toledo公司,瑞士,型号:AB135-S)。
1.1.4 数据资料 本研究涉及靶点蛋白UniProt数据库(http://www.uniprot.org/)、蛋白质结构数据库PDB(https://www.rcsb.org/)、PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)[14]、CooLGeN数据库(http://ci.smu.edu.cn/CooLGeN/)和人类基因数据库(GeneCards,https://www.genecards.org/)、蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)STRING数据库(https://string-db.org/)、生物信息学DAVID数据库(https://david.ncifcrf.gov/);分析软件采用网络拓扑分析软件Cytoscape 3.2.1、分子三维结构显示软件Pymol 2.3.2、化学结构转换软件Open Babel 2.3.1、POCASA在线预测蛋白活性口袋(http://g6altair.sci.hokudai.ac.jp/g6/service/pocasa/)、分子对接软件AutoDock1.5.6及AutoDock Vina[15]。
1.2 方法
1.2.1 色谱与质谱条件 色谱柱为CORTECS C18(100 mm×2.1 mm,1.6 μm)色谱柱;流动相为水(A)、乙腈(B),梯度洗脱程序:0~3 min(12% B→22%B),3~9 min(22%B→40%B),18~19 min(40%B→95%B);柱温:25 ℃;流速:250 μL/min;进样体积:2 μL。质谱采用电喷雾离子源负离子模式,离子源参数设置如下:鞘气(N2)44 psi,辅助气8 psi,喷雾电压2.7 kV,毛细管温度350 ℃;样品先采用高分辨质谱全扫描,质量范围为m/z 300~1 450;二级质谱采用动态数据依赖性扫描,分辨率为Full Scan 70 000 FWHM,MS/MS 15 000 FWHM。使用Xcalibur 3.0软件进行质谱数据处理,通过高分辨质谱信息推导其可能的分子式,采用前期实验室已建立的三七化学成分质谱数据库,结合化合物的一级、二级质谱及裂解规律进行分析和鉴别。
1.2.2 给药及样本处理 适应性喂养1周,给药前禁食不禁水12 h。将大鼠随机分为2组(n=5),给药组灌胃给予三七总皂苷提取液,给药体积0.01 mL/g,空白组灌胃相同体积水,连续给药3 d。末次给药1 h后,10%水合氯醛麻醉,腹主动脉取血7 mL,室温放置30 min,待充分凝血后,以3 000 r/min,离心半径7 cm,离心15 min。吸取上清液1.0 mL,加入4 mL乙腈,于离心管中充分涡旋1 min,以15 000 r/min,离心半径7 cm,离心15 min。吸取上清液,用氮气吹干,用0.5 mL12%乙腈溶液充分溶解残留物,过0.22 μm微孔滤膜,得血清供试品溶液。
1.2.3 靶标蛋白筛选 采用反向药效团匹配的方法将检测到的PNS的入血成分以*.mol2格式上传到PharmMapper系统,将蛋白种类设定为Human Protein Targets Only,其他参数均设置为默认。提交后获得PDB ID、靶点名称(Target Name)和得分(Fit Score),其中Fit Score为分子和靶点的匹配度,数值越高代表越匹配。选取fit score>3的靶点蛋白作为化合物的靶标蛋白,输入UniProt数据库,校正靶点名称为相应基因简称,经检索和转化操作获取与成分相关的潜在作用靶点。通过在CooLGeN和GeneCards数据库中输入关键词“Renal Fibrosis”搜索与CGN相关的基因,并去除重复和假阳性基因。
1.2.4 PPI网络构建 将药对的潜在靶点导入STRING数据库,限定物种为人,进行PPI分析。选取0.7的高置信度保证数据的可靠性,保存结果。将导出文件中的Node1、Node2和Combined Score信息导入Cytoscape软件进行可视化分析,并将节点大小设置用于反映度(Degree)值的大小,边(Edge)的粗细设置反映Combined Score的大小。
1.2.5 靶点的通路分析 在DAVID网站导入得到的潜在作用靶点,限制物种为人,进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析,分析结果以P值小于0.05为指标筛选。应用在线绘图软件E Chat对KEGG分析结果进行可视化处理。将入血成分预测出的31个作用靶点通过DAVID数据库进行GO分析和KEGG分析。GO富集分析结果包括生物过程(Biological Process,BP)、细胞组分(Cellular Component,CC)、分子功能(Molecular Function,MF)。
1.2.6 活性成分-靶点-通路-疾病网络构建 根据上述20个入血活性成分的靶点筛选及通路分析结果,采用Cytoscape软件构建三七总皂苷“活性成分-靶点-通路-疾病”网络。其中,以不同的节点(Node)分别表示活性成分、靶蛋白、通路、疾病4类节点,用边(Edge)表示它们之间的相互关系,构建网络探讨PNS多成分、多靶点和多通路之间的相互作用机制。绿色三角代表黄芪活性成分,橙色菱形代表三七活性成分,绿色圆形代表靶点,紫色方形代表通路。
1.2.7 活性成分与关键靶点验证 选择PPI中度值排名前11位中的靶点蛋白结构,与PNS入血成分进行反,向分子对接模拟计算,采用Pymol、AutoDock、Open Babel等软件分别对靶蛋白及配体分子进行格式转化及预处理,构建活性口袋(结合原配体并检索POCASA预测蛋白活性口袋),使用Autodock Vina软件进行分子对接筛选,获取反映活性成分与各个靶点蛋白亲和力分数(对接打分函数结果为结合自由能△G,单位为kcal/mol)和对接构象相互作用。结果选取结合自由能≤-10.0 kcal/mol(1 cal=4.184 J)的结合构象,使用Pymol软件进行可视化处理。
2.1 PNS色谱图建立与入血成分分析 PNS及空白组、给药组的大鼠血清样品进行了定性分析,3种样品的总离子流图见图1。由于血液中的内源性代谢物也同时有良好的响应,对含量较低的PNS入血成分干扰明显,在色谱图上难以直接发现其入血成分。入血的原形成分既存在于给药血清中又存在于PNS中,因此比对PNS及给药组血清的色谱图,通过对PNS中主要成分的准分子离子峰为基峰的离子流图进行提取,并比对保留时间,对照品图谱及二级色谱图,在给药血清中分析并鉴定了20种入血的皂苷类成分。见表1。入血成分的精确相对分子质量误差均小于5×10-6。

表1 三七总皂苷入血成分的LC-MS数据及鉴定
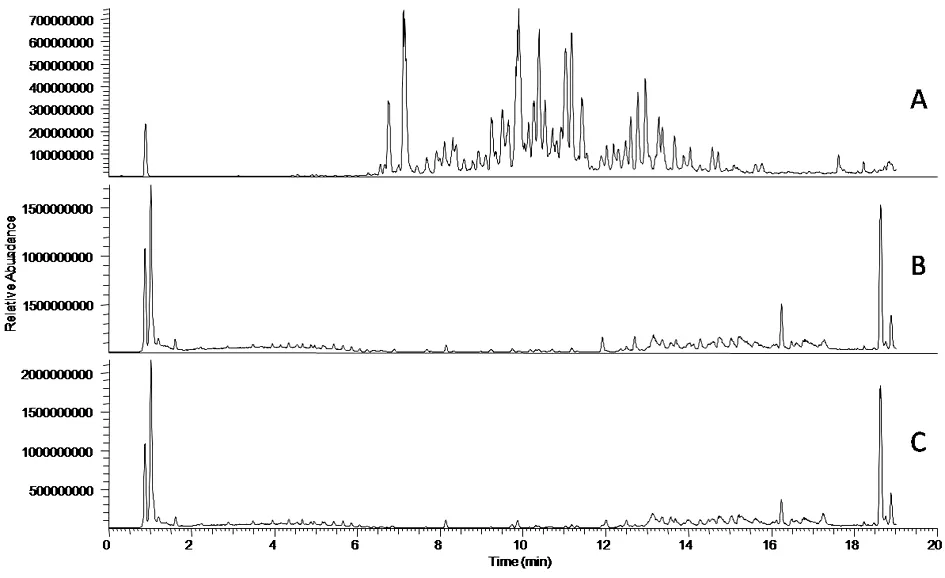
图1 三七总皂苷(A),空白血清(B)和给药血清(C)的负离子模式总离子流图
2.2 网络药理学结果
2.2.1 靶标蛋白筛选 将采用反向药效团匹配方法得到的成分靶点,删除重复及去除假阳性,整合得到成分作用靶点272个,与CooLGeN和GeneCards数据库中筛选的RF相关的基因1 498个取交集,汇总得到31个与PNS入血成分治疗RF相关的潜在作用靶点。见表2。

表2 与三七总皂苷入血成分治疗肾纤维化相关的潜在作用靶点
2.2.2 PPI网络分析 图2中节点表示蛋白,边表示蛋白之间的关联,其中节点的大小表示度值的大小,边的粗细表示Combined Score值的大小。其中度值大于5的蛋白包括AKT1(11)、EGFR(11)、MMP9(11)、SRC(10)、STAT1(10)、JAK2(8)、CASP3(7)、NOS2(6)、MMP2(6)、IL2(6)、MDM2(6)。

图2 靶蛋白PPI网络分析
2.2.3 靶点通路注释分析 根据错误发生率小于0.05,筛选出BP 50个(涉及信号转导、凋亡、增殖、基质分解、缺氧应答等);CC 12个(涉及细胞核、细胞外区、细胞质、胞浆等);MF 33个(涉及蛋白结合、锌离子结合、ATP结合、蛋白激酶活性、内肽酶活性、酶结合等)。取Count值大于5排序,结果如图3所示,BP富集的基因数靶点较多,说明PNS入血成分主要通过调节细胞生物过程发挥治疗RF的作用。KEGG分析共富集到51条信号通路,与RF相关主要涉及PI3K-AKT信号通路、Rap1信号通路、HIF-1信号通路、FoxO信号通路、Ras信号通路、雌激素信号通路、TNF信号通路等。选与RF相关的10个通路进行可视化。见图4。

图3 三七总皂苷入血成分作用靶点的GO富集分析

图4 三七总皂苷入血成分作用靶点KEGG富集分析的8条通路
2.2.4 “活性成分-靶点-通路”网络分析 该网络有64个节点(包括20个成分、31个靶点、10条通路和1个疾病)和560条边。节点的度值代表网络中与节点连接的路线数目,度值越大说明与之相连的节点数越多。表明三七总皂苷治疗RF的作用是多成分、多基因、多靶点协同作用的复杂过程。见图5。

图5 三七总皂苷治疗肾纤维化“成分-靶点-通路”网络
2.3 活性成分与靶蛋白对接分析 对20个PNS入血成分和11个潜在核心靶点进行分子对接,即受体为AKT1(PDB ID:6HHF)、EGFR(PDB ID:6S9B)、MMP9(PDB ID:IL6J)、SRC(PDB ID:1KSW)、STAT1(PDB ID:1YVL)、JAK2(PDB ID:3IO7)、CASP3(PDB ID:6OBL)、NOS2(PDB ID:3E7G)、MMP2(PDB ID:1RTG)、IL2(PDB ID:4NEM)、MDM2(PDB ID:6Q9H)。大部分的PNS入血成分与靶点有较高的结合活性,结构较为稳定。本研究结合能小于-5.0 kcal/mol的对接结果有219个,占99%;结合能小于-9.0 kcal/mol的对接结果有49个,占22%。本研究以≤-9.0 kcal/mol作为筛选标准,除M7、M9、M15外,其他17个入血成分与单个或多个受体结合活性较高,其中M5、M8、M11、M12、M16~M20与3个以上的受体结合活性较高。在11个靶点受体中,AKT-1、SRC、CASP3、NOS2与5个以上的成分结合活性较高。见图6。图7为选取结合能小于-10.0 kcal/mol的分子最接结果用Pymol软件进行可视化。
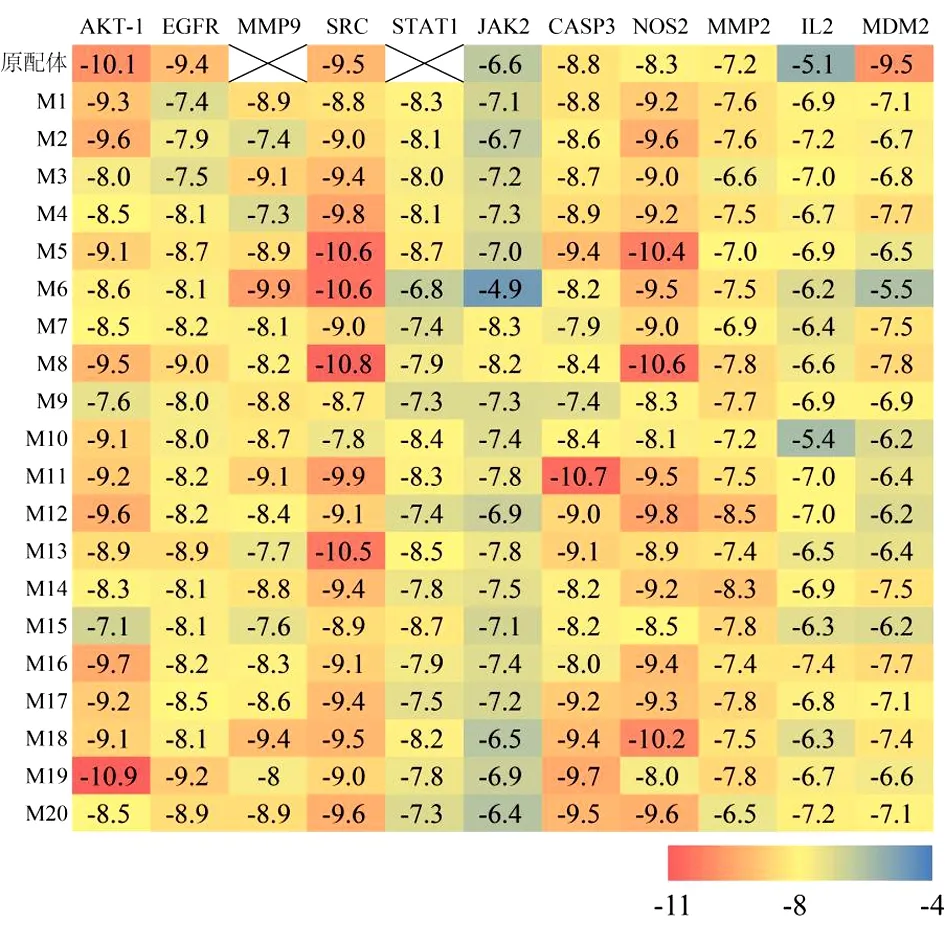
图6 分子对接结果的热图分析

图7 三七总皂苷抗肾纤维化靶蛋白-入血成分分子对接图
以往文献研究表明,有的三七皂苷类成分即是入血成分,也是其他主要成分的代谢产物[16-17]。一般认为,结合能小于0说明配体与受体可以自发结合,配体与受体的相互作用的亲和力越强则构象越稳定,所需的能量也越少,结合的可能性越大。经Vina筛选,根据得到的数据进行热图分析,结果见图6,红色越深代表结合自由能越低。
3.1 关键活性成分分析 三七皂苷类成分在肝脏、心脏、肾脏、肺等器官中发挥良好的抗纤维化作用,能有效减轻肌成纤维细胞的激活和增殖,抑制ECM的过度积累(包括胶原蛋白和纤维连接蛋白),减少氧化应激、炎症反应,以及纤维化标志物(尤其是TGF-β1),减少对实质细胞的损伤(包括凋亡和坏死变化)[18]。人参皂苷Rg1能明显抑制UUO诱导的肾纤维化,显著降低梗阻肾和TGF-β1诱导的大鼠肾小管细胞中α-平滑肌肌动蛋白(Alpha-smooth Muscle Actin,α-SMA)的表达,并通过降低血小板应答蛋白-1(Thrombospondin-1,TSP-1)表达和增加血管内皮生长因子表达来调节肾微血管完整性[19-21]。人参皂苷Rb1能有效抑制肾小管损伤及胶原沉积等导致的肾纤维化,降低TGF-β1水平并能通过AMPK/mTOR、PI3K/AKT/mTOR等通路抑制细胞自噬体形成和自噬聚集[22-24]。人参皂苷Rh2显著降低细胞凋亡指数,下调胶原的表达水平,切割胱天蛋白酶3,增加肾脏中Bcl-2的表达[25]。此外,PNS还可有效抑制炎症以及激活抗氧化活性从而减少肾损伤[26]。因此,三七总皂苷被视为治疗肾纤维化的一类有效成分。
在三七药材及PNS中,含量较高的成分主要为人参皂苷Rg1、Rb1、Re、Rd及三七皂苷R1等,研究显示这些成分的口服利用度较低。但除了口服后以原型的形式吸收入血外,这些成分还通过在消化道内脱去糖苷代谢为极性更小的活性成分并吸收入血[27]。在人及生物样品中,人参皂苷Rg1主要以代谢产物形式人参皂苷Rh1及人参皂苷F1存在;人参皂苷Rb1的可代谢为人参皂苷Rd、人参皂苷F2或Rg3、人参皂苷Rh2或CK;三七皂苷R1可代谢为三七皂苷R2及Rh1[28-29]。分子对接结果中,入血成分与潜在靶点之间99%均具有结合活性。其中人参皂苷Rb1、丙二酰人参皂苷Rb1、人参皂苷Rh2、人参皂苷Rg2、人参皂苷Rb3、人参皂苷Rb2、人参皂苷Rg3等与主要靶点AKT1、SRC、CASP3、NOS2的结合活性较强,这些成分有的即是PNS的入血成分,也是其他主要成分的代谢产物。含量较高的成分,如人参皂苷Rg1、Rb1及三七皂苷R1,除了自身与靶点具有较好的结合活性外,还通过代谢为极性更小的化合物而发挥更好的结合活性。
3.2 核心靶点及相关通路分析 本研究结果显示,PNS入血成分参与治疗RF的潜在核心靶点为AKT1、EGFR、MMP9、SRC、STAT1、JAK2、CASP3、NOS2、MMP2、IL2、MDM2等,核心靶点之间存在显著的相互作用关系,且与大部分入血成分显示出良好的结合活性。由KEGG通路富集分析可知,31个靶点共富集在10条与RF相关的通路上,入血成分通过这些信号通路上的相关靶点达到治疗RF的目的。这些信号通路主要影响细胞迁移、增殖、分化和凋亡,与炎症、缺氧、成纤维细胞活化、细胞外基质沉积等密切相关。其中,PI3K/AKT信号通路与RF相关的靶点数量最多。KEGG分析显示,入血成分能作用于上游的胰岛素样生长因子1受体、胰岛素受体、JAK激酶2、基质金属蛋白酶9、表皮生长因子受体、KIT、C-C基序配体5以及作用于蛋白激酶B1,通过上游RAS信号通路、趋化因子信号通路、Rap1信号通路等多途径调控或直接作用于PI3K/AKT信号通路,从而抑制细胞的生长、增殖,影响细胞周期。PI3K/AKT通路能作用于下游的HIF-1信号及FoxO信号通路,可调控细胞增殖、凋亡、迁移、自噬及氧化应激、免疫反应,从而调节纤维化,作用于肾脏细胞的稳态和存活,对RF起保护作用。
蛋白激酶B1、Src蛋白、胱天蛋白酶3、一氧化氮合酶2、表皮生长因子受体与多个成分有较高的结合活性。AKT是信号转导中主要的信号节点,小鼠蛋白激酶B1的缺失可减少肾纤维化和肾小管去分化,使单侧输尿管梗阻(Unilateral Ureteral Obstruction,UUO)小鼠肾脏中纤维连接蛋白和Ⅰ型胶原的表达显著增加,并增强人近端肾小管细胞(HK2细胞)中TGF-β1的表达及磷酸化信号转导及转录激活因子3的表达,促进肾小管细胞凋亡[30-31]。Src蛋白是一种非受体酪氨酸激酶,用化学抑制剂PP1失活后,通过抑制TGF-β1、PI3K/AKT和EGFR信号通路的激活,以及增加上皮细胞G2/M阻滞,可抑制肾成纤维细胞的活化和增殖,减少ECM沉积[32-33]。此外,PP1可抑制Src蛋白激活阻断肾小管上皮细胞内吞作用,增加基质金属蛋白酶-2活性,促进细胞凋亡及ECM降解[34]。胱天蛋白酶3在细胞内能特异性切割Gasdermin E蛋白产生氨基末端片段而引起细胞凋亡,特异性敲除胱天蛋白酶3能减轻肾小管损伤和炎症,防止肾小管损伤[35]。近端上皮中表皮生长因子受体的持续激活可导致自发性进行性肾小管间质纤维化,表皮生长因子受体激活下游的ERK、AKT,以及TGF-β1/SMAD通路,可促进上皮去分化、细胞周期阻滞及肌成纤维细胞的增殖[36-38]。诱导型一氧化氮合酶在肾间质纤维化中高度表达,其小分子抑制剂可降低一氧化氮合酶2表达以及TGF-β1/Smad3磷酸化[39]。蛋白激酶B1、Src蛋白、胱天蛋白酶3、表皮生长因子受体均视为目前治疗肾纤维化的潜在靶点。
综上所述,本研究以PNS口服吸收入血成分为研究对象,通过网络药理学方法分析了三七总皂苷治疗肾纤维化的主要作用靶点及通路,构建“活性成分-靶点-通路-疾病”网络,并运用分子对接方法对这些入血成分与潜在关键靶点的结合能力进行验证。研究结果表明,PNS是三七治疗肾纤维化的活性成分,其入血成分均呈现出与AKT1、SRC、CASP3、NOS2、EGFR等靶点良好的结合能力,从而通过多成分、多靶点、多途径的特点发挥治疗肾纤维化的作用,为后续的药理研究及药物开发提供了科学依据。
推荐访问:纤维化 药理学 对接