尿素含量测定方法的比较
来源:优秀文章 发布时间:2022-12-04 点击:
李颖,刘雁鸣,郑金凤,谢莹莹,张悦,刘杨,蒋赟(1.湖南省药品检验检测研究院,长沙 410001;
2.湖南省药品审查核验中心,长沙 410209;
3.国家药品监督管理局药用辅料工程技术研究重点实验室,长沙 410001)
尿素又称碳酰胺、脲,在临床上作为脱水药、利尿药及角质软化药等;
由于该药具有抗菌,使蛋白质溶解、变性,增加蛋白质水合,增加皮肤通透性等作用,作为辅料在药剂中主要用作透皮促进剂及助溶剂,以增加药物在水中的溶解度[1]。同时,尿素还可用于注射剂、口服制剂和外用制剂[2]。由于药用尿素的广泛应用,其需求量逐年上涨[3]。需对其含量测定《中国药典》(ChP2020)、欧洲药典(EP10.0)和日本药典(JP17)中均采用氮测定法[4-7],仅美国药典(USP43)中采用HPLC 法[8]。本文比较了凯氏定氮法、HPLC-CAD 法和HPLC-UV 法3 种测定尿素含量的方法,以寻找一种简便、有效、适用性高的方法。
1.1 仪器
凯氏定氮装置[4];
U3000 电喷雾高效液相色谱仪(CAD 检测器,赛默飞公司);
e2695高效液相色谱仪(UV 检测器,Waters 公司);
MS105DU 电子天平(瑞士Mettler-Toledo 公司)。
1.2 试药
尿素对照品(中国食品药品检定研究院,批号:100288-201903,纯度:99.8%);
缩二脲(麦克林,批号:C10871148,纯度:98%);
三聚氰酸(麦克林,批号:C10691090,纯度:98%);
缩三脲(上海旭东海普南通药业有限公司,批号:190601,纯度:99.0%);
乙腈(Merck 公司,批号:JA079030,色谱级);
收集尿素样品9 批;
水为实验室自制超纯水。
2.1 溶液配制
2.1.1 盐酸滴定液(0.2 mol·L-1) 取盐酸18 mL,加水至1000 mL,摇匀。按照ChP2020年版通则8006 盐酸滴定液标定。
2.1.2 系统适用性溶液 精密称取缩二脲、缩三脲、三聚氰酸和尿素适量,用75%乙腈溶解并稀释制成质量浓度分别为0.005、0.005、0.005(约相当于0.1%的浓度)和5.0 mg·mL-1的混合溶液,即得。
2.1.3 供试品溶液 取本品,加75%乙腈溶解并稀释制成每1 mL 中含0.2 mg 的溶液,摇匀,即得。
2.1.4 对照品溶液1 精密称取尿素对照品90.51 mg,至10 mL 量瓶中,加75%乙腈溶解并稀释制成每1 mL 中含9.033 mg 尿素的溶液,作为对照品储备液。精密量取对照品储备液适量,用75%乙腈稀释制成质量浓度为 90.33、135.49、180.65、225.82、451.64 μg·mL-1的线性系列溶液。
2.1.5 对照品溶液2 精密称取尿素对照品约96.71 mg,至10 mL 量瓶中,加75%乙腈溶解并稀释制成每1 mL 中含9.652 mg 尿素的溶液,作为对照品储备液。精密量取对照品储备液适量,用75%乙腈稀释制成质量浓度为96.52、144.77、193.03、241.29、482.58 μg·mL-1的线性系列溶液。
2.2 凯氏定氮法
参考ChP2020 四部尿素各论[4]下的含量测定项进行测定。
2.2.1 重复性测试 取同一批供试品(批号:20180301)共6 份,按ChP2020 四部的条件进行试验,结果见表1。

表1 重复性结果表(%)Tab 1 Repeatability (%)
2.2.2 含量测定 本品在ChP2020 中的限度为:含CH4N2O 不得少于99.5%。第一次含量考察结果6 份样品有3 份未达到要求;
根据其原理及试验操作过程[9-13],课题组认为是否消解完全会直接影响含量测定结果,第二次对尿素含量测定进行考察时,对上述可能存在的问题进行了排除。严格控制消解时火炉的火力大小,使样品一直处于沸腾状态,样品完全消解,结果均能符合限度要求,且滴定结果的平行性好(RSD=0.26%)。
2.3 HPLC-CAD 法
2.3.1 色谱条件 色谱柱:Waters XBridge Amide(4.6 mm×250 mm,3.5 μm);
流动相:乙腈-水(94∶6);
流速:1.0 mL·min-1;
柱温:30 ℃;
电喷雾检测器雾化温度:35℃;
进样量10 μL。
2.3.2 系统适用性试验 取空白溶剂(75%乙腈)及“2.1”项下系统适用性溶液、对照品溶液及供试品溶液各10 μL 注入液相色谱仪,按“2.3.1”项下色谱条件进样分析,记录色谱图。结果空白溶剂对主峰无干扰,各杂质峰之间以及与尿素主峰之间的分离度均满足要求。典型图谱见图1。
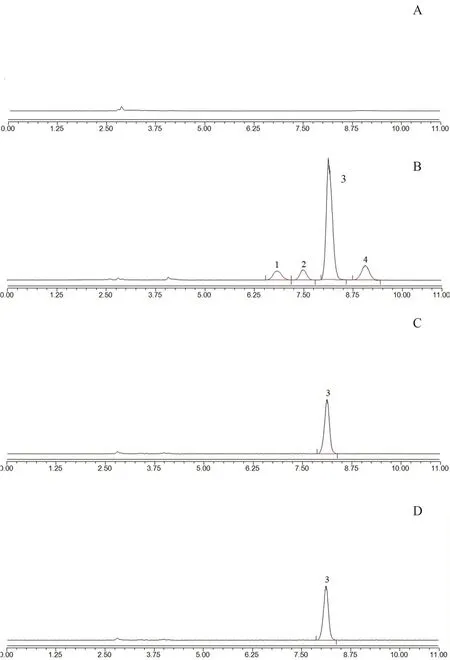
图1 HPLC-CAD 典型色谱图Fig 1 Typical chromatogram of HPLC-CAD
2.3.3 线性关系试验 精密量取“2.1.4”项下线性系列溶液各10 μL,进样测定,记录色谱图,以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,Y=0.013X-0.5595,R²=0.9997。结果表明,尿素在90.33 ~451.64 μg·mL-1内与峰面积的线性关系良好。
2.3.4 检测限和定量限 分别精密量取“2.1.4”项下对照品储备液适量,逐级稀释,精密吸取10 μL,注入液相色谱仪,记录色谱图。设定量限S/N=10,检测限S/N=3,结果检测限为0.0020 μg·mL-1,定量限为0.0067 μg·mL-1。
2.3.5 精密度试验 取同一批供试品溶液(批号:20180301),连续进样6 次,测得尿素峰面积的RSD(n=6)为0.56%,表明仪器精密度良好。
2.3.6 重复性试验 取同一批供试品(批号:20180301)共6 份,分别按“2.1.3”项下方法制备,进样测定,计算尿素的含量为99.11%,RSD为2.1%(n=6),表明方法的重复性良好。
2.3.7 稳定性试验 取同一批供试品溶液,于0、2、4、8、12 h 分别进样测定,记录色谱图,测得尿素峰面积的RSD为4.2%(n=5),表明供试品溶液在12 h 内稳定性良好。
2.3.8 回收试验 取同一批供试品(批号:20180301)共6 份,每份约0.25 g,精密称定,分别置于50 mL 量瓶中,加75%乙腈溶解并稀释至刻度,摇匀,精密量取0.5 mL,置25 mL 量瓶中,精密加入尿素对照品储备液(9.033 mg·mL-1)0.25 mL,加75%乙腈稀释至刻度,摇匀,作为回收率测定溶液,进样测定,计算尿素的平均回收率为99.15%,RSD为1.4%(n=6),表明本方法的回收率良好。
2.4 HPLC-UV 法
2.4.1 色谱条件 色谱柱:Waters XBridge Amide(4.6 mm×250 mm,3.5 μm);
流动相:乙腈-水(94∶6);
流速:1.0 mL·min-1;
检测波长:195 nm;
柱温:30℃;
进样量:10 μL。
2.4.2 系统适用性试验 取空白溶剂(75%乙腈)、系统适用性溶液、对照品溶液及供试品溶液各10 μL 注入液相色谱仪,按“2.4.1”项下色谱条件进样分析,记录色谱图。结果空白溶剂对主峰无干扰、各杂质峰之间以及与尿素主峰之间的分离度均满足要求。典型图谱见图2。

图2 HPLC-UV 典型色谱图Fig 2 Typical chromatogram of HPLC-UV
2.4.3 线性关系试验 精密量取“2.1.5”项下的线性系列溶液各10 μL,分别注入液相色谱仪,记录色谱图,以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,Y=3.4385×103X+1.9593×104,R²=0.9996。结果表明,尿素在96.52 ~482.58 μg·mL-1内与峰面积的线性关系良好。
2.4.4 检测限和定量限 分别精密量取“2.1.5”项下对照品储备液适量,分别逐级稀释,精密吸取10 μL,注入液相色谱仪,记录色谱图。设定量限S/N=10,检出限S/N=3,结果检测限为0.62 μg·mL-1,定量限为2.06 μg·mL-1。
2.4.5 精密度试验 取同一批供试品溶液(批号:20180301),按“2.4.1”项下的色谱条件连续进样6 次,记录色谱图,测得尿素峰面积的RSD为0.42%(n=6),表明仪器精密度良好。
2.4.6 重复性试验 取同一批供试品(批号:20180301)共6 份,分别按“2.1.3”项下的方法制备供试品溶液,按“2.4.1”项下的色谱条件分别进样测定,计算尿素的含量为99.81%,RSD为0.35%(n=6),表明方法的重复性良好。
2.4.7 溶液稳定性试验 取同一批供试品溶液(批号:20180301),于0、2、4、8、12 h 分别按“2.4.1”项下的色谱条件进样测定,记录色谱图,测得尿素峰面积的RSD为0.30%(n=5),表明供试品溶液在12 h 内稳定性良好。
2.4.8 回收试验 取同一批供试品(批号:20180301)共6 份,每份约0.25 g,精密称定,分别置50 mL 量瓶中,加75%乙腈溶解并稀释至刻度,摇匀,精密量取0.5 mL,置25 mL 量瓶中,精密加入尿素对照品储备液(9.652 mg·mL-1)0.25 mL,加75%乙腈稀释至刻度,摇匀,作为回收率测定溶液,进样测定,计算尿素的回收率为100.09%,RSD为0.96%(n=6),表明本方法的回收率良好。
2.5 样品含量测定
取9 批供试品,分别按照3 种不同的方法进行测定,运用SPSS 软件配对t检验对尿素含量的结果进行分析,结果见表2 及表3。

表2 含量测定结果(%)Tab 2 Content determination (%)

表3 3 种方法配对t 检验Tab 3 Paired t-test of the 3 methods
综上,3 种含量测定方法测得的结果基本一致,配对t检验结果显示P均小于0.05,表明3种方法间成显著相关。
本试验对尿素含量的测定方法进行了比较,结果表明采用3 种方法测定尿素含量测定结果基本一致,互相证明了3 种方法结果的可靠性。
传统凯氏定氮法测定尿素的含量,虽然成本低廉,但是操作过程烦琐,分析时间长,影响因素多,试验第一步消解为尿素与硫酸反应生成硫酸铵,凯氏烧瓶中的溶液在缓缓加热至溶液呈澄明的绿色,此时能明显观察到凯氏烧瓶中弥漫了白雾,火力需始终保持样品溶液在白雾中沸腾再保持加热30 min。此时,火炉的火力控制不当,样品消解不完全会造成含量偏差过大。火力太大,白雾会冲出凯氏烧瓶,无法使样品反应完全;
火力太小,样品达不到沸腾状态,也无法完全消解样品。另外,使用的定氮仪是采用通则0704 氮测定法的装置,该装置搭建烦琐,且该试验需要加热蒸馏,“俟氨馏尽”,这样的字眼在试验过程中不能简单明了地判断,接收馏液不全,直接影响样品的含量。此外,ChP2020 采用的氮测定法是对含氮量的测定,而非针对尿素主成分本身,因此该方法的专属性存在一定的问题,可操作性差。HPLC-CAD 法可排除缩二脲、缩三脲和三聚氰酸等杂质的干扰,专属性强,准确度与精密度均良好,简便易操作[14-15];
但电喷雾检测器在市场上的普及率相对较低,仪器的维护成本较高。HPLC-UV 法既能准确地测定尿素的含量,还可以测定除尿素外的其他杂质含量,且仪器的市场普及率高;
综合考虑,认为HPLC-UV 法更能广泛地应用到尿素含量的测定中。本研究可为尿素及其相关产品质量标准的建立及开发提供理论依据。