金鲳鱼肌原纤维蛋白乳液凝胶的制备及表征
来源:优秀文章 发布时间:2023-04-18 点击:
裴志胜,冯紫蓝,王会博,薛长风
(1.海南热带海洋学院食品科学与工程学院,海南三亚 572022;
2.海南省海洋食品工程技术研究中心,海南三亚 572022;
3.海南热带海洋学院,海洋食品精深加工关键技术省部共建协同创新中心,海南三亚 572022;
4.海南大学食品科学与工程学院,海南海口 570228)
金鲳鱼(Trachinotus ovatus),学名卵形鲳鲹,是我国海南、广东等主要的海水养殖品种[1]。截止2019年,金鲳鱼产业总产值已达200亿元[1],但金鲳鱼的产品目前主要以活鲜、冰鲜、全条冻为主,形式单一,不利于金鲳鱼产品的精深发展。金鲳鱼肉质细嫩光滑,氨基酸比例均衡,是优良的肌原纤维蛋白的来源。肌原纤维蛋白的乳化性能,使其成为乳化物制备的食品材料之选。何青[2]利用猪肉肌原纤维蛋白颗粒制备了稳定的高内相Pickering乳液,具有冷热稳定等优点,可以延缓脂质水解及提高葛根素的生物可及性。王莉莎[3]将植物油与金枪鱼肌原纤维蛋白进行复合凝胶的制备,为鱼糜中不饱和脂肪酸的添加提升提供了技术参考和理论依据。
乳液凝胶是一种被油滴填充的具有凝胶网络结构的半固体食品体系[4]。乳液凝胶的生成主要根据基质的特性进行加工,主要依据是填充物与基质之间的相互作用力,而没有相互作用力的则需要外力加工或者乳化剂的参与。乳液凝胶在物料包埋上表现出一定的应用前景,不仅能有效抑制成分释放,提高生物活性物质的有效率,还能通过乳液凝胶组分的调整控制包埋物的释放速度,做到控释、缓释的目的,其在功能性食品的开发上极具潜力[5]。
而对于鱼类蛋白作为乳液凝胶的凝胶基质的研究尚少,鱼类肌原纤维蛋白的乳化性能因其鱼类来源不同也会有所区别,不同来源的肌原纤维蛋白在结构及功能上是存在一定差异性。Chan等[6]学者认为白肉鱼和红肉鱼的凝胶特性是有差异的,可能与这些肌原纤维蛋白的展开速率不同有关,红肉鱼的肌原纤维蛋白在加热时展开速率的较慢。肌原纤维蛋白的凝胶特性不仅会影响对水产蛋白的感官和质构品质,而且会对乳化性和保水性等产生影响。主要原因是蛋白质的性能和特定蛋白质含量的不同及本身pH的差异[7]。
综上,本项目拟探讨金鲳鱼肌原纤维蛋白(Trachinotus ovatusMyofibrillar protein,TMP)的结构特性,并利用肌原纤维蛋白与玉米油构建乳液凝胶体系,研究其流变特性及平均粒径分布和结构特性;
探讨不同pH和NaCl浓度条件下乳化凝胶的稳定性,为金鲳鱼精深加工利用提供技术参考和理论依据。
1.1 材料与仪器
金鲳鱼片(冷冻) 海南翔泰渔业有限公司;
玉米油 金龙鱼有限公司;
氯化钠、十二水合磷酸氢二钠分析纯,国药集团化学试剂有限公司;
二水合磷酸二氢钠、四水合酒石酸钾钠、氢氧化钠 均为分析纯,西陇科学股份有限公司;
硫酸铜 分析纯,天津市福晨化学试剂厂。
XHF-DY高速分散器 宁波新芝生物科技股份有限公司;
MCR 92流变仪 Anton Paar;
T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;
LS 13 320激光粒度仪 贝克曼库尔特商贸(中国)有限公司;
ALPHA II德国布鲁克红外光谱仪 布鲁克光谱仪仪器公司;
B302系列生物显微镜 重庆奥特光学仪器有限责任公司;
Sartorius普及型pH计Sartorius科学仪器股份有限公司。
1.2 实验方法
1.2.1 原料预处理 将冷冻的金鲳鱼鱼片(400~500 g)置于4 ℃冰箱解冻12 h,备用。
1.2.2 金鲳鱼肌原纤维蛋白(TMP)的提取制备及蛋白浓度测定 参考Bakry等[8]的方法,并稍作修改。将解冻后的鱼片收集白色肌肉并在冰浴条件下搅碎,然后将切碎的肉在低磷酸盐缓冲溶液(0.05 mol/L NaCl,3.38 mmol/L NaH2PO4·2H2O,15.5 mmol/L Na2HPO4·12H2O,pH 7.5)中以8000 r/min在4 ℃离心10 min,并去除上清液,离心步骤重复操作三次。沉淀在高磷酸盐缓冲溶液(0.6 mol/L NaCl,3.38 mmol/L NaH2PO4·2H2O,15.5 mmol/L Na2HPO4·12H2O,pH7.0)中以4000 r/min离心3次,每次10 min后,将混合物在4 ℃冰箱中保存24 h,然后在4 ℃下以10000 r/min离心10 min,获得上清液在冷蒸馏水中收集并在4 ℃下沉淀30 min。在4 ℃下分别在10000 r/min下再离心两次,每次15 min,以去除混合物中的上清液后,收集沉淀(TMP)并在4 ℃冰箱中下储存,24 h内使用完毕。
参考周茹等[9]的方法,利用双缩脲法测定蛋白质的浓度,标准曲线为:y=0. 4979x+0. 0226,R2=0.997。
肌原纤维蛋白含量的计算公式:
式中:C肌原纤维蛋白含量,%;
m表示水相中肌原纤维蛋白含量,g;
V表示水相溶液体积,mL。
1.2.3 金鲳鱼肌原纤维蛋白(TMP)的表征
1.2.3.1 金鲳鱼肌原纤维蛋白(TMP)SDS-PAGE的测定 参考Xiong等[10]的方法并做适当的修改,即利用预制胶(Tris-Gly,12%),电压为120 V,时间为1 h,考马斯亮蓝(G-250)对凝胶进行染色,采用脱色液脱色至背景清晰,采用凝胶成像系统进行拍照分析。
1.2.3.2 金鲳鱼肌原纤维蛋白(TMP)红外光谱测定及二级结构分析 真空冷冻干燥后的样品粉末与溴化钾混合研磨并压片,在恒温箱里平衡5 min,红外光谱仪扫描,范围为4000~400 cm−1,分辨率为4 cm−1,每个样品图谱扫描重复3次,采集红外光谱图[11]。
1.2.3.3 金鲳鱼肌原纤维蛋白(TMP)电镜结构表征将TMP于-60 ℃条件下预冷冻处理,于真空冷冻干燥机内进行脱水整个过程持续24 h[12]。将冻干得到蛋白质颗粒粉末固定在金属导电胶上,对样品进行喷金处理,调整参数进行观察、拍照。
1.2.4 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的制备及表征
1.2.4.1 制备金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的肌原纤维蛋白含量(C)的初步确定 参考许彦腾[13]的方法并做适当的修改,即分别称取C=0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的肌原纤维蛋白溶液,漩涡振荡2 min中水化处理,再分别添加体积分数φ=0.5比例的玉米油(pH7.0),利用高速均质剪切机控温条件下(10 ℃以下)7000 r/min均质2 min,通过流变学性质测定,确定合适的金鲳鱼肌原纤维蛋白浓度。
1.2.4.2 制备金鲳鱼肌原纤维蛋白(TMP)乳液凝胶最佳体积油相比(φ)的确定 称取C=2.5%的TMP溶液,分别添加体积比为φ=0.1、0.3、0.5、0.6、0.64、0.66、0.68、0.70玉米油,利用高速均质剪切机控温条件下(10 ℃以下)7000 r/min均质2 min,通过对表观结构、显微结构及流变学性质和平均粒径的测定,得较好的乳液凝胶油相体积比(φ)[14]。
1.2.4.3 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的流变学性质测定 参考Xu等[15]的方法并做适当的修改,使用流变仪测定乳液凝胶流变性特性,频率范围为1~10 Hz,平行板(直径27.83 mm,1 mm间隙)温度为25 ℃,在所有样品的储能模量G"和弹性模量G""均在线性粘弹性区域(0.5%的应变)内。
1.2.4.4 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶表观结构观察 利用照相机对制备的TMP乳液凝胶进行拍照观察。
1.2.4.5 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶显微结构观察 采用光学显微镜观察TMP乳液凝胶的显微结构,取适量的乳液凝胶置于凹载玻片上,于10倍镜头下观察,所得图像采用自带软件进行处理分析。
1.2.4.6 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的粒径测定 采用激光粒度仪对有乳液凝胶进行粒径测定。参数如下:样品折射率为:1.52,介质为水,水的折射率为1.333[16]。
1.2.4.7 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶激光共聚焦显微结构观察 采用激光共聚焦显微镜(CLSM)观察最佳比例的TMP乳液凝胶显微结构:参照张会等[17]的方法并稍作修改。用50 μL尼罗蓝(1 mg/mL溶解于去离子水)对乳液凝胶中蛋白质进行染色,用50 μL尼罗红(1 mg/mL溶解于丙酮)对乳液凝胶中油脂染色。染色在避光条件下进行,染料溶液与乳液凝胶按质量比1:25进行染色,然后将染色的乳液凝胶置于载玻片上,盖上盖玻片后,利用CLSM在40×物镜下观察乳液凝胶并采集图片。扫描条件设置如下:用633 nm处的CY5通道来激发绿染色的蛋白质,用488 nm处的FITC通道来激发尼罗红染色的脂肪。
1.2.5 金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的稳定性测试
1.2.5.1 不同pH条件对金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的稳定性的测定 配制不同pH条件下(3.0、5.0、7.0、9.0、11.0)(离子强度0.6 moL/L)C=2.5%的肌原纤维蛋白溶液,分别添加体积比为φ=0.68的玉米油油相,利用高速均质剪切机控温条件下(10 ℃以下)7000 r/min均质2 min,通过对表观、显微结构、流变学性质和平均粒径的测定,判断其对乳液凝胶的影响[18]。
1.2.5.2 不同NaCl浓度条件对金鲳鱼肌原纤维蛋白(TMP)乳液凝胶的稳定性的测定 配制不同NaCl浓度条件下(0.0、0.2、0.4、0.6、0.8、1.0 mol/L)(pH7.0)的C=2.5%肌原纤维蛋白溶液,添加体积比为φ=0.68的玉米油油相,利用高速均质剪切机控温条件下(10 ℃以下)7000 r/min均质2 min,通过对表观、显微结构、流变学性质和平均粒径的测定,判断对乳液凝胶的影响[15]。
1.3 数据处理
采用SAS9.3软件分析正交组合安排和结果、方差分析以及回归模型参数;
采用Excel 2010将数据表示为平均值±标准偏差;
采用SPSS 18.0统计软件进行Pearson相关性分析、ANOVA单因素方差分析后采用Duncan分析法对各处理组进行显著性分析;
采用Excel 2010软件和Origin软件绘图。
2.1 金鲳鱼肌原纤维蛋白的表征
2.1.1 TMP的SDS-PAGE分析 由图1所示,可以清楚的观察到TMP中的肌球蛋白重链(MHC)、肌动蛋白(Actin)、肌钙蛋白-T(Tropornin-T)、原肌球蛋白,图谱中MHC和肌动蛋白的条带颜色最深、最宽,说明金鲳鱼肌原纤维蛋白主要是由肌球蛋白和肌动蛋白所构成的,也可见提取的TMP较纯,适合用于下一步乳液凝胶的制备[19]。

图1 TMP SDS-PAGE图谱Fig.1 TMP SDS-PAGE map
2.1.2 TMP红外光谱测定及二级结构分析 由图2可知,TMP存在典型的蛋白特性峰,即1600~700 cm−1的酰胺Ⅰ区和1230~1320 cm−1的酰胺Ⅲ区。3500~3250 cm−1范围内的吸收峰反映O-H、N-H伸缩振动;
2800~3000 cm−1范围内的吸收峰反映脂肪族CH伸缩振动峰;
1700~1600 cm−1范围内的吸收峰反映C=O和C-N伸缩振动的酰胺I带;
1600~1500 cm−1范围内的吸收峰反映C-N伸缩振动的酰胺Ⅱ带,1300~1000 cm−1左右的吸收峰主要反映C-O键、CN-C键的伸缩振动[20]。由酰胺I带的蛋白二级结构拟合结果(表1)可知,TMP的β-折叠的含量最高,β-折叠的含量与蛋白分子聚集程度有关[21],其次为β-转角,β-转角的含量与蛋白柔性结构稳定相关,次之无规则卷曲,无规则卷曲的柔性构象结构利于连接结构相对刚性的α-螺旋和β-折叠,使肌原纤维蛋白的结构稳定性增强,稳定的结构对于理化性质尤为重要。α-螺旋与蛋白质分子展开程度有关,其含量低说明蛋白分子展开程度高,结构稳定性不强[22]。在pH为7.0时,靠近等电点,蛋白负电荷减少,静电斥力减小,导致蛋白分子内的氢键减少,氢键与水的结合减弱,分子间的氢键增多,对应的是α-螺旋含量减少,β-折叠含量增多。

图2 TMP红外光谱分析Fig.2 Infrared spectral analysis of TMP
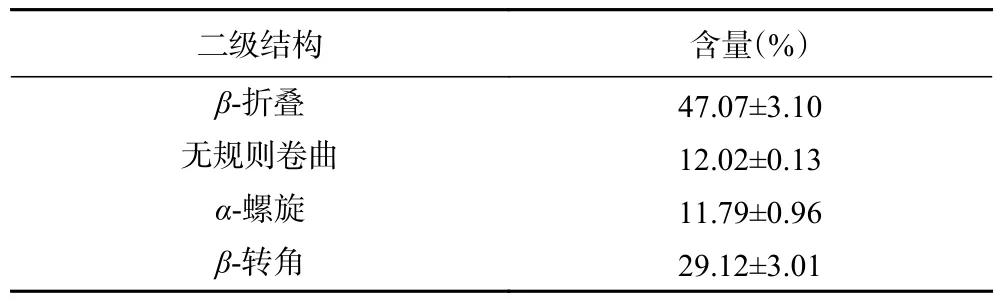
表1 pH7. 0时TMP 二级结构Table 1 pH7.0 TMP primary fibrin secondary structure
2.1.3 TMP电镜微观结构表征 由图3可知,在pH为7.0,NaCl浓度为0.6 mol/L时,TMP在放大倍数为4000倍时,形态为纤维状,随着放大倍数增大到25000倍时,肌原纤维蛋白为聚集状态的椭圆化颗粒状态,肌原纤维蛋白的椭圆化颗粒状与静电相互作用影响有关[21]。

图3 pH7.0条件下对TMP显微结构形态观察Fig.3 Microstructure morphology of TMP was observed under pH7.0 conditions
2.2 制备TMP乳液凝胶的工艺优化及表征
2.2.1 制备TMP乳液凝胶肌原纤维蛋白浓度(C)的初步确定 由图4可知,蛋白浓度对TMP乳液流变特性的影响。在1~10 Hz的测定频率范围内,当油相比为φ=0.5时,在蛋白含量(C)为2.5%时乳液凝胶的弹性模量G"达到最大。当蛋白浓度在0.5%~1.5%时,蛋白不足以完成乳化油相,造成乳液中的油相过多,乳液弹性模量G"偏低;
在蛋白含量达到2.0%时,油相乳化程度增强,初步形成均匀乳液,乳液的弹性模量G"明显提升;
在蛋白含量为2.5%,油相的乳化完全,弹性模量G"达到最大;
但当蛋白含量为3%时,油相被完成乳化的同时,产生了剩余的蛋白,降低了乳液凝胶的弹性模量G"。可知,在蛋白浓度为2.5%时,乳液凝胶即可达到较好的流变特性。

图4 不同蛋白浓度对TMP乳液/乳液凝胶流变特性影响Fig.4 Effects of different protein concentrations on rheological properties of TMP emulsions/emulsion gels
2.2.2 制备TMP乳液凝胶的最佳体积油相比(φ)的确定 由图5可知,在肌原纤维蛋白浓度为2.5%的条件下,添加不同油相比(φ=0.1、0.3、0.5、0.6、0.64、0.66、0.68、0.69、0.70)对乳液凝胶的影响,在油相比(φ)添加量为0.1、0.3时,乳液出现明晰的乳析,当油相比(φ)为0.5时,形成了均匀的乳液状态,并随着油相比(φ)(0.60~0.70)的提升,逐步形成了状态良好的乳液凝胶;
油相比(φ)为0.70时,乳液凝胶出现破油的现象,从而无法形成乳液凝胶。肌原纤维蛋白浓度2.5%,油相比(φ)为0.60~0.69时,形成了结构相对稳定的乳液凝胶状态。何青[2]的研究表明,在油相体积为0.70~0.86时,猪肉肌原纤维蛋白颗粒在油滴的周围形成了致密的界面3-D网路状结构,得到了稳定的乳液胶体。而本研究的最佳油相比例要低于何青[2]的结果,可能是由于本研究的肌原纤蛋白为鱼类蛋白,何青使用的是猪肉肌原纤维蛋白,由于蛋白来源的差异性,使蛋白乳化能力上存在差异,因此研究的最佳油相比也不同。

图5 不同油相比条件下制备的TMP乳液凝胶形态及光学显微镜图像Fig.5 Form and optical microscope image of TMP gel prepared under different oil conditions
由图6流变测定动态粘弹性测定结果可知,当油相比(φ)为0.10、0.30、0.50和0.70时,乳液的流变弹性模量G"均偏低。在油相比(φ)为0.68时,乳液凝胶的弹性模量G"最佳,在1~10 Hz的测定频率范围内,弹性模量G"大小依次为0.68>0.69>0.66>0.64>0.60。乳液凝胶的弹性模量G"并不完全随着油相体积分数的提高而上升,在φ=0.68时,油相与蛋白已经达到较好的弹性模量G",而φ为0.70时已经处于破油状态,粘弹性大大减弱。乳液凝胶动态粘弹性升高且主要表现为弹性特征,可能是由于高油含量往往伴随着高的弹性特征[23−24]。

图6 不同油相比对TMP乳液/乳液凝胶流变特性的影响Fig.6 Effects of different oils on the rheological properties of TMP emulsions/emulsion gels
由图7可知,随着油相比(φ)的增加,乳液的平均粒径呈现增加趋势,当φ=0.66时,达到一个峰值;
但当φ=0.68时,平均粒径开始减少;
当φ=0.70时,平均粒径突变增大,可能在较低的φ(0.10~0.66)时,肌原纤维蛋白在界面逐步进行吸附,随着φ的增加,体系颗粒增多,平均粒径变大;
当φ=(0.68~0.69)时,体系形成的乳液凝胶状态,对油滴产生较大的束缚作用,平均粒径变小;
当φ=0.70时,体系发生破乳,肌原纤维蛋白发生无序聚集,使平均粒径突变增大。所以,结合上述流变测定动态粘弹性测定结果和粒径分布结果可知,乳液凝胶的体积油相比(φ)为0.68时,所制备出来的乳液凝胶最佳。

图7 不同油相比对TMP乳液/乳液凝胶粒径分布的影响Fig.7 Effects of different oils on particle size distribution of TMP emulsion/emulsion gel
2.2.3 金鲳鱼肌原纤维蛋白乳液凝胶激光共聚焦显微结构图像观察 由图8可知,在蛋白浓度为2.5%、油相比为0.68时,TMP乳液凝胶的CLSM的图像。从绿色油相部分可知,乳液凝胶的状态多重W/O/W的结构;
从红色蛋白部分可知,蛋白包裹油相,形成了乳液凝胶结构。何青[2]利用猪肉肌原纤维蛋白颗粒制备的HIPEs乳液为O/W结构,可见肌原纤维蛋白的来源不同,对乳液结构的形成有一定影响。
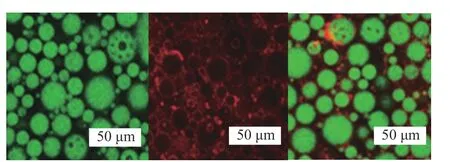
图8 蛋白质含量2.5%和0.68油相比制备的TMP乳液凝胶的CLSM图像Fig.8 CLSM image of TMP emulsion gel prepared at 2.5%protein content and 0.68 oil ratio
2.3 金鲳鱼肌原纤维蛋白乳液凝胶的稳定性性质分析
2.3.1 金鲳鱼肌原纤维蛋白乳液凝胶在不同pH条件下的稳定性分析 图9是在油相比(φ)为0.68,肌原纤维蛋白浓度为2.5%,离子强度0.6 mol/L的条件下,对不同pH条件下乳液凝胶的形态及光学显微镜成像进行分析。在pH3.0和pH5.0的环境下,体系无法形成稳定的乳液凝胶的状态;
当pH为7.0、9.0、11.0时,体系形成了稳定的乳液凝胶。出现这种情况的原因可能是pH在酸性条件下肌原纤维蛋白表面净电荷的变化,改变溶解度,引起乳化性能的变化,使其与油水的结合能力变差,从而影响了乳液凝胶的形成[25]。李子晗等[26]也研究表明,在pH5.0~6.0时,肌原纤维蛋白的乳化稳定指数显著降低,不利于乳状液稳定,而在pH7.0~8.0时,乳化稳定指数显著提升,乳液稳定性增加。

图9 不同pH条件下制备的TMP乳液凝胶形态及光学显微镜图像Fig.9 Form and optical microscope image of TMP gel prepared under different pH conditions
由图10可知,当pH=7.0时,乳液凝胶的弹性模量G"最佳,其次为pH9.0和pH11.0,在pH3.0和pH5.0的条件下,由于体系未形成凝胶状,弹性模量G"最低。

图10 不同pH对TMP乳液凝胶流变特性的影响Fig.10 Effects of different pH on the rheological properties of TMP emulsion gels
由图11可知,当pH=3.0和5.0时,由于体系未形成乳液凝胶,造粒体系的颗粒过大。在pH7.0时,乳液凝胶的粒径最小。但随着pH的上升,乳液凝胶的粒径又逐渐变大,可能是由于碱性环境中,因肌原纤维蛋白颗粒之间的相互排斥而导致粒径变大[27−28]。也有研究表明,蛋白质颗粒大小的变化与其显微聚集状态及静电效应有一定程度的联系[22],肌原纤维蛋白的电荷总量随着pH的增加而增加,pH的增加导致蛋白之间的静电斥力增加,蛋白质分散,粒径也逐渐增大。

图11 不同pH对TMP乳液凝胶粒径分布的影响Fig.11 Effect of different pH on particle size distribution of TMP emulsion gel
结合上述结果,从不同pH条件下制备的肌原纤维蛋白乳液凝胶形态及光学显微镜图像、流变特性及其粒径分布的影响可知,在pH7.0,NaCl浓度为0.6 mol/L时,乳液凝胶的弹性模量G"最高,平均粒径最小。
2.3.2 金鲳鱼肌原纤维蛋白乳液凝胶在不同NaCl浓度条件下的稳定性分析 如图12所示,是在油相比(φ)为0.68,肌原纤维蛋白浓度为2.5%,pH7.0,不同NaCl浓度条件下对乳液凝胶的形态及光学显微镜成像进行分析。由图12可知,在0~1.0 mol/L的离子强度下,金鲳鱼肌原纤维蛋白均可以形成稳定的乳液凝胶,各个处理组的差异性较小,可知NaCl浓度对乳液凝胶形成的影响相对较小。

图12 不同NaCl浓度条件下制备的TMP乳液凝胶形态及光学显微镜图像Fig.12 Form and optical microscope image of TMP gel prepared under different salt concentration conditions
从图13可知,在NaCl浓度为0.6 mol/L时,乳液凝胶的弹性模量G"最佳,其次依次排序为0.8 mol/L>0.4 mol/L>0 mol/L>0.2 mol/L>1.0 mol/L。由此可知,NaCl浓度可以影响乳液凝胶的弹性模量G",可能是因为NaCl浓度的介质环境影响乳状液中液滴的净电荷,因盐析的影响,使乳液凝胶的状态出现差异[29]。

图13 不同盐浓度对TMP乳液凝胶流变学特性的影响Fig.13 Effects of different salt concentrations on the vasculology characteristics of TMP oil gel
由图14可知,NaCl浓度对乳液凝胶的粒径存在一定的影响,在0 mol/L条件下,乳液凝胶粒径最小;
在0.2、0.4、0.6 mol/L时,乳液凝胶粒径相对较大;
0.8、1.0 mol/L时又略微下降。由此可见,在肌原纤维蛋白浓度为0 mol/L条件下,肌原纤维蛋白溶解度最低,为了稳定油相,从而形成了较小的乳液凝胶液滴。随着NaCl浓度的增加,肌原纤维蛋白相对溶解变大,稳定油相的蛋白充足,乳液凝胶的粒径变大。当NaCl浓度较高时,乳液凝胶粒径的下降,推测此归因于肌球蛋白由细丝状态转变为单体形式状态[7]。

图14 不同盐浓度对TMP乳液凝胶粒径分布的影响Fig.14 Effects of different salt concentrations on the particle size distribution of TMP gel
肌原纤维蛋白浓度(C)和油相比(φ)均会对乳液凝胶体系的弹性模量G"及乳液液滴的粒径大小存在影响,在金鲳鱼肌原纤维蛋白浓度(C)为2.5%,油相比(φ)为0.68时,制备得乳液凝胶为W/O/W的多重结构,其弹性模量G"最佳,平均粒径变小。乳液凝胶在pH酸性条件下不稳定,碱性环境下相对稳定,pH对乳液凝胶流变和粒径分布影响较大,但NaCl的浓度改变对乳液凝胶的影响较小。本研究构建的乳液凝胶体系为功能物质递送和脂肪代替物提供了可选的食品级材料,为金鲳鱼肌原纤维蛋白的开发提供了一定的技术参考,也为金鲳鱼肌原纤维蛋白的开发利用提供一定的理论基础,为其精深加工提供一定的技术参考。本研究后续通过采用多羟基化合物(多糖、淀粉类)的添加,提升乳液凝胶的载油率及其在酸性环境下的稳定性,扩展其应用领域。
猜你喜欢鲳鱼肌原纤维油相改性铵油炸药油相加注装置的设计煤矿爆破(2020年3期)2020-12-08多酚与肌原纤维蛋白相互作用机制及其对蛋白特性的影响研究进展食品科学(2020年11期)2020-07-134个月整体规格超8两/尾!“鱼瘟”影响下,这一金鲳鱼养殖户为何能逆袭?当代水产(2020年10期)2020-03-17比窦娥还冤的鲳鱼杭州(2018年11期)2018-04-13一种对稀释、盐度和油相不敏感的低界面张力表面活性剂配方中国洗涤用品工业(2017年2期)2017-04-16储运油泥中非油相组分对表观黏度的影响分析浙江大学学报(工学版)(2016年11期)2016-06-05应用Box-Behnken设计优选虎耳草软膏剂成型工艺遵义医科大学学报(2016年1期)2016-03-16上汤斗鲳餐饮世界(2015年1期)2015-12-22肌原纤维蛋白与大豆分离蛋白复合体系乳化性的研究食品工业科技(2014年23期)2014-03-11TG酶协同超高压处理对鸡胸肉中肌原纤维蛋白凝胶品质的影响食品工业科技(2014年23期)2014-03-11推荐访问:鲳鱼 表征 凝胶