非酒精性脂肪性肝病对乙肝病毒相关肝细胞癌患者生存的影响
来源:优秀文章 发布时间:2023-04-16 点击:
张珊,陈松海,刘妍,王春艳,付懿铭,陆荫英,纪冬*,陈国凤*
1北京大学302临床医学院,北京 100039;
2解放军总医院第五医学中心肝病医学部,北京 100039;
3解放军总医院第五医学中心感染病医学部,北京 100039
全球范围内,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)患病人数约为17亿[1]。中国的NAFLD患病率、发病率及与NAFLD相关的年病死率在亚洲国家范围内均最高,但作为严重的公共健康问题,NAFLD在我国目前仍未引起足够重视[2-3]。乙型肝炎在肝脏疾病中占据着非常重要的地位[4-5]。我国约有7000万例慢性乙型肝炎病毒(hepatitis B virus,HBV)感染者,其中2000万~3000万例是慢性乙型肝炎患者[6]。乙肝肝硬化进展至肝细胞癌(hepatocellular carcinoma,HCC)的年发生率为3%~6%[7],是我国HCC的首要病因[6]。世界卫生组织最新数据显示,2020年全球新发肝癌905 677例,中国新发肝癌410 038例,全球因肝癌死亡830 180例,中国因肝癌死亡391 152例,中国新发及死亡病例数均位居世界第一[8]。虽然乙型肝炎疫苗广泛应用后慢性乙型肝炎感染人数不断减少,但乙型肝炎所致的HCC患者在全球病例中仍占一半以上[9]。NAFLD的患病趋势与HBV感染似乎密切相关,慢性乙型肝炎患者合并NAFLD的发病率不断升高[10]。因此,研究NAFLD与HBV感染共患病对人体及疾病发展的影响具有重要的临床意义。NAFLD合并HCC是否会使患者生存期进一步缩短目前尚未得到研究证实。本研究回顾性分析HBV相关HCC患者的临床资料,以期探索合并NAFLD对此类患者生存期的影响。
1.1 一般资料 收集2008年6月-2020年12月就诊于解放军总医院第五医学中心的833例经临床检查及影像学明确诊断为HBV相关HCC患者的临床资料,患者年龄(52.3±9.9)岁,其中男667例(80.1%),女166例(19.9%)。纳入标准:(1)依据《慢性乙型肝炎防治指南(2019年版)》[5]诊断为慢性HBV感染者;
(2)接受核苷(酸)类似物[nucleos(t)ide analogues,NAs]治疗并获得完全病毒学应答(HBV DNA<20 IU/ml);
(3)依据《原发性肝癌诊疗规范(2019年版)》[11]明确诊断为HCC,均按照巴塞罗那肝癌临床(Barcelona clinic liver cancer,BCLC)分期[12]给予相应治疗(0期、A期行手术切除或消融治疗,B期、C期行基于介入的系统性治疗,D期行对症支持治疗)。排除标准:(1)合并其他病毒性肝炎、自身免疫性肝病、酒精性肝病、药物性肝损伤等;
(2)胆管细胞癌、继发性肝癌及其他系统肿瘤;
(3)基线资料严重缺失。NAFLD的诊断依据为中华医学会肝脏病学分会脂肪肝和酒精性肝病学组制定的《非酒精性脂肪性肝病诊疗指南(2018年更新版)》[13],有弥漫性肝细胞脂肪变的影像学或组织学证据并排除酒精滥用。本研究经解放军总医院第五医学中心伦理委员会批准通过(审批号:2020055D)。
1.2 方法 本研究所有基线指标数值均来源于患者初次诊断为HCC时的数据。收集患者性别、年龄、体重指数(BMI)、糖尿病史、HCC家族史,肝硬化、门静脉栓塞等临床信息,通过溴甲酚绿法检测白蛋白(ALB)、钒酸氧化法测定胆红素(BIL)、乳酸脱氢酶法测定谷丙转氨酶(ALT)、IFCC速率法测定谷草转氨酶(AST)、NPP底物-AMP缓冲液法测定碱性磷酸酶(ALP)、速率法测定γ-谷氨酰转移酶(GGT)、血小板计数法测定血小板(PLT)、电化学发光法测定甲胎蛋白(AFP)水平。以患者肝癌相关性死亡为终点,终点指标为总生存期(overall survival,OS),失访患者将末次随访日期作为生存时间的删失值。收集纳入患者的相关临床资料及随访信息。以BCLC分期为标准,按可切除(BCLC分期0及A期)和不可切除(BCLC分期B、C、D期)分层,每层患者按照是否合并NAFLD分组,随后使用稳健逆概率处理加权法(inverse probability of treatment weighting,IPTW)平衡两组间的混杂因素并进行生存分析。
1.3 稳健IPTW方法 其原理是以所有观察对象作为标准人群,在计算得出倾向性评分的基础上,利用标准化法的原理,通过倾向性评分值赋予每个研究对象一个相应的权重进行加权,使各组中倾向性评分的分布一致,从而消除混杂因素的影响。NAFLD组各观察对象的权重为Wt=Pt/PS,非NAFLD组各观察对象的权重为Wc=(1-Pt)/(1-PS)。PS为倾向性评分值,Pt为接受处理组在整组中的占比。
1.4 统计学处理 采用R-4.0.3进行统计学处理。正态分布的计量数据以±s表示,组间比较采用独立样本t检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher精确概率法检验。生存分析采用Kaplan-Meier法绘制生存曲线,并行Log-rank检验及单因素Cox回归分析。P<0.05为差异有统计学意义。
2.1 可切除与不可切除HBV相关HCC患者的临床特征分析 以BCLC分期为标准,本组833例患者中可切除患者465例,不可切除患者368例;
可切除患者中非NAFLD组304例(65.4%),NAFLD组161例(34.6%);
不可切除患者中非NAFLD组292例(79.3%),NAFLD组76例(20.7%)。组间比较显示,对于可切除患者,非NAFLD组与NAFLD组性别、BMI、HCC家族史、ALB、BIL、PLT差异有统计学意义(P<0.05);
对于不可切除患者,非NAFLD组与NAFLD组性别、BMI、HCC家族史、HBeAg、肝硬化、门静脉栓塞、ALB、BIL、AST、ALP、GGT、PLT差异均有统计学意义(P<0.05,表1)。
2.2 稳健IPTW法加权后可切除与不可切除患者的临床特征分析 使用稳健IPTW法对表1中不均衡的临床指标进行加权,加权后的临床基线数据均平衡(P>0.05,表2)。

表1 可切除与不可切除HBV相关HCC患者的临床特征分析Tab.1 Analysis of clinical features of patients with hepatitis B virus-related hepatocellular carcinoma between resectable group and non-resectable group
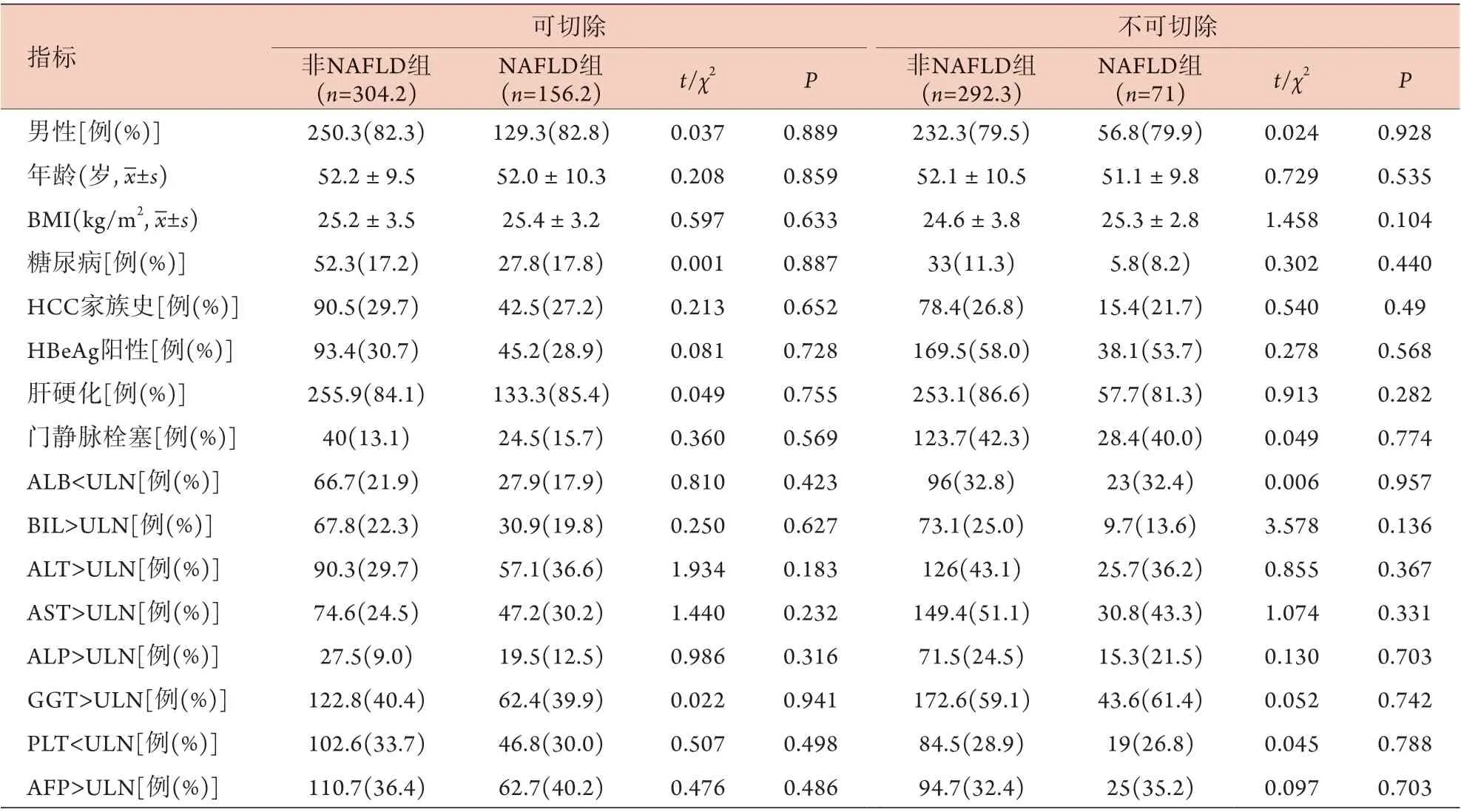
表2 加权后可切除与不可切除HBV相关HCC患者的临床特征分析Tab.2 Analysis of clinical features of patients with hepatitis B virus-related hepatocellular carcinoma between resectable group and non-resectable group after weighting
2.3 生存分析 本组8 3 3 例患者中死亡4 7 0 例(56.4%),中位生存时间62(60,67)个月。使用稳健IPTW法加权之后,对于可切除患者,非NAFLD组的3、5、8年生存率分别为91.1%、60.4%、13.7%,中位生存时间68(62,74)个月,NAFLD组的3、5、8年生存率分别为96.9%、82.1%、41.2%,中位生存时间94(86,110)个月,NAFLD组的生存情况优于非NAFLD组(P<0.01,图1A);
单因素Cox回归分析结果显示,NAFLD是患者生存的保护因素(HR=0.473,95%CI 0.356~0.627,P<0.01)。对于不可切除患者,非NAFLD组的3、5、8年生存率分别为53.0%、25.7%、2.5%,中位生存时间43(30,49)个月,NAFLD组的3、5、8年生存率分别为76.8%、53.7%、18.4%,中位生存时间67(53,78)个月,NAFLD组的生存情况优于非NAFLD组(P<0.01,图1B);
单因素Cox回归分析结果表明,NAFLD是患者生存的保护因素(HR=0.358,95%CI 0.247~0.518,P<0.01)。
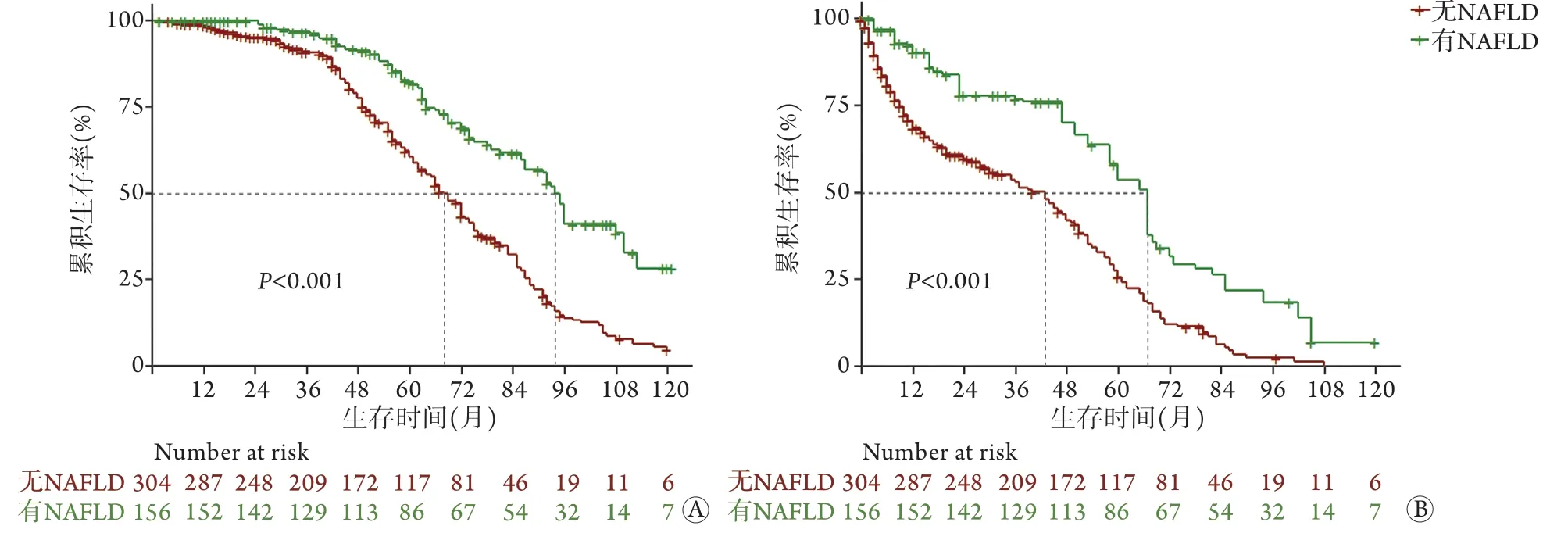
图1 HBV相关HCC患者总体生存结果Fig.1 Overall survival outcomes
NAFLD是近年来肝病领域研究的热点[14]。而乙型肝炎在病毒性肝炎领域一直占据着非常重要的地位,在全球范围内HBV感染是HCC的首要病因[15]。HBV慢性感染者合并NAFLD逐渐增多[16]。本研究探讨了NAFLD对HBV相关HCC患者生存的影响,对HCC预后的高危因素进行了分析及校正。首先按BCLC分期分为可切除患者与不可切除患者,排除了肿瘤进展程度及治疗方式对预后可能带来的影响。有研究显示,糖尿病是影响HCC患者预后的危险因素之一,合并2型糖尿病者的长期预后较差[17],2型糖尿病是降低HCC总生存率的独立危险因素(HR=1.55,95%CI 1.27~1.91,P=0.001)[18]。肝功能也会影响HCC患者的预后,BIL[19]、ALB[19]、ALP[20]等是HCC预后较差的独立危险因素。此外,HCC家族史、肝硬化及门静脉栓塞对HCC患者预后的影响也早已得到学术界的公认。
本研究对以上影响HCC预后的高危因素均进行了统计学校正,排除了多种混杂因素的可能影响,结果发现,NAFLD组的HBV相关HCC患者累积生存率明显高于非NAFLD组。有研究发现,HBV相关HCC患者与NAFLD相关HCC患者的生存率并无明显差别,NAFLD、HBV感染作为HCC的病因并非预后不良的危险因素[21-22]。研究发现,NAFLD的存在是结肠癌患者总生存率的独立保护因素(HR=0.593,95%CI 0.442~0.921,P=0.02)[23]。另有研究表明,在肝硬化患者中,超重或肥胖可能与患者的生存期长呈中度相关[24]。NAFLD是一种与胰岛素抵抗及遗传易感性密切相关的代谢应激性肝损伤,与肥胖症、高脂血症、2型糖尿病、代谢综合征等多种疾病有着密切的联系[25-26],当患者处于肿瘤末期时,能量过度消耗导致恶液质的发生,是许多患者生存期短的主要原因。超重或肥胖可能与乙型肝炎合并NAFLD的HCC患者的生存时间延长有着密切关系,其原因可能是NAFLD患者普遍脂肪含量较高,体内能量储存较多,对营养恶性消耗的耐受度较高。
本研究为单中心研究,样本量较小。因此,在进行数据分析时采用了稳健IPTW方法,将可能对HCC预后有影响的临床指标进行加权,既能避免使用倾向性评分匹配法损失过多样本量,又能解决IPTW法假阳性率较高的问题。研究初始根据BCLC分层,并对性别、年龄、肝功能、并发症等多项因素进行加权,尽可能保证了结果的准确性。除此之外,本研究仍存在一定的局限性,如抗病毒治疗时间、门脉高压静脉曲张并发症等对预后的影响在本文中尚未体现,有待进一步研究。
总之,合并NAFLD的HBV相关HCC患者累积生存率高于未合并NAFLD患者,此结果为进一步深入的大规模临床研究提供了线索。
猜你喜欢法测定中位肝病非酒精性脂肪性肝病的中医治疗肝博士(2022年3期)2022-06-30调速器比例阀电气中位自适应技术研究与应用大电机技术(2021年3期)2021-07-16你还在把“肝病” 当“胃病”在治吗?肝博士(2020年4期)2020-09-24真相的力量中外文摘(2020年13期)2020-08-01注重活动引领 凸显数学本质——以“三角形的中位线”为例福建基础教育研究(2020年4期)2020-05-28ICP-OES法测定钢和铁中微量元素昆钢科技(2020年6期)2020-03-29跟踪导练(4)时代英语·高三(2019年4期)2019-09-03HPLC法测定桂皮中的cinnamtannin D-1和cinnamtannin B-1中成药(2017年9期)2017-12-19UPLC法测定萹蓄中3种成分中成药(2017年5期)2017-06-13一种基于LBP 特征提取和稀疏表示的肝病识别算法中国生物医学工程学报(2017年6期)2017-02-10推荐访问:肝病 脂肪 乙肝病毒