耐药结核病患者利奈唑胺血药浓度对血液系统毒性发生的影响
来源:优秀文章 发布时间:2023-04-08 点击:
王红红 郭少晨 周文强 刘忠泉 朱慧 陆宇
耐药结核病治疗存在抗结核药物种类匮乏、药物不良反应大、治疗周期长,以及患者治疗依从性差等问题[1]。利奈唑胺是首个用于临床的全合成噁唑烷酮类抗菌药物,其作用机制独特且不易与其他药物发生交叉耐药[2],体内和体外对结核分枝杆菌均表现出良好的活性,是耐药结核病化疗方案的重要组成[3-5]。2019年世界卫生组织耐药结核病治疗指南推荐利奈唑胺为耐药结核病治疗方案的A组首选药物[5]。但长期使用利奈唑胺的不良反应发生率较高,限制了其在临床的广泛应用。利奈唑胺的不良反应主要涉及消化系统、神经系统及血液系统[4],其中,血液系统毒性发生最多,尤其是血小板减少症[6]。
利奈唑胺引起的血液系统毒性发生情况多有报道[7-9],其相关危险因素的研究结果各有差异[10-16]。研究表明,利奈唑胺药物暴露与血小板减少症的发生密切相关[7],且其在不同患者中血药浓度波动较大。笔者分析应用利奈唑胺的耐药结核病患者发生血液系统毒性与利奈唑胺血药浓度的相关性,以期为利奈唑胺不良反应的发生提供预警。
一、研究对象遴选
1.研究对象:采用前瞻性队列研究方法,连续纳入首都医科大学附属北京胸科医院2019年1月至2021年2月应用含利奈唑胺化疗方案治疗的耐药结核病患者作为研究对象,共219例。收集研究对象的临床资料,包括性别、年龄、体质量、血清白蛋白、天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL)、碱性磷酸酶(alkaline phosphatase,ALP)、血清肌酐及血常规等。研究对象包括男性138例(63.0%),女性81例(37.0%);
平均年龄为(35.30±13.17)岁,年龄>45岁者为53例(24.2%),≤45岁者166例(75.8%);
平均体质量为(62.18±11.81) kg,体质量>55 kg者128例(70.7%),≤55 kg者53例(29.3%),38例无体质量记录;
肝功能异常者11例,肾功能异常者8例。
2.纳入标准:(1)参照世界卫生组织耐药结核病治疗指南[5],应用含利奈唑胺化疗方案治疗的耐药结核病患者;
(2)应用利奈唑胺治疗至少7 d;
(3)签署知情同意书。
3.排除标准:(1)拒绝抽血的患者;
(2)哺乳期和妊娠期妇女;
(3)存在血液系统疾病者、风湿系统疾病(系统性红斑狼疮)者、接受化疗的肿瘤患者、急性重症胰腺炎患者、肝母细胞瘤患者或服用抗血小板药物者;
(4)合并用药中有产生血液系统毒性的药物;
(5)肝肾功能相关数据缺失者。
4.伦理审查:本研究在首都医科大学附属北京胸科医院开展,经首都医科大学附属北京胸科医院医学伦理委员会审查并批准[审批号:(2019)年临审第(14)号]。
二、研究方法
1.利奈唑胺剂量:研究对象采用多药联合治疗,治疗方案中含利奈唑胺,静脉或口服给药均可。给药剂量为600 mg/次,1次/d;
若出现药物不良反应则减量至300 mg/次,1次/d,直至停药。
2.血液标本采集及血药浓度检测:(1)血液标本采集:研究对象给予利奈唑胺治疗至少7 d,在任一时间给药后2 h时抽取静脉血2 ml,3000×g,离心10 min,分离出血浆样本,-80 ℃保存。(2)利奈唑胺血药浓度测定:血浆样本用等量的乙腈脱蛋白沉淀,20 000×g,离心10 min,离心后取上清液采用高效液相色谱-质谱法(HPLC-MS)进行血药浓度检测。(3)HPLC-MS:安捷伦高效液相色谱仪:色谱柱:Agilent ZORBAX SB-C18(2.1 mm×50 mm,1.8 μm);
流动相A为含0.1%的甲酸、5 mmol/L的甲酸铵(水相);
流动相C为乙腈(有机相体积比为30∶70);
等度洗脱:流速0.35 ml/min;
进样量:2 μl;
柱温:25 ℃。安捷伦质谱仪:采用电喷雾离子源,在正离子电离模式下,选用多反应监测的质谱扫描方法进行测定,利奈唑胺和利福喷丁的监测离子对的质荷比(m/z)分别为:338.1→296.1和877.4→845.3。通过标准品优化后,主要质谱参数如下:离子源温度为350 ℃;
脱溶剂气体流率为10 L/min;
碰撞电压为利奈唑胺17 V,内标利福喷丁16 V;
毛细管电喷雾电压:4000 V。
三、指标判定
1.血液系统毒性发生的判定:血液系统毒性根据血常规数据判定。治疗开始前血常规检查结果作为基线值,治疗后的血常规结果用于评估血液系统毒性的发生。白细胞计数<4×109/L(男性<3.5×109/L)判定为白细胞减少;
血红蛋白<110 g/L定义为贫血;
血小板计数低于正常值(<100×109/L)或低于基础值的75%,定义为血小板减少症。
2.肝肾功能评估:肝功能指标选取ALT、AST、TBIL、ALP;
肾功能指标选取血清肌酐值。ALT≥3倍正常值上限(upper limits of normal,ULN)和(或)TBIL≥2倍ULN,或AST、ALP和TBIL同时升高,且至少1项≥2倍ULN,定义为肝功能异常[17]。根据CKD-EPI公式,估算肾小球滤过率(eGFR)<80 ml/min,定义为肾功能异常。
四、统计学处理
采用SPSS 20.0软件对数据进行统计分析。偏态分布的计量资料以“中位数(四分位数)[M(Q1,Q3)]”描述,组间差异的比较采用秩和检验;
计数资料以“百分率/构成比(%)”描述,组间差异的比较采用χ2检验;
通过绘制受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)确定血药浓度(峰浓度)对血液系统毒性的诊断价值,并确定最佳诊断临界值;
采用多因素logistic回归分析研究对象发生血液系统毒性的影响因素;
以P<0.05为差异有统计学意义。
一、血液系统毒性发生情况
219例研究对象进行了利奈唑胺血药峰浓度的测定及血液系统毒性反应的分析,其中,92例(42.0%)发生了血液系统毒性反应,包括白细胞计数减少[15.5%(34/219)]、贫血[21.5%(47/219)]、血小板减少症[27.4%(60/219)]等,127例(58.0%)未发生任何相关毒性反应。女性、体质量≤55 kg者、血清白蛋白<40 g/L者发生血液系统毒性反应的比例明显高于男性、体质量>55 kg者、血清白蛋白≥40 g/L者,差异均有统计学意义;
血液系统毒性反应者利奈唑胺峰浓度明显高于未发生者,差异有统计学意义。女性和体质量≤55 kg者发生白细胞减少的比例明显高于男性和体质量>55 kg者,差异均有统计学意义;
发生白细胞减少者利奈唑胺峰浓度明显高于未发生者,差异有统计学意义。女性、体质量≤55 kg者、血清白蛋白<40 g/L者发生贫血和血小板减少症的比例明显高于男性、体质量>55 kg者、血清白蛋白≥40 g/L者,差异均有统计学意义;
发生贫血和血小板减少症者利奈唑胺峰浓度均明显高于未发生者,差异均有统计学意义。具体见表1。

二、 血液系统毒性反应影响因素分析
1.利奈唑胺血药峰浓度对血液系统毒性的预测分析:以利奈唑胺血药峰浓度为检验变量,是否发生血液系统毒性为状态变量,绘制ROC曲线,计算预测因子的ROC曲线下面积(AUC)来评估预测效能。结果显示,利奈唑胺血药峰浓度的AUC值为0.627(95%CI:0.550~0.704),当约登指数为0.246时最大,此时对应血药峰浓度为20.7 μg/ml,作为最佳诊断临界值点(图1)。
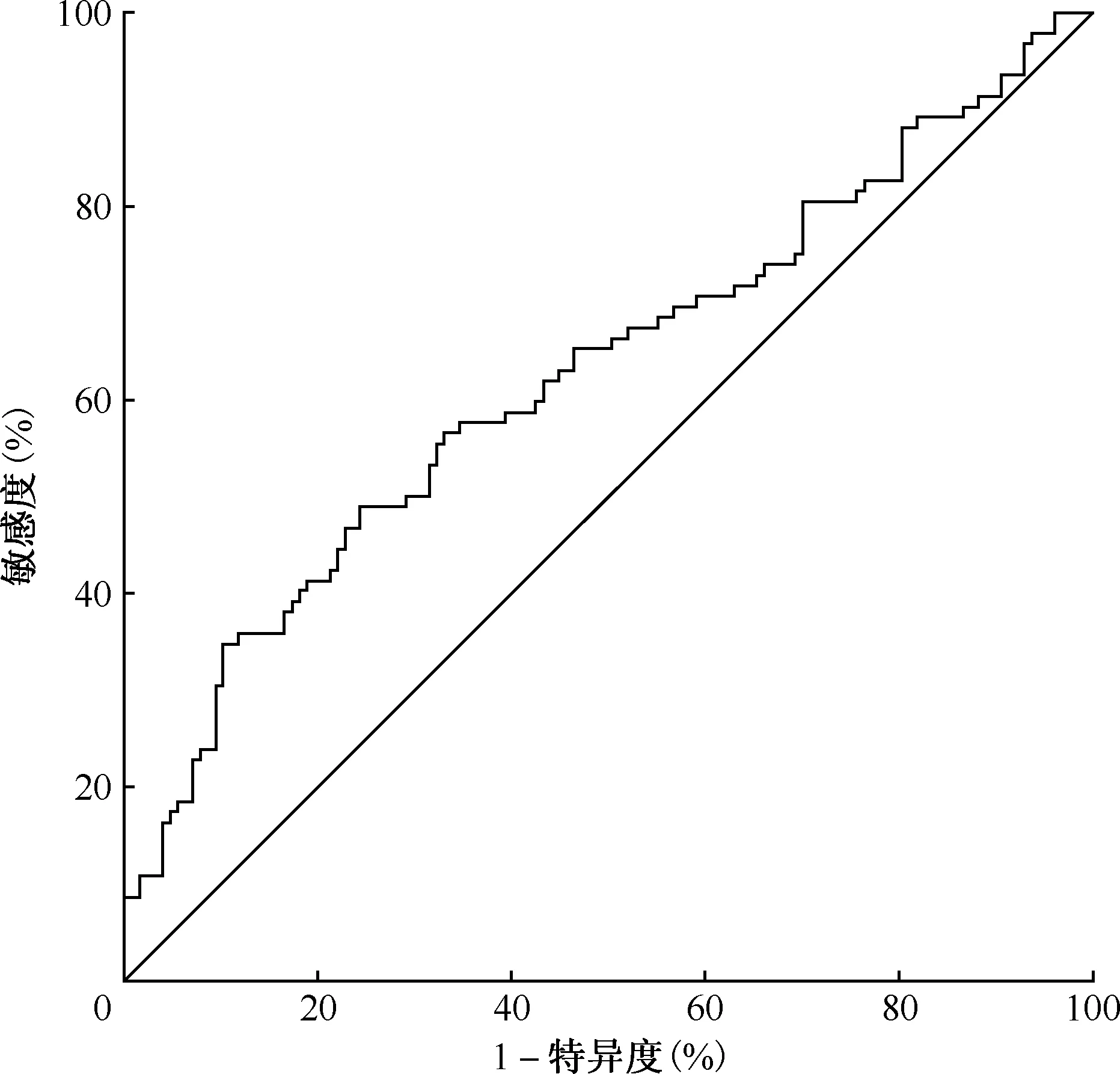
图1 耐药结核病患者利奈唑胺血药峰浓度对发生血液系统毒性预测的受试者工作特征曲线
2.影响因素分析:采用多因素logistic回归分析,以是否发生血液系统毒性为因变量,把经单因素分析后差异具有统计学意义的变量赋值(表2)并纳入模型,结果显示,血清白蛋白<40 g/L者血液系统毒性发生的风险是血清白蛋白≥40 g/L者的2.622倍,利奈唑胺血药峰浓度>20.7 μg/ml者血液系统毒性发生的风险是血药峰浓度≤20.7 μg/ml者的6.419倍,见表3。

表2 多因素logistic回归分析变量赋值情况

表3 应用含利奈唑胺化疗方案治疗的耐药结核病患者发生血液系统毒性影响因素的多因素logistic回归分析
利奈唑胺是耐药结核病治疗的重要药物,但临床应用过程中血液系统毒性等不良反应发生较常见,发生不良反应易导致患者中断治疗或停药,使疗效降低或产生耐药性,因此,不良反应的早期发现和预警具有重要意义。研究表明,在耐药结核病患者中利奈唑胺引起的血液系统毒性发生率较高[18-20],主要表现为白细胞减少、贫血和血小板减少症。使用利奈唑胺2周以上的患者易发生血小板减少症和贫血[20]。本研究中219例应用利奈唑胺治疗的耐药结核病患者血液系统毒性的发生比例为42.0%,白细胞减少发生比例为15.5%,贫血发生比例为21.5%,血小板减少症发生比例为27.4%,与上述研究一致。
目前,对利奈唑胺致血液系统毒性的危险因素研究较多,但研究结果各有差异[11,15-16]。有研究报道,利奈唑胺血药浓度与血液系统毒性存在相关性[9, 21-22],多项回归分析进一步显示,利奈唑胺相关血小板减少症可能呈浓度依赖[23-26]。因此,笔者进行了耐药结核病患者利奈唑胺血药浓度及其他相关因素与血液系统毒性发生情况的分析。结果表明,发生血液系统毒性的患者利奈唑胺峰浓度明显高于未发生血液系统毒性的患者。多因素logistic回归分析显示,利奈唑胺血药峰浓度>20.7 μg/ml者血液系统毒性发生风险是血药峰浓度≤20.7 μg/ml者的6.419倍,是血液系统毒性发生的独立危险因素。利奈唑胺的作用机制是与细菌50S亚基上核糖体RNA的23S位点结合,阻止形成70S始动复合物,从而抑制细菌蛋白质的合成,发挥抑菌作用,而血液系统毒性的发生是与人体线粒体毒性相关的骨髓抑制导致的[27],当患者应用利奈唑胺时,不仅会与结核分枝杆菌核糖体结合,还可能会与人体线粒体核糖体结合而抑制线粒体蛋白合成,导致血液系统毒性的发生。血药浓度高于线粒体蛋白合成的半抑制浓度时,会产生人体线粒体毒性,导致血液系统毒性的发生。由此可见,在耐药结核病患者中,血药浓度过高,患者易发生血液系统毒性。
笔者分析发现,发生血液系统毒性的患者利奈唑胺血药峰浓度明显高于未发生血液系统毒性者,体质量和血清白蛋白水平均明显低于未发生血液系统毒性者;
发生血液系统毒性女性患者比例明显高于未发生血液系统毒性者。利奈唑胺血药峰浓度、性别、体质量对白细胞减少、贫血和血小板减少症的发生均产生影响,血清白蛋白水平主要对贫血和血小板减少症产生影响。这一结果与Natsumoto等[28]和Niwa等[29]研究发现的体质量对血液系统毒性的发生有影响是一致的。Natsumoto等[28]研究表明,较高的每日每千克利奈唑胺给药剂量与血液系统毒性的发生明显相关;
Niwa等[29]研究表明,体质量<55 kg是利奈唑胺血液系统毒性发生的危险因素。同时,朱熙等[30]研究也发现,基础白蛋白<25 g/L 是利奈唑胺血液系统毒性发生的独立危险因素。
多因素logistic回归分析结果显示,应用含利奈唑胺化疗方案治疗的耐药结核病患者利奈唑胺血药峰浓度>20.7 μg/ml和血清白蛋白<40 g/L是血液系统毒性发生的影响因素。这与以往的研究结论基本一致[30-31]。利奈唑胺的血药浓度在不同患者中波动较大,需要进行血药浓度监测[32-33]。因此,临床应用利奈唑胺时,需要进行治疗药物浓度监测,并且给营养不良患者加强营养,提高体质量,可能会使利奈唑胺发挥更好的疗效,提高安全性。本研究结果发现血清白蛋白<40 g/L是发生血液系统毒性的独立危险因素,这与在利奈唑胺治疗期间接受人血清白蛋白治疗的患者很少发生药物性血小板减少症是相符的[31],血清白蛋白的保护机制还需进一步研究。因此,临床应用利奈唑胺治疗时,建议对有低蛋白血症的患者注意进行血常规检查。
利益冲突所有作者均声明不存在利益冲突
作者贡献王红红:酝酿和设计实验、实施研究、采集数据、分析/解释数据、起草文章、统计分析;
郭少晨:酝酿和设计实验、实施研究、采集数据、行政/技术/材料支持;
周文强:酝酿和设计实验、实施研究、采集数据;
刘忠泉:酝酿和设计实验、采集数据、行政/技术/材料支持;
朱慧:酝酿和设计实验、实施研究、采集数据、对文章的知识性内容作批评性审阅;
陆宇:酝酿和设计实验、实施研究、分析/解释数据、对文章的知识性内容作批评性审阅、获取研究经费、指导