漆黄素对高糖诱导视网膜Müller细胞氧化应激炎症反应的作用
来源:优秀文章 发布时间:2023-03-10 点击:
胡千慧,曹睿,凌云,郁盛雪
(1.锦州医科大学口腔医学院;
2.锦州医科大学辽宁省糖尿病感知功能障碍重点实验室,辽宁 锦州 121000)
糖尿病全球发病率逐年升高,流行病学研究表明:到2030年,糖尿病的患病率将增加到7.7%,影响4.39亿成年人[1-2]。糖尿病并发症主要包括神经病变、肾病、视网膜病变及大血管并发症,其中糖尿病视网膜病变(diabetic retinopathy,DR)属于微血管并发症,可导致患者视力明显下降或视野缺失,重者可致失明[3-4]。Müller细胞是视网膜细胞中最主要的神经胶质细胞,与视网膜血管和视网膜神经元密切接触,主要作用包括神经递质传导、调节视网膜血流、维持血视网膜屏障,控制视网膜代谢及营养物质供应,并与DR密切相关[5]。
漆黄素(FIS)是一种黄酮醇,主要存在于水果、蔬菜、坚果、豆类中,具有抗氧化、抗炎、抗癌、抗病毒、抗血管生成、免疫调节及神经保护[6]等多种生物学特性。漆黄素可通过上调还原型谷胱甘肽(glutathione,GSH)、SOD水平及减少MDA含量发挥抗氧化作用,从而改善帕金森小鼠脑组织氧化损伤[7]。在小鼠肝缺血再灌注损伤模型中,漆黄素能够减轻IL-1β、IL-18、TNF-α及NLRP3炎症小体表达,增加肝组织中p-GSK3β、p-AMPK蛋白表达来减轻肝缺血再灌注损伤[8]。漆黄素还与Akt-GSK3β信号通路密切相关,它通过调节PTEN-Akt-GSK3β信号通路抑制三阴性乳腺癌、肺癌的转移与侵袭[9]。
有研究证实漆黄素通过抑制 β 淀粉样蛋白生成和Tau蛋白磷酸化等,减轻神经毒性损伤,改善记忆功能发挥神经保护作用;
漆黄素在PD模型中提高MPTP 小鼠脑组织的GSH、SOD、T-AOC 水平,降低MDA 含量,改善 MPTP 诱导的 PD小鼠脑内ROS产生与清除之间的失衡,改善 MPTP 小鼠脑组织的氧化损伤发挥神经保护作用[10]。目前尚不清楚漆黄素是否对DR起治疗作用。本研究以视网膜Müller细胞为研究对象,旨在探讨漆黄素对高糖条件下Müller的潜在影响及作用,包括ROS的产生、抗氧化应激作用及炎症因子的表达及其分子机制,为漆黄素治疗DR提供基础理论依据。
1.1 细胞、试剂与仪器
Müller细胞系(上海宾穗生物科技),漆黄素(纯度>98%,成都曼思特生物科技)。DME/F12培养液(Hyclone),胎牛血清(Aus GeneX),青链霉素双抗、胰蛋白酶(索莱宝),二甲基亚砜(Sigma),增强型细胞增殖活力(CCK-8)检测试剂盒(上海尚宝生物科技),活性氧检测试剂盒、线粒体膜通透性转换孔、BCA法蛋白检测试剂盒、ECL显影剂、超氧化物歧化酶试剂盒、丙二醛含量试剂盒、JC-1检测试剂盒(索莱宝),通用型高灵敏度染料法定量PCR检测试剂盒(南京诺唯赞生物科技),反转录试剂盒(Thermo),(IL-β、IL-6 、TNF-α)mRNA(华大基因),单克隆抗β-Actin(华美生物),磷酸化丝氨酸-苏氨酸激酶(p-Akt)、磷酸化糖原合成酶激酶-3 (p-GSK-3β)(Affinity),HRP标记二抗(protein-tech)。细胞微孔板成像系统cytation5(美国Biotek),倒置相差显微镜(日本奥林巴斯),电泳仪(北京六一)、NANO DROP 2000C(Thermo)、荧光定量PCR仪、化学发光凝胶成像系统(美国伯乐)。
1.2 实验分组
本实验分为两部分,第一部分通过CCK8明确漆黄素生物安全性,确定高糖模型浓度及漆黄素有效浓度。首先在含有Müller细胞的培养基中分别加入不同浓度漆黄素(0、25、50、75、100 μmol/L)作用48 h检测细胞增殖活力;
其次分别加入(0、25、50、100 mmol/L)浓度的葡萄糖作用48 h检测细胞增殖活力,确定最终高糖模型浓度;
最后分别加入(25、50、75、100 mmoL/L)浓度漆黄素预处理2 h后再加入确定后高糖的浓度培养48 h检测细胞增殖活力,确定漆黄素有效浓度。第二部分实验分为4组,分别是正常对照组(Control)、高糖组(HG)、漆黄素组(FIS)以及TCBN抑制剂组。Control组:正常培养Müller细胞;
HG组:培养基中加入 100 mmol/L高糖培养作用48 h;
FIS组:培养基中分别加入75 μmol/L 漆黄素预处理2 h后加入 100 mmol/L高糖培养48 h;
TCBN抑制剂组:培养基中加入漆黄素 75 μmol/L+ 1 μmol/L TCBN预处理2 h,然后加入100 mmol/L 高糖培养48 h。以上细胞处理时间及TCBN浓度根据相关文献确定。
1.3 CCK-8检测细胞增殖活性
取对数生长期Müller细胞,接种于96孔板中,密度调整至每孔1×105个细胞,每孔100 μL,放入培养箱培养。细胞培养24 h后向各孔加入10 μL不同浓度的葡萄糖和漆黄素,同时设置空白对照组,以每个浓度为1组,每组分别设5个平行复孔。将96孔培养板放入培养箱中继续培养48 h,每孔加入10 μL增强型CCK-8试剂,放入培养箱孵育2 h,用Cytation5测定490 nm处的吸光度(A)值。细胞存活率(%)=[A(加药)-A(空白)]/ [A(对照)-A(空白)]×100%。
根据细胞增殖活性检测结果,最终确定浓度100 mmol/L为高糖模型,75 μmol/L漆黄素是药物最佳浓度,用于后续实验。
1.4 氧化应激指标测定
检测MDA含量和SOD活性,各组Müller细胞给药处理48 h后收集细胞,超声波破碎,离心取上清液。采用硫代巴比妥酸比色法测定 MDA 含量,黄嘌呤氧化酶法测定 SOD 活性,严格按照试剂盒说明方法进行操作,使用细胞微孔板成相系统(Cytation5)405 nm 处测定各孔(A)值,表示MDA含量及SOD活性。
DCFH-DA荧光探针检测细胞内活性氧(reactive oxygen species,ROS)水平,各组Müller细胞给药处理48 h后,加入终浓度10 mmol/L DCFH-DA,放入37 ℃培养箱孵育20 min,使其与细胞充分接触,后用无血清培养基洗涤3次,调节488 nm激发波长,Cytation5观察细胞内荧光表达强度,放大倍数20倍。同一实验平行重复3次。
JC-1法检测线粒体膜电位(MMP),各组Müller细胞重悬后接种于24孔培养板中,待细胞贴壁后按照各组要求处理48 h,之后弃掉培养基,PBS冲洗2次,将含有Jc-1探针的空白培养基(1 μg/mL)加入24孔培养板中,放入37 ℃培养箱孵育20 min ,调节激发波长为488 nm和543 nm,Cytation5观察细胞内荧光表达强度。
检测线粒体膜通透性转换孔(mPTP)开放水平,各组Müller细胞重悬后接种于24孔培养板中,待细胞贴壁后按照各组要求处理48 h,之后弃掉培养基,PBS冲洗2次。按照检测试剂盒分别加入适当体积染色工作液,放入37 ℃培养箱避光孵育40 min。之后更换成新鲜的37 ℃预热的培养基,再次放入37 ℃培养箱避光孵育30 min,之后弃掉培养基,PBS冲洗3次,最后加入检测缓冲液,调节激发波长为488 nm,Cytation5观察细胞线mPTP开放水平。
1.5 免疫荧光检测IL-1、IL-6、TNF-α炎症因子表达
各组Müller细胞给药处理48 h后,PBS冲洗3次;
4%多聚甲醛固定25 min,PBS冲洗3次;
0.1%TritonX-100通透细胞30 min,PBS冲洗3次;
0.1%BSA。
室温封闭60 min。加入IL-1、IL-6、TNF-α抗体(1∶500)4 ℃过夜,取出后室温复温放置60 min,PBS冲洗3次,加入二抗anti-mouse,488-conjugated,fluor 647-conjugated anti-rabbit(1∶500)室温放置2 h,PBS避光冲洗3次,最后用含DAPI染色剂封片。Cytation5观察细胞内IL-1、IL-6、TNF-α荧光表达水平并拍照。
1.6 qPCR 法检测各组细胞中IL-1、IL-6、TNF-α mRNA的表达
各组Müller细胞给药处理48 h后,Trizol法提取细胞总RNA,测定总RNA浓度,逆转录合成cDNA,PCR扩增,配制20 μL扩增反应体系。PCR设置反应条件:95 ℃ 5 min、95 ℃ 10 s、 55 ℃ 20 s、72 ℃ 20 s,30个循环。每个组别设置3个复孔。扩增完毕后,采用2-△△Ct 法计算IL-1、IL-6、TNF-α mRNA的相对表达量。引物序列如下:

表1 qPCR所用引物系列
1.7 免疫印迹法测定IL-1、IL-6、TNF-α、 p-Akt、p-GSK3β蛋白表达
各组Müller细胞给药处理48 h后,进行相应蛋白测定。RIPA细胞裂解液提取各组细胞全蛋白,经BCA法测定蛋白质含量,取蛋白样20 μg与上样缓冲液混合后100 ℃煮沸10 min,10% SDS-聚丙烯酰胺凝胶分离蛋白质,湿转法转移至硝酸纤维素膜上,5% BSA封闭,放入一抗IL-1、IL-6、TNF-α、 p-Akt、p-GSK3β(1∶1000)4 ℃杂交过夜。将硝酸纤维素膜经TBST冲洗3次后放入二抗(1∶5000)孵育1~2 h。冲洗后吸去多余液体,增强化学发光法检测,化学发光凝胶系统分析仪成像,以β-actin作为内参,Image J软件分析条带灰度值,计算相对表达量。
1.8 统计学方法

2.1 漆黄素对高糖诱导 Müller细胞增殖活力的影响
CCK8结果显示,与对照组相比,100 μmol/L漆黄素降低细胞增殖活力(P<0.05),100 μmol/L以下是安全剂量范围,见图1(a);
与对照组相比,100 mmol/L葡萄糖可明显降低细胞增殖活力(P<0.01),见图1(b);
本研究选用100 mmol/L葡萄糖进行后续实验。与HG组比较,25、50 μmol/L的漆黄素对高糖诱导Müller细胞增殖活力没有作用(P>0.05);
75 μmol/L漆黄素能够抑制高糖诱导后Müller细胞增殖活力降低(P<0.05);
而100 μmol/L的漆黄素组反而降低Müller细胞增殖活力(P<0.05),见图1(c)。以上结果提示75 μmol/L漆黄素能够抑制高糖诱导后Müller细胞增殖活力下降。

**P<0.01 vs Control,## P<0.01vs HG
2.2 漆黄素对高糖诱导Müller细胞氧化应激水平的影响
2.2.1 漆黄素对高糖诱导Müller细胞MDA及SOD含量的影响
丙二醛(MDA)含量是反映机体抗氧化能力的参数,以及体内脂质过氧化的程度,从而间接的反映出机体组织及细胞过氧化损伤的程度。超氧化物歧化酶(SOD)是生物体内一种重要的抗氧化酶,其活性可反应出机体抗氧化能力。实验各组细胞MDA和SOD水平比较,结果显示HG组MDA含量明显高于与对照组,SOD活性明显低于对照组(P<0.05),漆黄素组MDA含量明显低于HG组,SOD活性明显高于HG组(P<0.05),TCBN组MDA含量明显高于漆黄素组,SOD活性明显低于漆黄素组(P<0.05),见图2。

**P<0.01vs Control,##P<0.01vs HG,&& P<0.01vs FIS
2.2.2 漆黄素对高糖诱导Müller细胞ROS水平的影响
ROS参与氧化应激反应,病理条件下ROS的产生和清除失去了正常平衡,ROS 浓度持续升高或持续时间过长会引起蛋白质损伤和脂质过氧化反应等,产生细胞毒性。结果显示,HG组ROS荧光强度明显高于与对照组,漆黄素组ROS荧光强度明显低于HG组,TCBN组ROS荧光强度明显高于漆黄素组,见图3。

(a):荧光图(20×);
(b):平均光密度分析
2.2.3 漆黄素对高糖诱导Müller细胞mPTP的影响
mPTP开放导致线粒体损伤及细胞凋亡,绿色荧光越强,说明mPTP开放程度越低,相反绿色荧光越弱,开放程度越高。结果显示,HG组mPTP绿色荧光强度明显低于对照组,漆黄素组mTPT绿红色荧光强度明显高于HG组,TCBN组mPTP绿色荧光强度明显低于漆黄素组,见图4。

(a):荧光图(20×);
(b):平均光密度分析
2.2.4 漆黄素对高糖诱导Müller细胞MMP水平的影响
MMP的下降是细胞凋亡早期的一个标志性事件。当MMP较高时,JC-1聚集在线粒体基质中形成聚合物,产生红色荧光;
当MMP较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体,产生绿色荧光。结果显示,HG组红色荧光强度低于对照组,而绿色荧光强度明显高于与对照组,漆黄素组红色荧光强度高于HG组,绿色荧光强度明显低于HG组,TCBN组红色荧光强度低于漆黄素组,绿色荧光强度明显高于漆黄素组,见图5。以上结果提示漆黄素通过降低高糖诱导Müller细胞MDA含量、抑制ROS产生、稳定MMP、抑制MPTP开放及增加SOD活性来抑制氧化应激反应,而这种作用能被Akt抑制剂TCBN所阻断,我们推测漆黄素可能通过Akt/GSK3β信号通路发挥抗氧化作用。
2.3 漆黄素对高糖诱导的Müller细胞IL-1、IL-6、TNF-α炎症因子水平表达的影响
免疫荧光结果显示,HG组Müller细胞IL-1、IL-6、TNF-α荧光表达强度明显高于对照组;
漆黄素组各炎症因子荧光强度比HG组明显减弱;
TCBN组各炎症因子荧光强度比漆黄素组增强,见图6。

(a~c):荧光图(20×);
(d~f):IL-1β、IL-6、TNF-α平均光密度分析
qPCR和Western Blot结果显示,HG组IL-1、IL-6、TNF-α mRNA及蛋白表达比对照组明显增加(P<0.05);
漆黄素组各炎症因子mRNA及蛋白表达比HG组明显降低(P<0.05);
TCBN组各炎症因子mRNA及蛋白比漆黄素组明显表达增加(P<0.05),见图7。以上结果提示漆黄素能够减少高糖诱导诱导Müller细胞炎症因子表达水平,而这种作用能被Akt抑制剂TCBN所阻断。
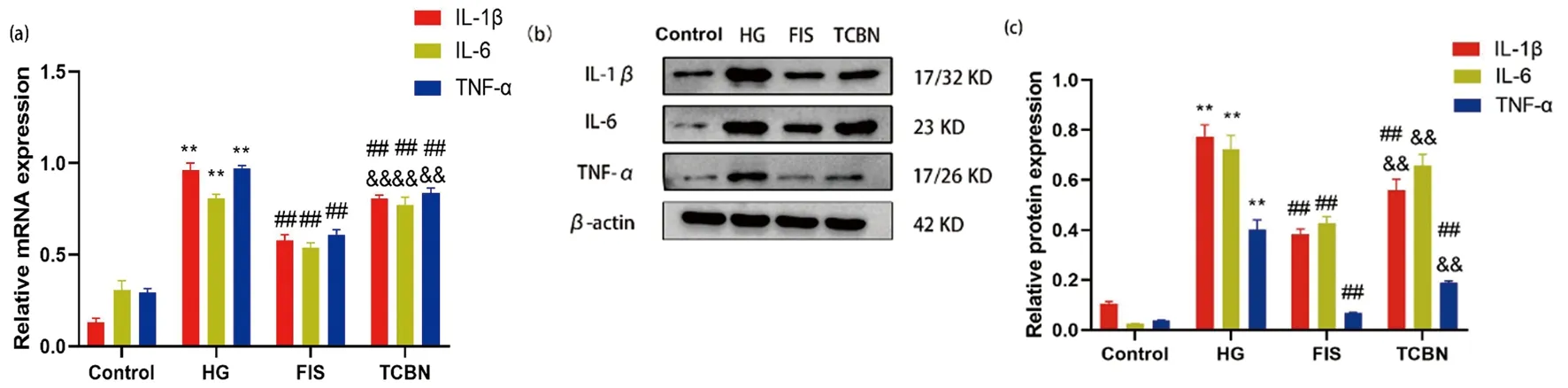
(a):各组细胞IL-1β、IL-6、TNF-α mRNA表达;
(b~c):各组细胞IL-1β、IL-6、TNF-α蛋白表达及半定量分析
2.4 漆黄素对高糖诱导Müller细胞p-Akt、p-GSK3β蛋白水平表达的影响
Western Blot结果显示,HG组p-Akt、p-GSK3β蛋白表达明显低于对照组(P<0.05);
漆黄素组p-Akt、p-GSK3β蛋白表达明显高于HG组增加(P<0.05);
TCBN组p-Akt、p-GSK3β蛋白表达较漆黄素组明显减少(P<0.05),见图8。以上结果提示漆黄素可能通过激活Akt/GSK3β信号通路发挥抗氧抗炎作用,而这种作用能被Akt抑制剂TCBN所阻断。

(a):各组细胞p-Akt、p-GSK3β蛋白表达;
(b):各组细胞p-Akt、p-GSK3β半定量分析
慢性炎症和氧化应激是DR发病重要因素,其特征是血管和视网膜神经元变性[11]。高血糖能引起体内细胞ROS产生增多,当过度ROS的产生与内源性抗氧化因子清除ROS的能力不平衡时,就会发生氧化应激,其特征是ROS诱导的促炎因子和促血管生成因子的过表达,这些因子会损伤神经胶质细胞和神经元,造成组织细胞结构或功能障碍,进而影响整个视网膜[12]。因Müller细胞贯穿于视网膜全层,且与DR发病密切相关,所以本研究选用高糖刺激Müller细胞做为体外模型来研究漆黄素在高糖环境下对Müller细胞的作用,结果显示,高糖刺激后Müller细胞MDA含量大幅度增加,SOD活性明显下降及产生大量ROS,说明高糖刺激后Müller细胞处于氧化应激状态,ROS量升高超出机体的清除能力,导致细胞内线粒体膜系统受到损伤。
mPTP是跨越线粒体内外膜的通道,是由蛋白质组成的复合体,当线粒体内Ca2+超载、过度氧化应激,ROS的大量产生时会导致mPTP呈不可逆性高水平开放,导致线粒体肿胀,线粒体跨膜电位降低,释放促凋亡因子及抑制BCL-2抗凋亡因子的产生,诱导细胞凋亡[13]。有研究报道天麻素抑制氧化应激时心肌细胞mPTP开放,稳定MMP,从而发挥抗氧化作用保护心肌细胞[14]。本研究发现高糖损伤后ROS大量产生,导致mPTP开放,而漆黄素干预后抑制Müller细胞ROS的产生,进而抑制mPTP开放,随后应用JC-1染色观察MMP,发现高糖组mPTP开放时可以导致MMP显著下降,漆黄素干预后可有效的抑制mPTP开放,维持MMP相对稳定,与文献报道相一致。炎症-免疫反应也是近几年来DR治疗的热点,越来越多的证据表明炎症是DR发生的关键因素。Müller细胞参与构成血-视网膜屏障,也是IL-1、IL-6、TNF-α等炎症因子的主要来源。糖尿病状态下激活NF-κB、IL-1β、IL-6、TNF-α等炎症因子,导致Müller细胞发生活化,活化的细胞胞体肥大肿胀,肥大的胞体及突触进入已闭合血管内形成瘢痕,晚期又参与其它血管的生成。因此,早期干预Müller细胞抑制其活化很有必要。有文献报道TNF-α促进活化的Müller细胞的胶质细胞增生和炎症反应,从而加重青光眼RGC的损伤[15]。另有研究报道非增殖型DR患者眼部组织中各种炎症因子IL-1β、IL-6、IL-8、TNF-α和MCP-1水平升高,激活的胶质细胞,内皮细胞产生的这些细胞因子的增加,突出了这些炎症细胞因子在DR早期的活性增加,这些炎症介质的积累是糖尿病患者视网膜神经元细胞的早期死亡的原因之一。现阶段临床上使用非甾体类抗炎药如阿司匹林来治疗DR,临床效果稳定且良好,这也从临床方面证实了炎症反应在DR发病中的作用。本研究结果显示高糖刺激后IL-1β、IL-6、TNF-α炎症因子表达增多,漆黄素处理后表达显著下降,与文献报道相一致。
Akt/GSK-3β信号通路在细胞生长、存活、细胞凋亡及信号转导中发挥重要作用,Akt是丝氨酸/苏氨酸激酶,可通过抑制凋亡信号从而保护细胞免于凋亡,糖原合成酶激酶-3(glycogen synthase kinase-3β,GSK3β)是活化的Ser/Thr 蛋白激酶,可调节糖原代谢和细胞凋亡[16]。已有文献报道,激活Akt 信号通路可保护氧化应激损伤导致的小鼠原代神经元凋亡;
提高磷酸化 GSK 3β(Ser9),从而保护线粒体免受铁诱导的氧化应激[17]。本研究结果显示漆黄素能够抑制高糖刺激Müller细胞氧化应激反应及炎症因子表达,增加p-Akt及p-GSK 3β蛋白表达。而加入Akt抑制剂TCBN后结果显示漆黄素的抗氧化应激及抗炎作用被阻断,p-Akt及p-GSK 3β蛋白表达下降,所以我们推测漆黄素是通过激活Akt/GSK 3β发挥作用。
综上所述,在高糖刺激氧化应激损伤模型中,漆黄素通过降低细胞内MDA含量、增加SOD活性、抑制ROS产生、mTPT开放来维持MMP稳定,减少炎症因子表达从而减轻氧化应激损伤,这种作用与激活Akt/GSK 3β信号通路有关。但漆黄素对高糖刺激后氧化应激和炎症与线粒体深入机制还需深入研究。
猜你喜欢 黄素高糖氧化应激 基于炎症-氧化应激角度探讨中药对新型冠状病毒肺炎的干预作用世界科学技术-中医药现代化(2020年2期)2020-07-25穿越时光的黄素石楼海峡姐妹(2019年8期)2019-09-03当药黄素抗抑郁作用研究天然产物研究与开发(2019年1期)2019-03-01葛根素对高糖诱导HUVEC-12细胞氧化损伤的保护作用中成药(2018年6期)2018-07-11当药黄素对H2O2诱导PC12细胞损伤的保护作用天然产物研究与开发(2018年1期)2018-02-02漆黄素固体分散体的制备中成药(2017年12期)2018-01-19丹红注射液对高糖引起腹膜间皮细胞损伤的作用中成药(2017年8期)2017-11-22芝麻素对高糖损伤SH-SY5Y细胞的保护效果及机制中成药(2016年8期)2016-05-17氧化应激与糖尿病视网膜病变西南军医(2016年6期)2016-01-23乙肝病毒S蛋白对人精子氧化应激的影响癌变·畸变·突变(2015年3期)2015-02-27推荐访问:应激 视网膜 炎症