甘蔗叶多糖的分离纯化及其体外活性分析
来源:优秀文章 发布时间:2023-03-01 点击:
韦巧艳,严德林,陈远菲,苏喜德,赵海燕,覃逸明
甘蔗叶多糖的分离纯化及其体外活性分析
韦巧艳1,严德林1,陈远菲1,苏喜德2,赵海燕1,覃逸明1
(1. 广西科技师范学院食品与生化工程学院,来宾 546199;
2. 广西来宾湘桂糖业有限责任公司,来宾 546199)
以甘蔗叶为原料,采用机械力辅助超声法提取甘蔗叶粗多糖。经除蛋白、除色素、除小分子杂质等预处理后,用DEAE-52纤维素离子柱及DEAE-琼脂糖凝胶FF离子柱对甘蔗叶粗多糖进行分离纯化,得到SCLP-1和SCLP-5两种甘蔗叶纯多糖,并对其红外吸收特征、抑菌性能和抗氧化性能进行进一步研究。结果表明:甘蔗叶粗多糖提取率为1.8%,除蛋白率为39.8%,除蛋白过程多糖保留率为58.6%,除色素率为67.9%;
除色素过程的多糖保留率为60.2%,除小分子杂质过程的多糖保留率为96.8%。红外光谱扫描结果显示, SCLP-1和SCLP-5这两种甘蔗叶纯多糖均具有多糖特征吸收峰;
抗氧化试验结果显示,SCLP-5的抗氧化能力略高于SCLP-1的抗氧化性但均低于VC;
抑菌试验结果显示,两种纯化组分对大肠杆菌和金黄色葡萄球菌均有良好的抑制作用,且对大肠杆菌的抑制效果优于金黄色葡萄球菌。
甘蔗叶;
多糖;
分离纯化;
抗氧化;
抑菌性;
红外光谱
甘蔗(L.)是光合作用和生物量生产效率最高的作物之一[1]。甘蔗叶是甘蔗收获后剩下的青绿叶片,是甘蔗糖业生产中的主要废弃物之一,资源丰富。据统计每生产1 t的蔗糖,将产生1 ~ 2 t的甘蔗叶,这些蔗叶通常被丢弃或用作生物燃料的原料,不仅浪费资源还会造成环境污染[2]。甘蔗叶中含有纤维素(43%)、半纤维素(27%)、木质素(17%)以及少量的蛋白质和多糖等活性物质[3-4]。近年来,植物多糖因其具有显著的免疫调节、抗肿瘤、抗氧化、抗菌、降血脂等特殊的理化性质和较高的生物学功能而备受关注[5-8]。甘蔗叶多糖作为甘蔗叶的主要活性成分之一,其结构和生物学特性尚未得到深入的研究[9],限制了甘蔗叶多糖的开发利用。鉴于此,以甘蔗叶为原料,采用机械力辅助超声法提取甘蔗叶粗多糖,经sevag除蛋白、离子交换树脂吸附除色素、透析袋去除小分子杂质等预处理后,用DEAE-52纤维素离子柱及DEAE-琼脂糖凝胶FF离子柱对甘蔗叶粗多糖进行分离纯化,并对纯多糖的红外吸收特征、抑菌性能和抗氧化性能进行研究,以期为甘蔗叶多糖的生物活性研究和产品开发提供借鉴。
1.1 材料
甘蔗叶采集于来宾市周边甘蔗地,将收集的甘蔗叶洗净、烘干、粉碎,过60目筛,装袋备用;
葡萄糖标准品、DPPH、水杨酸、硫酸亚铁(均为分析纯):天津欧博凯化工有限公司;
浓硫酸、苯酚、牛血清蛋白V、考马斯亮蓝G250(均为分析纯)、MD55-3500透析袋:西陇科学有限公司;
无水乙醇、抗坏血酸(均为分析纯):成都市科隆化妆品有限公司;
大肠杆菌、金黄色葡萄球菌、营养琼脂干粉培养基:广东环凯微生物有限公司;
AB-8大孔吸附树脂、2.5 cm × 50 cm 层析柱:天津市光复精细化工研究所;
DEAE-52、DEAE-琼脂糖凝胶FF:上海源叶生物科技有限公司;
三羟甲基氨基甲烷:天津市科密欧化学试剂有限公司;
邻苯三酚:天津市大茂化学试剂厂。
800Y高速多功能粉碎机:武义海纳电器有限公司;
LM-SJ-5立式球磨机:无锡新洋设备科技有限公司;
数控超声波清洗仪KQ-300DB:昆山市超声仪器有限公司;
H3-20K台式高速离心机:可成仪器设备有限公司;
IRTracer-100傅里叶变换红外光谱仪:岛津管理企业有限公司。
1.2 方法
1.2.1 粗多糖的提取 基于课题组的前期研究,将粉碎后的甘蔗叶粉末用球磨机按照球料比(质量)45:1、70 min、20 Hz的工艺条件进行研磨预处理;
将预处理后的甘蔗叶粉末(5.00 g)溶于蒸馏水(125 mL)中,置于超声反应器内,于230 W、65 ℃下反应66 min;
然后将提取液离心(3 000 r·min-1,15 min),收集上清液,并用3倍体积的无水乙醇进行醇沉,静置1 h后离心(5 000 r·min-1,5 min),收集沉淀,干燥,得到甘蔗叶粗多糖。
1.2.2 甘蔗叶多糖提取率的测定 称取0.500 g葡萄糖标准品,用蒸馏水定容至500 mL,制成1mg·mL-1的葡萄糖标准溶液,随后分别稀释至0.01 ~ 0.10 mg·mL-1。将1.0 mL 2%苯酚和5.0 mL浓硫酸加入到上述配制好的稀释液中,摇匀,沸水浴15 min后取出,冷却至室温,以2 mL蒸馏水加1 mL 2 %苯酚和5.0 mL浓硫酸为空白,在波长490 nm处测其吸光度[10]。以吸光度A为纵坐标,葡萄糖的质量浓度C (μg·mL-1)为横坐标,绘制标准曲线,得到标准曲线回归方程为:=0.008 90.042 1(2= 0. 999 0),按照相同的方法测定样品的吸光度值代入标准曲线方程,求出样品相应的质量浓度,参照文献[11]中的方法计算甘蔗叶粗多糖的提取率。甘蔗叶粗多糖的提取率(%)计算如公式(1):

1.2.3 甘蔗叶多糖蛋白去除率的测定 参考王文平等[12]的方法并加以修改。称取10.00 mg牛血清白蛋白于100 mL容量瓶中,定容,即得0.1 mg·mL-1蛋白质标准溶液,放置4 ~ 5 ℃冰箱中保存备用。将50 mL 95 %乙醇溶于100.00 mg的考马斯亮蓝G- 250中,随后加入 85%磷酸100 mL,并用蒸馏水定容至1 L,置于棕色瓶中,备用。分别准确量取标准蛋白质溶液 0.0、0.2、0.4、0.6、0.8和1.0 mL于6支试管中, 并补充蒸馏水至1 mL,得到浓度分别为0.00、0.02、0.04、0.06、0.08和0.10 mg·mL-1的标准蛋白溶液,随后分别加入5 mL考马斯亮蓝G-250溶液混匀,放置 15 min,于波长595 nm处测定其吸光度。以吸光度值为纵坐标,牛血清蛋白的质量浓度C (μg·mL-1)为横坐标,绘制标准曲线,得到标准曲线回归方程为:= 0.004 9+0.006 3(2= 0. 999 2)。
将上述干燥后的粗多糖用蒸馏水定容至100 mL。用上述苯酚-硫酸法测其吸光度。吸取1 mL溶液于比色管中,用蒸馏水补至2 mL,加入1.0 mL 2 %苯酚和5.0 mL浓硫酸,摇匀,沸水浴加热15 min后拿出,冷却至室温,以2 mL蒸馏水加1 mL 2 %苯酚和5.0 mL浓硫酸为空白,在波长490 nm处测定其吸光度,按照葡萄糖标准曲线计算多糖含量。吸取1 mL溶液于比色管中,加入5 mL考马斯亮蓝 G-250 溶液,混匀,放置10 min,于波长595 nm处测定其吸光度,按照蛋白质标准曲线计算蛋白质含量。
参考范三红等[13]的方法略作修改。将 Sevag溶液 (三氯甲烷:正丁醇= 4:1)与多糖溶液混合后振荡30 min,离心(3 000 r·min-1,15 min)取上清液,分别按照公式(2)(3)计算多糖保留率和蛋白质去除率。


1.2.4 甘蔗叶多糖除色素 参考张华等[14]方法,在上述1.2.3脱蛋白后的多糖溶液(25 mL)中加入到经预处理后的AB-8大孔吸附树脂中进行震荡吸附,过滤,取上清液分别于490 和450 nm波长处测定吸光度值,根据公式(4)(5)分别计算多糖的保留率和色素去除率。


1.2.5 除小分子杂质 将1.2.4脱色素后的多糖溶液装入截留分子量为3 500 U的透析袋中,在磁力搅拌下透析36 h,每12 h换水1次[15]。用苯酚-硫酸法在波长490 nm处测定除小分子杂质多糖溶液吸光度,根据公式(6)计算多糖保留率。

1.2.6 DEAE-52型离子交换纤维素分离纯化 参考孙晓雪等[16]的方法将除杂后的多糖浓缩液20 mL倒入层析柱中进行上样。依次用蒸馏水、0.1 和0.2 mol·L-1的NaCl溶液各100 mL相继洗脱,每10 mL收集1管,以包括蒸馏水、0.1和0.2 mol·L-1NaCl洗脱液,洗脱速度为1和2 mL·min-1进行洗脱;
洗脱液用苯酚-硫酸法测吸光度,吸光值为纵坐标,以管数为横坐标,绘制洗脱曲线。
1.2.7 DEAE-琼脂糖凝胶FF分离纯化 参考孙鹤鹏使用的方法[17],将经DEAE-52离子交换纤维素柱纯化后的SCLP-1和SCLP-5多糖浓缩液各5 mL于DEAE-琼脂糖凝胶FF层析柱进行纯化,用蒸馏水、20%甲醇各45 mL进行洗脱,流速控制在1 mL·min-1,每5 mL收集1瓶,然后用苯酚-硫酸法测定吸光度,以管数为横坐标,吸光值为纵坐标分别绘制洗脱曲线。
1.2.8 多糖的红外表征 将溴化钾粉末烘干磨碎压片做背景,再将样品(甘蔗叶粗多糖、中性糖、酸性糖)分别与溴化钾粉末按1:100比例混合压片后放入红外光谱仪器中分别于400~4 000 cm-1进行扫描。
1.2.9 体外抗氧化活性测定 将VC和两种纯化多糖样品分别配制成8、16、24、32和40 μg·mL-1等5个浓度梯度溶液,备用。
(1)清除 DPPH·的能力。参考程丽敏等[18]的方法加以修改,制备0.01 mmol·mL-1的DPPH溶液,置于冰箱中保存,备用。将两种纯化多糖溶液分别按照表1进行加样,在暗处静置 30 min,于517 nm波长处测定吸光值,并以维生素C作阳性对照。按公式(7)计算 DPPH·的清除能力。

式(7)中:A为空白溶液吸光值;
A为样品溶液吸光值;
A为样品溶液吸光值。

表1 清除DPPH自由基的加样条件
(2)清除 O2-·的能力。参考文献[19]中的方法加以修改,制备Tris-HCl 缓冲液(5 mmol·L-1,pH = 8.2)、邻苯三酚溶液(2.5 mmol·L-1)。取2.25 mL Tris-HCl 缓冲液,于30 ℃水浴中水浴 20 min,按照表2进行加样,反应10 min后用紫外分光光度计在325 nm处测定吸光值A;
以蒸馏水代替样品测定吸光度A,以V作阳性对照,蒸馏水为空白清零。按式(8)计算 O2-·的清除能力。

式(8)中:A为空白溶液吸光值;
A为样品溶液吸光值。

表2 清除 O2-·的加样条件
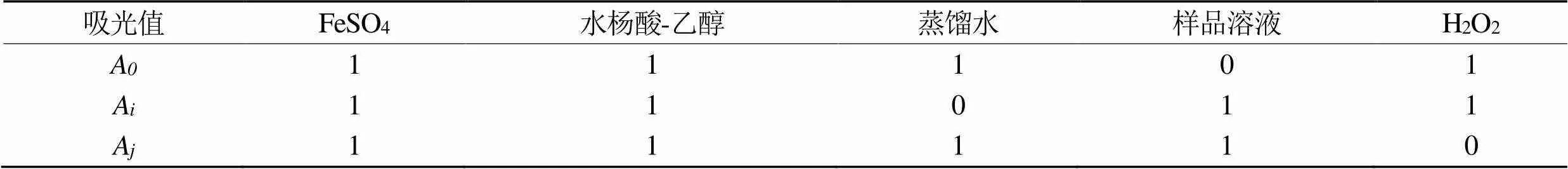
表3 清除·OH的加样条件
(3)清除·OH的能力。分别配制0.8 mmol·L-1H2O2、0.6 mmol·L-1的FeSO4和水杨酸-乙醇溶液,备用。取1 mL制备好的多糖溶液于试管中,按表3所示添加各试剂,混匀,10 min后,以VC作阳性对照,在510 nm下测定吸光度值,按式(7)计算·OH的清除能力。
1.2.10 抑菌活性 采用纸片扩散法测定两种纯化多糖的抑菌性能,滤纸片直径为6 mm,考察多糖浓度为8、16、24、32和40 μg·mL-1时对大肠杆菌及金黄色葡萄球菌的抑菌效果,以无菌生理盐水做空白对照,37℃条件下培养24 h,测量抑菌圈直径大小[20],每组试验平行测定3次,取平均值。抑菌圈直径越大,抑菌效果越好。
2.1 分离纯化前的预处理
通过计算得出甘蔗叶多糖的提取率为1.8%,Sevag法的蛋白质去除率为39.8%,多糖保留率为58.6%。大孔吸附树脂除色素率为67.9%,多糖保留率为60.2%,表明大孔吸附树脂的除色素率高。除小分子杂质过程的多糖保留率为96.8%。

(a)为洗脱速度1 mL·min-1;
(b)为洗脱速度2 mL·min-1。
Figure 1 Elution curves of crude polysaccharides from sugarcane leaves at different elution rates

(a)为0.1 mol·L-1 NaCl;
(b)为0.2 mol·L-1 NaCl。
Figure 2 Elution curves of crude polysaccharides from sugarcane leaves at different NaCl concentrations
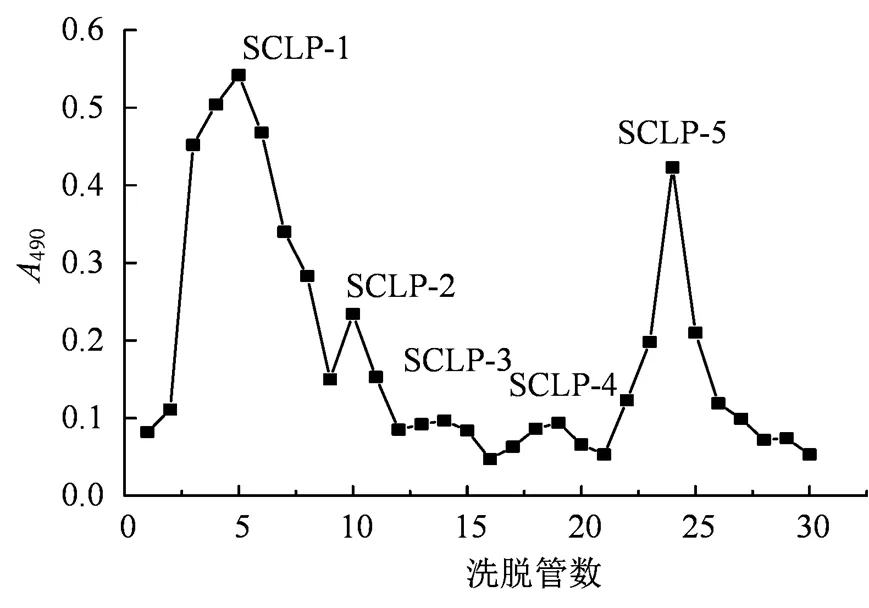
图3 甘蔗叶粗多糖溶液的DEAE-52洗脱曲线
Figure 3 DEAE-52 elution curve of crude polysaccharides from sugarcane leaves
2.2 DEAE-52洗脱效果
将经脱蛋白、脱色和除小分子杂质后的甘蔗叶多糖溶液用DEAE-52离子柱进行进一步的分离纯化,以蒸馏水为洗脱剂的甘蔗叶粗多糖洗脱曲线如图1所示。图1(a)为洗脱速率为1 mL·min-1时的洗脱曲线,图1(b)则为洗脱速度2 mL·min-1的洗脱曲线。从图1中可以看出,1 mL·min-1的洗脱速度,出现洗脱峰值,洗脱效果良好,而流速2 mL·min-1洗脱曲线吸光值低,且出现多个小峰值。故选用1 mL·min-1的洗脱速度。
图2(a)和2(b)为甘蔗叶粗多糖液经蒸馏水以1 mL·min-1的洗脱速度洗脱后,先后通过0.1 和0.2 mol·L-1的NaCl洗脱液进行洗脱得到的洗脱曲线。由图2可知,0.1 mol·L-1NaCl洗脱的洗脱曲线有均一的洗脱峰,而0.2 mol·L-1NaCl溶液吸光值低,且出现多个吸收峰,故采用0.1 mol·L-1NaCl溶液洗脱。

图4 甘蔗叶纯多糖SCLP-1的DEAE-琼脂糖凝胶FF柱洗脱曲线
Figure 4 DEAE-Sepharose fast flow chromatography elution curve of sugarcane leaves polysaccharides SCLP-1

图5 甘蔗叶纯多糖SCLP-5的DEAE-琼脂糖凝胶FF柱洗脱曲线
Figure 5 DEAE-Sepharose fast flow chromatography elution curve of sugarcane leaves polysaccharides SCLP-5
综上,采用1 mL·min-1的洗脱速度,分别用蒸馏水、0.1 mol·L-1NaCl溶液对甘蔗叶粗多糖液进行洗脱,得到如图3所示的洗脱曲线。由图3可知,甘蔗叶粗多糖经洗脱后出现5个峰,分别命名为SCLP-1、SCLP-2、SCLP-3、SCLP-4和SCLP-5。因SCLP-2、SCLP-3和SCLP-4含量较少,因此只收集SCLP-1和SCLP-5两个组分。
2.3 DEAE-琼脂糖凝胶FF离子柱洗脱效果
甘蔗叶多糖SCLP-1和SCLP-5经DEAE-琼脂糖凝胶FF柱进一步纯化、洗脱,结果(图4和图5)显示,两个洗脱峰均为一个单一对称峰,说明纯化后的甘蔗叶多糖是较纯的多糖。对这两组分分别进行富集、浓缩和干燥,得到甘蔗叶的两种纯化多糖SCLP-1和SCLP-5。

图6 甘蔗叶纯多糖SCLP-1和SCLP-5的红外光谱图
Figure 6 Infrared spectra of sugarcane leaves polysaccharides SCLP-1 and SCLP-5
2.4 多糖的红外光谱分析
图6为两种纯化多糖SCLP-1和SCLP-5的红外光谱图。从图6中可看出,两种纯化多糖的红外光谱图相似,均出现多糖的特征吸收峰,其中3 440 cm-1处出现的吸收峰为多糖O-H基的伸缩振动吸收峰;
2 935 cm-1处出现的吸收峰是C-H 伸缩振动吸收峰[21]。进一步分析发现,SCLP-5在1 730 cm-1处出现明显的吸收峰,说明其具有糖醛酸组分;
1 637 cm-1出现的吸收峰为甘蔗叶多糖结构中C=O 的非对称伸缩振动峰;
在1 072 cm-1处有较强的吸收峰,说明SCLP-1和SCLP-5均含有吡喃糖环;
位于852 cm-1和938 cm-1附近的吸收峰说明了甘蔗叶多糖中含有β-糖苷键[22-23]。
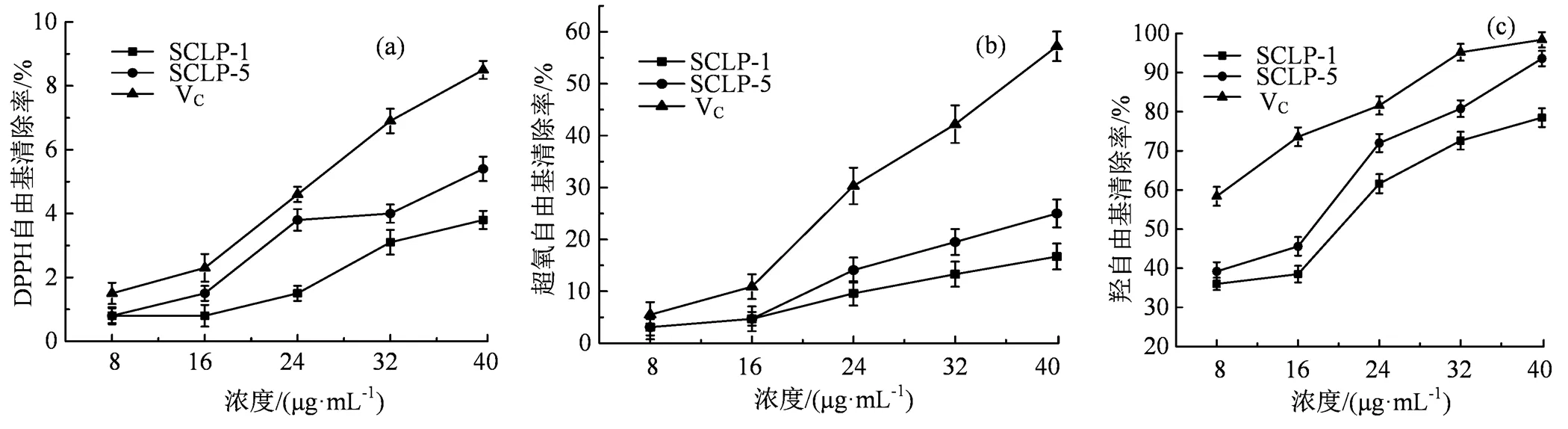
(a) DPPH· 清除能力;
(b)O2-·清除能力;
(c)·OH清除能力。
Figure 7 Antioxidant activities of sugarcane leaves polysaccharides SCLP-1 and SCLP-5

表4 甘蔗叶纯多糖SCLP-1的抑菌圈直径
注:-为无菌落生长。
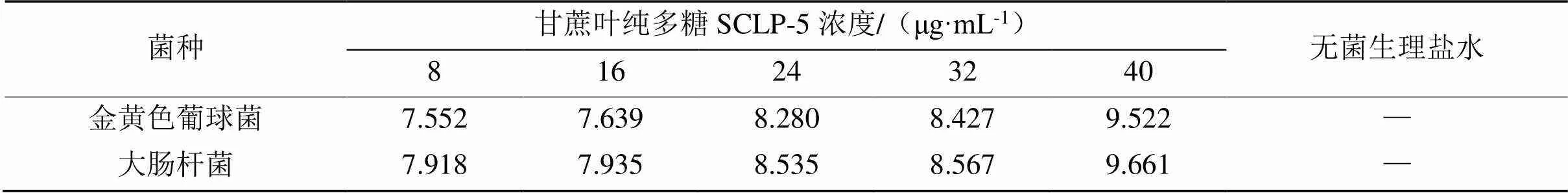
表5 甘蔗叶纯多糖SCLP-5的抑菌圈直径
注:-为无菌落生长。
2.5 抗氧化活性
两种甘蔗叶纯多糖SCLP-1和SCLP-5对 DPPH·、O2-·和·OH的清除能力如图7所示。由图7可知,在8~ 40 μg·mL-1的浓度范围,两种甘蔗叶纯多糖SCLP-1和SCLP-5的抗氧化能力均随着糖液质量浓度的增加而增大。两种甘蔗叶纯多糖SCLP-1和SCLP-5对·OH的清除能力最强,其次是O2-·,而对DPPH·的清除能力最弱,其中SCLP-5的抗氧化能力略高于SCLP-1,但均低于维生素C的抗氧化性。
2.6 抑菌活性
两种甘蔗叶纯多糖SCLP-1和SCLP-5对大肠杆菌和金黄色葡萄球菌两种供试指示菌的抑菌圈直径(表4和表5)显示,抑菌圈直径越大抑菌能力越强,SCLP-1和SCLP-5对2种供试指示菌的抑菌圈直径均 > 6.0 mm,其抑菌能力均随着糖液浓度的增加而增大,且两种纯化多糖对大肠杆菌的抑制效果优于金黄色葡萄球菌。试验结果表明,两种纯化多糖对金黄色葡萄球菌和大肠杆菌均具有一定抑制作用。
甘蔗叶药用历史悠久,可用于治疗汗证、盗汗及消渴症[24]。甘蔗叶多糖作为甘蔗叶中重要的活性成分,具有抗氧化、抑菌、抗炎和降血糖等作用[25]。本文将甘蔗叶粗多糖经除蛋白、除色素、除小分子杂质后,通过DEAE-52纤维素离子柱层析及DEAE-琼脂糖凝胶FF离子柱层析,得到SCLP-1和SCLP-5两种甘蔗叶纯多糖,并对其红外吸收特征、抗氧化性能和抑菌性能进行了分析。红外光谱分析结果显示,两种纯化多糖的结构相似,均含有吡喃糖环,其中SCLP-5含有糖醛酸组分,这可能是造成两者生物活性差异的原因。
近年来,关于植物多糖的抗氧化活性已被大量报道。杜锦畅等[26]研究发现,野巴子多糖对·OH和DPPH·具有一定的清除能力。陆娟等[27]等研究发现分离纯化的两种洋甘菊多糖(MCP-1-1 和 MCP-2-1)对 DPPH自由基和·OH均有清除作用。本文获得的SCLP-1和SCLP-5两种甘蔗叶纯多糖对羟自由基的清除能力最强,其次是超氧阴离子自由基,而对DPPH自由基的清除能力最弱,其中SCLP-5的抗氧化能力略高于SCLP-1,但均低于VC的抗氧化性。SCLP-5的抗氧化能力高于SCLP-1的原因可能与其组分中含有糖醛酸有关。有相关研究显示多糖的糖醛酸含量越高,分子量越小,抗氧化活性越高[27-28]。体外抑菌试验结果显示,随着多糖溶液浓度上升,SCLP-1和SCLP-5对大肠杆菌和金黄色葡萄球菌这2种菌株的抑菌效果越强,且对大肠杆菌的抑制效果优于金黄色葡萄球菌。该结果与刘东琦等[29]提取的玉米须多糖的抑菌结果相似。
本研究结果表明从甘蔗叶中分离纯化出的SCLP-1和SCLP-5多糖具有良好的抑菌和抗氧化活性,可以作为一种医药或功能性食品进行开发利用。
[1] SELMAN-HOUSEIN G, LÓPEZ M A, RAMOS O, et al. Towards the improvement of sugarcane bagasse as raw material for the production of paper pulp and animal feed[M]//Developments in Plant Genetics and Breeding. Amsterdam: Elsevier, 2000: 189-193.
[2] PESTANA P R, BRAGA A L F, RAMOS E M C, et al. Effects of air pollution caused by sugarcane burning in Western São Paulo on the cardiovascular system[J]. Rev Saude Publica, 2017, 51(0): 13.
[3] KHAIRE K C, MOHOLKAR V S, GOYAL A. Separation and characterization of cellulose from sugarcane tops and its saccharification by recombinant cellulolytic enzymes[J]. Prep Biochem Biotechnol, 2021, 51(8): 811-820.
[4] 李玉铭, 杜瑜欣, 周永升, 等. 甘蔗叶的研究进展[J]. 食品工业, 2018, 39(1): 237-239.
[5] GAO J F, ZHANG Y N, CUI J W, et al. A polysaccharide from the whole plant ofL. enhances the antitumor activity of dendritic cell-based immunotherapy against breast cancer[J]. Front Pharmacol, 2021, 12: 678865.
[6] YU Y, SHEN M Y, SONG Q Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: a review[J]. Carbohydr Polym, 2018, 183: 91-101.
[7] NUERXIATI R, ABUDUWAILI A, MUTAILIFU P, et al. Optimization of ultrasonic-assisted extraction, characterization and biological activities of polysaccharides fromD. Don (Salep)[J]. Int J Biol Macromol, 2019, 141: 431-443.
[8] QIU S L, CHEN J, CHEN X, et al. Optimization of selenylation conditions forpolysaccharide based on antioxidant activity[J]. Carbohydr Polym, 2014, 103: 148-153.
[9] 娄红波, 王先宏, 何丽莲, 等. 甘蔗茎叶化学成分的研究[J]. 中成药, 2021, 43(8): 2086-2091.
[10] 朱鹤云, 关皎, 王佳林, 等. 紫外分光光度法测定黄芩多糖的含量[J]. 吉林医药学院学报, 2016, 37(5): 334-335.
[11] YIN C M, FAN X Z, FAN Z, et al. Optimization of enzymes-microwave-ultrasound assisted extraction ofpolysaccharides and determination of its antioxidant activity[J]. Int J Biol Macromol, 2018, 111: 446-454.
[12] 王文平, 郭祀远, 李琳, 等. 考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J]. 食品研究与开发, 2008, 29(1): 115-117.
[13] 范三红, 李兰, 张锦华, 等. 小米多糖分离纯化及抗氧化活性研究[J]. 中国粮油学报, 2021, 36(6): 22-29.
[14] 张华, 冉黄桥, 杨玲, 等. 大孔吸附树脂的不同预处理对贝母多糖纯化效果影响[J]. 食品科技, 2017, 42(7): 195-199.
[15] 马广强, 李国群, 吴静, 等. 白莲莲房多糖分离纯化、结构表征及抗氧化与免疫活性[J]. 食品与机械, 2021, 37(5): 156-162.
[16] 孙晓雪, 康杰, 王昶, 等. DEAE纤维素纯化玉米须总多糖的工艺优选[J]. 中国实验方剂学杂志, 2014, 20(15): 28-30.
[17] 赵鹤鹏. 玉米须多糖的制备及其生物活性研究[D]. 吉林: 吉林化工学院, 2017.
[18] 程丽敏, 董爽, 梁文明, 等. 金花葵茎可溶性糖的提取及抗氧化性研究[J]. 食品研究与开发, 2016, 37(22): 59-63.
[19] CHEN R Z, LI Y, DONG H, et al. Optimization of ultrasonic extraction process of polysaccharides fromAit and evaluation of its biological activities[J]. Ultrason Sonochem, 2012, 19(6): 1160-1168.
[20] 刘大伟. 黄芩多糖大孔树脂纯化工艺优化及其抑菌活性[J]. 食品工业科技, 2021, 42(15): 183-188.
[21] SUNTHORNVARABHAS J, LIENGPRAYOON S, SUWONSICHON T. Antimicrobial kinetic activities of lignin from sugarcane bagasse for textile product[J]. Ind Crops Prod, 2017, 109: 857-861.
[22] WU X M, TU P F. Isolation and characterization of α-(1→6)-glucans from[J]. J Asian Nat Prod Res, 2005, 7(6): 823-828.
[23] LIU B, SHANG Z Z, LI Q M, et al. Structural features and anti-gastric cancer activity of polysaccharides from stem, root, leaf and flower of cultivated[J]. Int J Biol Macromol, 2020, 143: 651-664.
[24] 张金玲, 邓家刚, 刘布鸣,等. 甘蔗叶中黄酮类化合物的分离鉴定及含量测定[J]. 食品研究与开发, 2019, 40(22): 164-170.
[25] 魏纪湖, 蓝崇, 田林. 甘蔗叶的药用价值评价与综合利用浅析[J]. 大众科技, 2016, 18(6): 84-86.
[26] 杜锦畅, 王坤, 张景, 等. 野巴子多糖的结构分析及清除自由基研究[J]. 中央民族大学学报(自然科学版), 2021, 30(3): 32-38.
[27] 陆娟, 谢东雪, 贺柳洋, 等. 洋甘菊多糖的分离纯化、性质结构及抗氧化活性分析[J]. 食品与发酵工业, 2021, 47(3): 72-78.
[28] 白冰瑶, 付超, 张春兰, 等. 不同提取方法对恰玛古多糖生物活性的比较[J]. 食品科技, 2022, 47(3): 214-223.
[29] 刘东琦, 韩雪, 石俊姣, 等. 玉米须多糖不同提取方法对体外活性的影响[J]. 农产品加工, 2021(7): 36-38.
Isolation, purification andactivity analysis of polysaccharides from sugarcane leaves
WEI Qiaoyan1, YAN Delin1, CHEN Yuanfei1, SU Xide2, ZHAO Haiyan1, QIN Yiming1
(1. College of Food & Biochemical Engineering, Guangxi Science & Technology Normal University, Laibin 546199;2. Guangxi Laibin Xianggui Sugar Industry Co., Ltd., Laibin 546199)
In this paper, the crude polysaccharides from sugarcane leaves were extracted by mechanical force assisted ultrasonic method. After deproteinization, decolorization and removal of small molecular impurities, the produced crude polysaccharide extracts were purified by DEAE-52 cellulose ion column and DEAE-Sepharose fast flow chromatography to obtain two fractions, SCLP-1 and SCLP-5. The infrared absorption characteristics, antibacterial and antioxidant properties of SCLP-1 and SCLP-5 were further studied, and the results showed that the extraction rate of crude polysaccharides from sugarcane leaves was 1.8%, the protein removal rate was 39.8%, and the decolorization rate was 67.9%; the polysaccharide retention rates of the two processes were 58.6% and 60.2%, respectively, while the polysaccharide retention rate of the process of removing small molecular impurities was 96.8%. Infrared (IR) spectroscopy analysis showed that both SCLP-1 and SCLP-5 exhibited typical absorption peaks of polysaccharides; the results ofantioxidant test showed that the antioxidant activity of SCLP-5 was slightly higher than that of SCLP-1, but lower than VC; the results of bacteriostasis test showed that both SCLP-1 and SCLP-5 have antibacterial activity againstand, especially for.
sugarcane leaves; polysaccharides; separation and purification; antioxidation; antibacterial activity; infrared (IR) spectroscopy
R284.2
A
1672-352X (2022)06-1022-07
10.13610/j.cnki.1672-352x.20230106.023
2023-01-09 09:45:48
[URL] https://kns.cnki.net/kcms/detail//34.1162.S.20230106.1441.033.html
2022-03-04
2020年度广西科技师范学院大学生科研基金项目(GXKS2020DXSB10),广西糖资源工程技术研究中心(桂科AD16450040),广西高校制糖工程综合技术重点实验室培育建设(桂教科研[2016]6号)和广西科技师范学院糖蔗资源绿色高效技术开发与应用青年科研创新团队项目(GXKS2020QNTD01)共同资助。
韦巧艳,副教授。E-mail:84439627@qq.com 严德林,本科生。E-mail:794165898@qq.com
猜你喜欢 琼脂糖蒸馏水甘蔗 热压式蒸馏水机和多效蒸馏水机制备注射用水的质量比较医疗卫生装备(2022年2期)2022-03-16基于胶原-琼脂糖的组织工程表皮替代物构建研究太原理工大学学报(2021年6期)2021-11-25絮凝剂-树脂联合法从琼胶中制备琼脂糖工艺研究海洋科学(2020年9期)2020-10-09甘蔗的问题小猕猴学习画刊(2019年8期)2019-09-16水乳化法制备罗丹明B接枝琼脂糖荧光微球❋中国海洋大学学报(自然科学版)(2019年7期)2019-05-21水乳化法制备罗丹明B接枝琼脂糖荧光微球❋中国海洋大学学报(自然科学版)(2019年7期)2019-01-04爱咬甘蔗的百岁爷爷特别健康(2018年3期)2018-07-04影响DSQ型水管倾斜仪资料的蒸馏水问题研究科技创新与应用(2017年19期)2017-07-0823个甘蔗品种对甘蔗黑穗病的抗性测定中国糖料(2016年1期)2016-12-01黑熊吃甘蔗作文大王·低年级(2016年9期)2016-09-21推荐访问:纯化 多糖 甘蔗