血管性血友病因子抗原与白蛋白比值和糖萼素指数评分对乙型肝炎肝硬化食管静脉曲张的预测价值
来源:优秀文章 发布时间:2023-01-23 点击:
韩才均,黄 媛,粘 彬,朴美花
延边大学附属医院a,检验科;
b,消化内科;
c,超声科,吉林 延吉 133000
食管静脉曲张(EV)是门静脉高压的主要临床症状,EV破裂出血是肝硬化患者的常见致死因素[1]。早期评估EV风险对肝硬化患者临床结局具有重要意义。
肝窦内皮细胞参与调节肝内微循环稳态[2],其功能障碍引起肝血管结构异常和血管张力增加,是门静脉高压病理生理学的重要因素[3]。研究报道血管性血友病因子(von Willebrand factor,vWF)是内皮细胞活化标志物[4],其升高程度与肝纤维化程度相关[5]。而白蛋白(Alb)具有多种生物学效应,可通过免疫调节和抗氧化功能稳定内皮细胞[6]。因此,由vWF与Alb构建的数字模型可能是门静脉高压的间接指标。此外,肝硬化患者血小板(PLT)减少被认为与门静脉高压相关[7],糖萼素指数(glycocalicin index,GCI)反映PLT周转及更新状况[8],研究[9]报道肝硬化患者的GCI水平显著升高,且与肝病严重程度相关。课题组假设VAR和GCI与EV之间可能存在联系。国外研究[10]报道VITRO(vWF与PLT比值)评分与肝静脉压力梯度相关,是诊断门静脉高压的潜在标志物。因此,本研究目的评估VAR和GCI对乙型肝炎肝硬化EV存在及程度的诊断效能;
与VITRO评分比较,评估VAR联合GCI是否会提高EV诊断准确性。
1.1 研究对象 回顾性分析2020年4月—2021年12月本院收治的乙型肝炎肝硬化住院患者的临床资料。纳入标准:入院接受内窥镜检查,既往未接受内镜下套扎、经颈静脉肝内门体分流术等静脉曲张治疗术的患者。排除标准:(1)其他病毒性肝炎、酒精性肝炎、脂肪肝和自身免疫性疾病;
(2)非肝硬化性门静脉高压、肝内外恶性肿瘤;
(3)心血管及周围血管病,非肝硬化性PLT减少疾病,接受抗凝和抗PLT治疗的患者;
(4)有任何感染源或正在接受抗感染治疗的患者。
1.2 研究分组 参照食管静脉曲张诊断和分级标准[1],将患者分为EV组和无EV组,并根据食管静脉曲张形态及出血危险程度将EV患者分为轻度、中度、重度三级。轻度(G1):食管静脉曲张呈直线形或略有迂曲,无红色征;
中度(G2):曲张静脉呈直线形或略有迂曲,有红色征或呈蛇形迂曲隆起但无红色征;
重度(G3):曲张静脉呈蛇形迂曲隆起,且有红色征或呈串珠状、结节状或瘤样(不论是否有红色征)。根据Child-Pugh评分将肝硬化患者分为A、B、C级。
1.3 资料收集 患者的性别、年龄、入院时间和HBV DNA载量,以及血常规、肝肾功能、超声检查结果,均从病历中获得。使用全自动STA分析仪(法国,Stago公司)测量血浆vWF抗原(vWF-Ag)水平,采用ELISA试剂盒(美国,NOVUS公司)检测血清糖萼素(GC)水平。VAR=[vWF-Ag(%)]/Alb(g/L);
VITRO=[vWF-Ag(%)]/PLT(109/L)[10];
GCI=[GC(ng/mL)×250]/PLT(109/L)[8]。式中Alb为血清Alb。
1.4 统计学方法 采用SPSS 17.0和GraphPad prism 7.0软件进行数据分析。符合正态分布的计量资料用±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。非正态分布的计量资料采用M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验。趋势检验采用线性回归分析。采用Logistic回归模型分析EV的危险因素。计算受试者工作特征曲线(ROC曲线)下面积(AUC),评估研究参数对判断EV存在及程度的准确性。使用MedCalc软件比较各指标ROC曲线的诊断性能。P<0.05为差异有统计学意义。
2.1 一般情况 研究共纳入HBV相关肝硬化患者146例,男96例,女50例,平均57岁。Child-Pugh肝功能分级中A级59例,B级62例,C级25例。根据胃镜检查结果,将患者分为EV组和无EV组。相较于无EV组,EV组患者的脾脏厚度、MELD评分、Child-Pugh评分、vWFAg、INR、VAR、VITRO和GCI水平明显升高,PLT和Alb则显著降低,差异均存在统计学意义(P值均<0.05)(表1)。
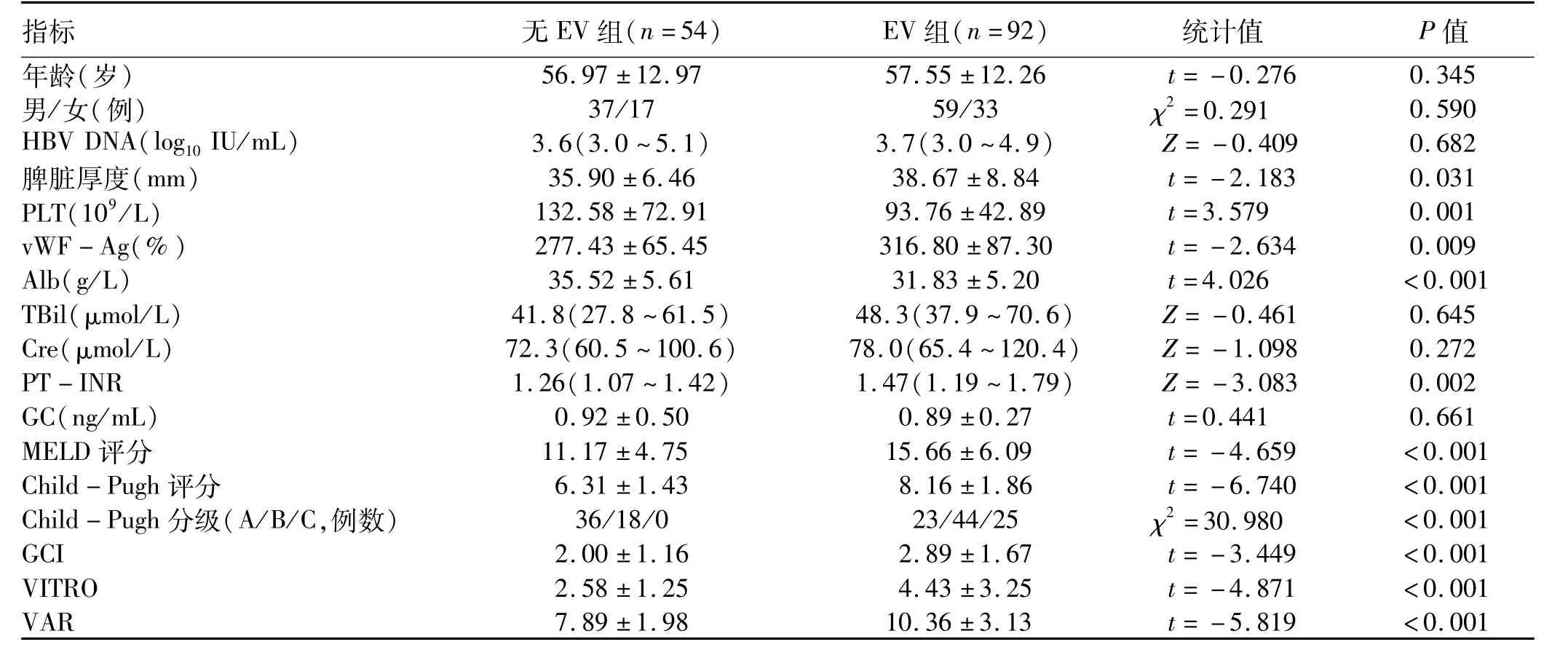
表1 EV组和无EV组患者基本特征Table 1 Comparisons of characteristics between EV and non-EV in patients with cirrhosis
2.2 VAR与EV的相关性 与无EV患者(7.89±1.98)相比,EV患者(10.36±3.13)的VAR水平显著升高(P<0.001)(图1a)。根据EV严重程度分级G1级30例,G2级33例,G3级29例,线性回归显示EV患者的VAR随EV严重程度而升高(P=0.002),方差分析Bonferroni法显示G3患者的VAR水平显著高于G1患者(P=0.007)(图1b)。
在Child-Pugh阶段内,有和没有EV的肝硬化患者之间,VAR存在显著差异(P<0.001)。在Child-Pugh A级中,无EV患者的平均VAR为(7.89±1.98),而EV患者为(10.13±2.94)(P=0.001);
在Child-Pugh B级中,无EV患者的平均VAR为(8.56±2.19),而EV患者为(10.08±3.29)(P=0.039);
在Child-Pugh C级中,所有患者都发生EV(图1c)。
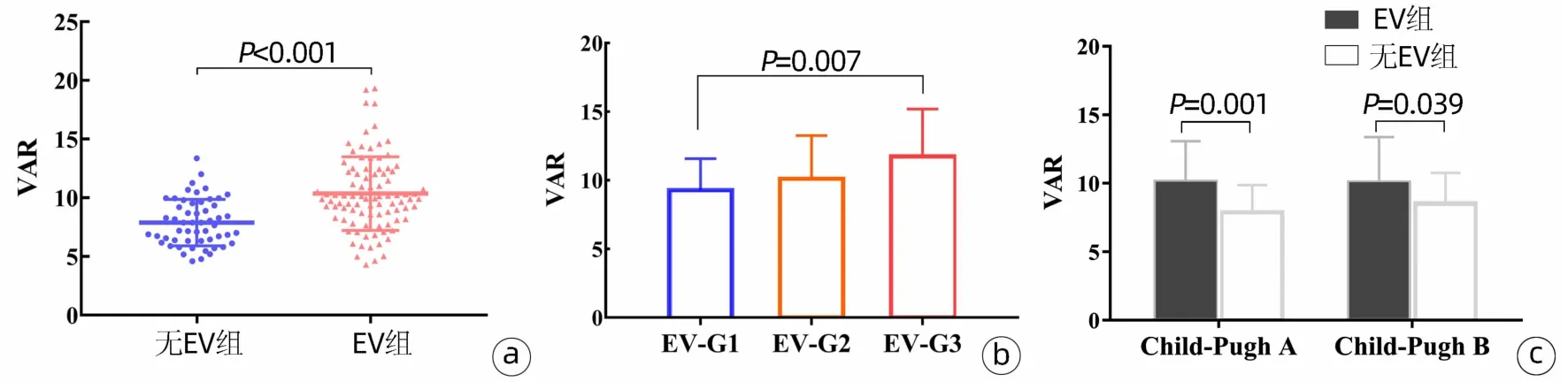
图1 VAR与食管静脉曲张的相关性Figure 1 The association of VAR score with esophageal varices
2.3 GCI与EV的相关性 与无EV患者(2.00±1.16)相比,EV患者(2.89±1.67)的GCI水平显著升高(P<0.001)(图2a)。线性回归显示EV患者的GCI随EV严重程度而升高(P=0.005),方差分析Bonferroni法显示G3患者的GCI水平显著高于G1和G2患者(P值分别为0.011、0.015)(图2b)。在Child-Pugh A级中,无EV患者的平均GCI为(1.87±1.00),EV患者为(2.55±1.40)(P=0.054);
在Child-Pugh B级中,无EV患者的平均GCI为(2.26±1.43),EV患者为(2.92±1.87)(P=0.179),组间差异均无统计学意义(图2c)。
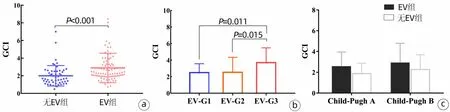
图2 GCI与食管静脉曲张的相关性Figure 2 The association of GCI score with esophageal varices
2.4 食管静脉曲张危险因素分析 采用二元Logistic回归分析确定EV危险因素。通过单因素分析,PLT、vWFAg、Alb、INR、MELD评分、VAR、GCI和VITRO均是EV的影响因素(P值均<0.05)。Pearson相关分析显示,GCI和VAR与VITRO评分之间存在较强的正相关性(r分别为0.758、0.489,P值均<0.001),不能同时放入Logistic回归模型中,通过剔除变量法,将共线性的自变量剔除。多因素分析采用向前逐步回归法对比值比(OR)值调整后,显示GCI和VAR为EV的独立危险因素(P值均<0.05)(表2)。

表2 EV危险因素的Logistic回归分析Table 2 Univariable and multivariable analysis of risk factors for esophageal varices
2.5 GCI、VAR和VITRO对EV诊断效能比较 ROC曲线分析GCI、VAR和VITRO对EV的诊断性能。GCI评分的AUC为0.710,敏感度为84.78%,特异度为53.70%;
VAR的AUC为0.745,敏感度为70.65%,特异度为70.37%;
VITRO的AUC为0.718,敏感度为65.22%,特异度为72.22%。GCI联合VAR对EV诊断性能明显优于VITRO评分(P=0.009),此时的敏感度为55.43%,特异度为94.44%(图3a,表3)。
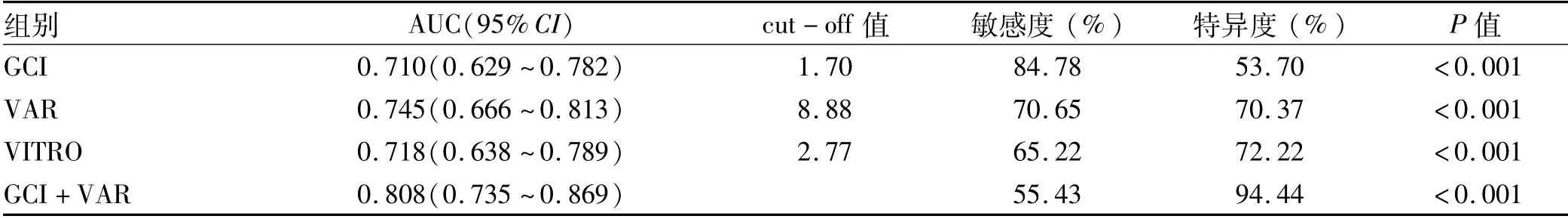
表3 研究参数对预测EV的诊断性能比较Table 3 Comparison of the diagnostic performance of study variables for esophageal varices
2.6 GCI、VAR和VITRO对重度EV诊断效能比较 ROC曲线分析GCI、VAR和VITRO对重度EV的诊断性能。GCI和VAR的AUC分别为0.787和0.755。VITRO的AUC为0.863,敏感度为65.52%,特异度为92.31%。GCI联合VAR诊断重度EV的AUC为0.869,与VITRO评分无差异(P=0.421),此时敏感度为89.66%,特异度为72.65%(图3b,表4)。

表4 研究参数对重度EV的诊断性能比较Table 4 Comparison of the diagnostic performance of study variables for severe esophageal varices
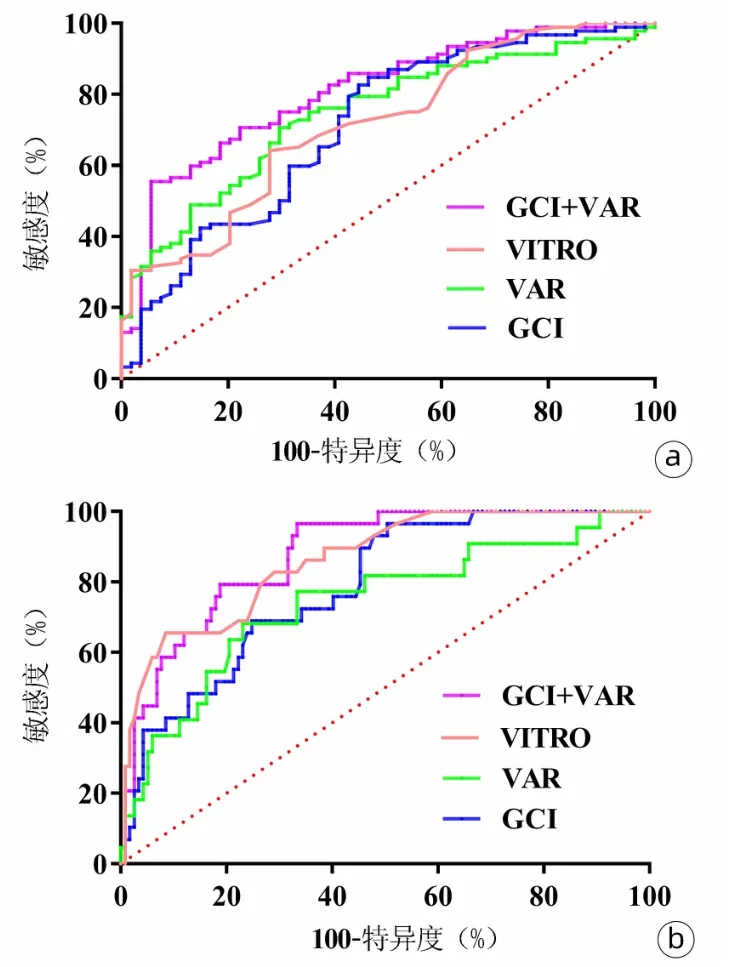
图3 GCI、VAR和VITRO诊断EV(图a)及重度EV(图b)的ROC曲线比较Figure 3 Comparison of the areas under the receiver operating curve for the GCI,VAR and VITRO score for diagnosing esophageal varices and severe esophageal varices
本研究以胃镜检查为金标准,发现VAR和GCI评分与肝硬化EV发生独立相关。VAR和GCI可能是Child-Pugh A级肝硬化患者EV风险分层的潜在标志物。
内皮损伤引起的肝内微循环障碍,是门静脉高压病理生理学的重要因素[2]。本研究中EV患者的vWF水平显著高于无EV患者,这可能与剪切应力诱导vWF合成释放增加[11]以及ADAMTS13清除减少有关[12],但多因素分析vWF与EV之间相关性不强,这可能反映内皮功能障碍并不是门静脉高压的唯一决定因素。Alb具有多种生物学效应,临床前模型发现Alb可以通过其对炎症、氧化和细胞应激的作用来稳定内皮功能[6]。另外,临床研究[13]证实Alb通过增加有效循环血容量,改善血流动力学紊乱和循环功能障碍,减少肝硬化患者并发症发生。本研究中EV患者的血清Alb显著低于无EV患者。因此,结合vWF和Alb的VAR评分可能与门静脉高压风险密切相关。线性回归显示VAR与EV分级之间存在显著相关性,而且在Child-Pugh A和B级患者中,EV患者的VAR评分显著高于无EV患者,提示VAR可能是Child-Pugh A和B级肝硬化患者EV风险分层的潜在标志物。
Alb减少是肝硬化患者的常见症状[7]。GC是Alb膜糖蛋白Ibα链的蛋白水解片段,经Alb计数校正后的GCI被认为是Alb周转标志物[8]。本研究中EV患者的GCI显著升高,提示Alb更新加快,这可能与肝硬化脾功能亢进和血小板生成素生成受损有关[9]。另外,ROC曲线显示GCI对重度EV的诊断敏感度高达96.55%,提示GCI有助于识别EV发展风险较高的患者。
国外研究[10]报道VITRO评分与肝静脉压力梯度相关,是诊断门静脉高压的无创标志物。本研究多变量分析显示VAR和GCI与EV发生独立相关,两者联合诊断EV的AUC为0.808,特异度高达94.44%,与VITRO评分相比(AUC=0.718),差异具有统计学意义(P=0.009),提示相较于VITRO评分,联合模型能提高EV的诊断效能。
综上,本研究以肝硬化门静脉高压相关的内皮功能障碍和Alb动力学变化为基础,证实VAR和GCI对乙型肝炎肝硬化患者EV的预判价值。二者联合可以提高EV的诊断准确性,有利于对肝硬化患者的风险分层和管理。此外,本研究还有一些局限。首先,纳入人群均为乙型肝炎肝硬化患者且数量有限,需要在更大样本人群里中验证这些结果。其次,仅对单个时间点VAR和GCI与EV
关系进行评价,而其在肝纤维化进程的变化可能对患者的危险分层可能更有意义。
伦理学声明:本研究方案于2020年12月5日经由延边大学附属医院伦理委员会审批,批号:(2020)伦审字(211)。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:韩才均负责课题设计,资料分析,撰写论文;
黄媛、粘彬参与收集数据,拟定写作思路及修改论文;
朴美花参与修改论文及最后定稿。