丙酮酸脱氢酶E1亚基α1在肾透明细胞癌中的表达及影响
来源:优秀文章 发布时间:2023-01-23 点击:
宋松泽,齐 琳,张德宇,石烟祝,张菲娅,沈雁婕,叶棋浓,蔺 静
1 锦州医科大学研究生培养基地(解放军总医院第四医学中心),北京 100048;
2 解放军总医院第四医学中心 检验科,北京 100048;
3 锦州医科大学,辽宁锦州 121001;
4 军事科学院军事医学研究院 生物工程研究所,北京 100850
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是人体肾癌中最常见的病理亚型,其发生率逐渐增高,寻找早期诊断和预测预后的重要生物标志物,对ccRCC的治疗和预后判断有重大意义。现已明确,ccRCC是一种代谢性疾病,通常伴随着葡萄糖代谢和三羧酸循环的重编程[1-2]。因此,探索糖代谢相关的重要基因和蛋白表达水平的变化,对于揭示ccRCC的发生发展具有重要意义。
连接糖酵解和三羧酸循环的丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDHC)位于真核细胞线粒体基质中,包括丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)、二氢硫辛酰胺乙酰转移酶(dihydrolipoamide acetyltransferase,DLAT)和脂肪酰胺脱氢酶(dihydrolipoamide dehydrogenase,DLD)[3]。PDHC活性缺失与部分代谢紊乱疾病相关,如肌无力、乳酸中毒及神经系统退行性疾病等[4-5]。丙酮酸脱氢酶E 1亚基α 1(pyruvate dehydrogenase E1 subunit alpha 1,PDHA1)作为PDHC催化反应的起始酶,是决定丙酮酸进入三羧酸循环或糖酵解代谢途径的关键调节因子之一。近年研究发现,PDHA1的表达水平降低可能与部分癌症的发生有关,如乳腺癌、胃癌、食管癌等[6-8]。然而,PDHA1是否能调节ccRCC生长和影响肿瘤预后尚不清楚。本研究通过生物信息学分析及体外细胞实验探索PDHA1在ccRCC中的表达及其生物学功能,为进一步研究PDHA1抑制ccRCC的分子机制奠定基础。
1 实验细胞系 人ccRCC 786-O细胞系(中国科学院上海细胞研究所)。
2 主要试剂 胎牛血清、RPMI 1640培养基(美国Gibco公司)和PBS缓冲液;
细胞培养板及一次性无菌10 mL移液管(无锡耐思生物科技有限公司);
pcDNA3.0-Flag-PDHA1表达载体由本室构建;
质粒提取试剂盒和CCK-8试剂盒(南京诺唯赞生物科技股份有限公司);
4%多聚甲醛(广州赛国生物科技有限公司);
抗Flag抗体(英国Abcam公司)。
3 数据资料采集 登录癌症基因组图谱网站(the cancer genome atlas,TCGA;
https://cancergenome.nih.gov),在数据库中下载ccRCC数据集的临床资料及RNASEqV2信息。
4 ccRCC的表达分析和生存分析 从UALCAN(http://ualcan.path.uab.edu)和GEPIA(http://gepia.cancer-pku.cn)调取TCGA数据库,分析PDHA1在ccRCC中的表达,并比较PDHA1高表达与低表达患者的无病生存期(disease free survival,DFS)和总生存期(overall survival,OS)差异。
5 基于PDHA1表达量的基因差异分析 采用R软件的“DESeq2”程序包辅助编程,对高、低表达PDHA1的ccRCC RNA-seq数据进行分析,查找差异基因,对差异基因行基因本体(gene ontology,GO)注释、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。
6 细胞转染与Western blot检测 ccRCC 786-O细胞以65% ~ 75%的密度均匀接种于2个6 cm皿中,同时加入4 mL含1%双抗及10%胎牛血清的RPMI 1640培养基。将5 µL Lipofectamine 2000与195 µL NaCl溶液混匀,静置5 min。随后将10 µg的Flag-PDHA1与NaCl混匀,使其总量为200 µL。再将上述两种混合液混匀共计400 µL,室温静置15 min,加入6 cm培养皿中。同样方法转染Flag空载体作为对照。6 h后换液,24 h后弃去细胞培养基,将细胞收集于EP管中,离心弃去上清,加入细胞体积3倍的RIPA,冰浴30 min,再加与RIPA等量的SDS,沸水浴10 ~ 15 min,离心后取上清进行聚丙烯酰胺凝胶电泳。以半干转的方式转膜,16 V,50 min。用含1 g脱脂奶粉的20 mL TBST封闭液封闭1 h,HRP-Flag抗体孵育1 ~ 2 h,TBST洗膜4次后,化学发光法显色,压片4 min,显影。
7 CCK-8法检测PDHA1对786-O细胞生长的影响 将Flag-PDHA1及Flag空载体分别转染于786-O细胞,常规培养24 h后,胰酶消化3 ~5 min,用细胞培养基重悬细胞,于96孔板每孔接种200 µL细胞悬液(细胞密度3 000/孔),过表达Flag-PDHA1组和Flag空载体均设3个复孔。待细胞贴壁后,吸去培养基,每孔加入100 µL稀释后CCK-8反应液(CCK-8与培养基按1∶10进行稀释)。37℃下继续培养1 h后测量第0、1、2、3、4天450 nm波长下光密度(optical density,OD)值。
8 克隆形成实验 将转染后的786-O细胞,以2 000个/孔的密度接种于6孔板中,过表达Flag-PDHA1组和Flag空载体组均设3个复孔。培养14 d后,弃去培养基,PBS清洗后,使用4%多聚甲醛固定,0.5%结晶紫染色,计数克隆数。
9 划痕实验 将786-O细胞按70%左右的密度均匀接种6孔板,分别转染Flag-PDHA1及Flag空载体,每组设3个复孔。待细胞密度接近100%时,用高压灭菌枪头,垂直于细胞平面并匀速划过细胞,PBS冲洗,镜下随机拍取3个位置,并做好标记。常规培养24 h后,在标记处拍照记录,计算细胞相对迁移距离。
10 统计学方法 通过SPSS25.0和GraphPad Prism 8软件对实验数据进行统计分析。采用Mann-WhitneyU方法分析临床资料组间PDHA1基因表达的差异,采用Kaplan-Meier绘制生存曲线。细胞实验中,两组间比较采用t检验,P<0.05为差异有统计学意义。
1 PDHA1在肾癌患者中表达情况分析 本研究从TCGA数据库中下载533例ccRCC组织以及72例癌旁正常组织的RNA-seq数据。分析发现,ccRCC组织中PDHA1 mRNA表达明显低于癌旁组织(P<0.01)。Ⅲ期ccRCC患者肿瘤组织中PDHA1 mRNA水平低于Ⅰ期患者(P<0.01)。肿瘤分级为Ⅱ级和Ⅲ级的患者,肿瘤组织中PDHA1 mRNA水平明显高于Ⅳ级患者(P<0.01)。淋巴结是否转移与PDHA1 mRNA水平无关(P>0.05;
图1)。

图1 ccRCC组织中PDHA1表达水平 A:癌旁组织和ccRCC组织中表达差异;
B:不同病理分期样本中表达差异;
C:不同分级样本中表达差异;
D:淋巴结未转移和转移的样本中表达差异Fig.1 PDHA1 expression levels in ccRCC A: Expression difference between adjacent tissues and ccRCC tissues; B: Expression levels in tissues of different cancer stages; C: Expression levels in tissues of different tumor grades; D: Expression levels in tissues with or without lymph node metastasis
以PDHA1表达水平的中位数为切点,将ccRCC患者分为PDHA1高表达组(258例)及PDHA1低表达组(258例)。生存曲线结果表明,高表达组患者无病生存期和总生存期更长(P<0.01;
图2)。

图2 ccRCC组织中PDHA1表达水平与临床预后的关系A:无病生存期;
B:总生存期Fig.2 Relationship between PDHA1 expression level and clinical prognosis in ccRCC A: DFS; B: OS
2 PDHA1高表达和低表达组间差异基因分析以中位数为分界点,将ccRCC患者分为高表达组和低表达组,进行组间差异基因分析,筛选出705个差异基因,较PDHA1低表达组,PDHA1高表达组上调577个基因,下调128个基因(图3)。为了解两组差异基因的功能,对705个差异基因进行GO及KEGG分析。将GO注释和KEGG通路分析的前15个结果绘制图形,GO及KEGG分析结果均显示,PDHA1调控ccRCC可能与凝血通路有关(图4)。

图3 PDHA1高表达与PDHA1低表达组间差异表达基因Fig.3 Differential expression genes between groups with high expression of PDHA1 and low expression of PDHA1
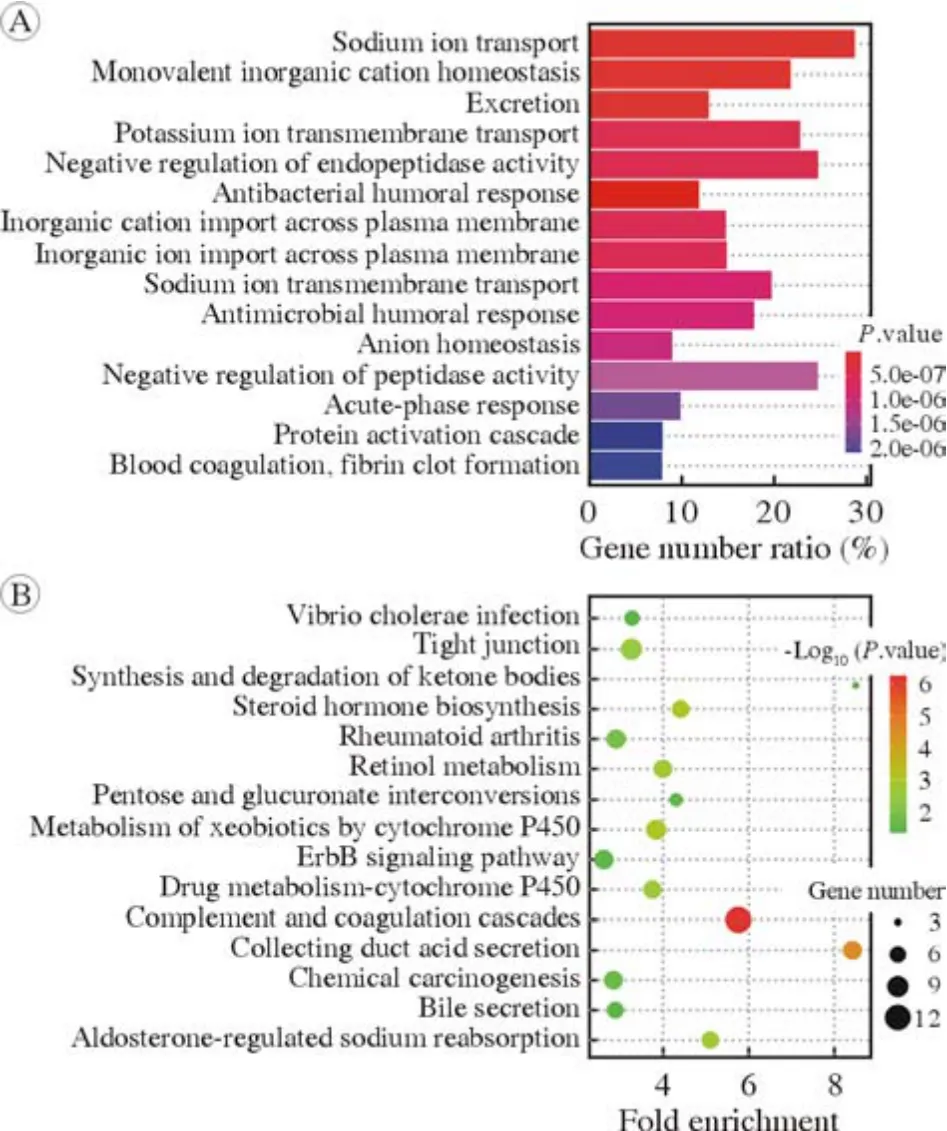
图4 PDHA1高表达与PDHA1低表达组间差异基因的GO注释(A)和KEGG通路(B)分析Fig.4 GO (A) and KEGG (B) pathway anotation between groups with high expression of PDHA1 and low expression of PDHA1
3 CCK-8实验 Western blot实验显示,Flag-PDHA1转染的786-O细胞成功表达PDHA1蛋白(图5A)。另外,通过CCK-8方法观察786-O细胞在第0、1、2、3、4天的生长情况,相比于空载体组,转染Flag-PDHA1后,786-O细胞在第4天生长明显受到抑制(P<0.01;
图5B)。

图5 PDHA1抑制786-O细胞增殖 A:Western blot;
B:细胞生长曲线 (P<0.01, vs Flag-PDHA1)Fig.5 PDHA1 inhibited proliferation of 786-O cells A: Western blot; B: Cell growth curves (P<0.01, vs Flag-PDHA1)
4 克隆形成实验 为了从多方面验证PDHA1抑制786-O细胞生长,在786-O细胞中分别转染Flag-PDHA1和Flag空载体,以2 000/孔的细胞密度铺于6孔板。结果表明,转染Flag-PDHA1组的786-O细胞克隆数量显著低于空载体组,再次说明PDHA1抑制786-O细胞增殖(P<0.01;
图6)。
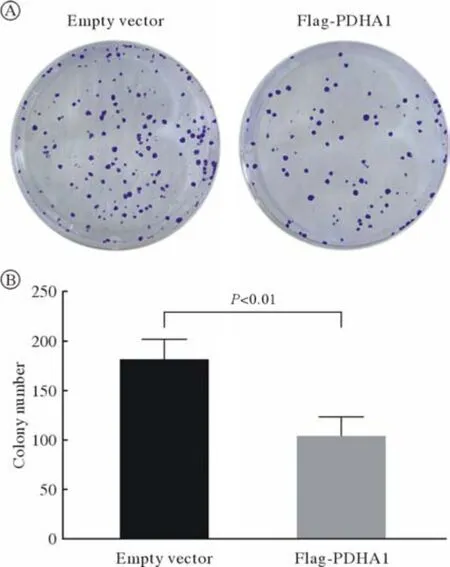
图6 PDHA1抑制786-O细胞增殖A:克隆形成实验;
B:克隆数量Fig.6 PDHA1 inhibited the proliferation of 786-O cellsA: Colony formation assay; B: Colony number
5 细胞划痕实验 将Flag-PDHA1和Flag空载体分别转染786-O细胞后,划痕实验显示,与空载体组相比,Flag-PDHA1可明显抑制786-O细胞的迁移能力(P<0.01;
图7)。

图7 PDHA1抑制786-O细胞迁移A:划痕实验;
B:相对细胞迁移Fig.7 PDHA1 inhibited the migration of 786-O cellsA: Wound healing assay; B: Relative cell migration
糖代谢是生物体三大能量代谢之一,PDHA1作为连接糖酵解和三羧酸循环的平衡枢纽而被广泛关注。由于ccRCC通常伴随着葡萄糖代谢和三羧酸循环的重编程[1-2],因此我们对PDHA1在ccRCC中的表达及影响进行了探讨。
我们通过检索TCGA数据库发现,PDHA1在ccRCC组织中表达明显低于癌旁组织,PDHA1的表达与ccRCC分期和分级相关,并且与肾癌患者无病生存期和总生存期呈正相关。另外,体外细胞实验显示,786-O细胞高表达PDHA1后,细胞增殖、克隆形成和迁移能力均明显减弱。因此,PDHA1的表达水平降低可能与ccRCC的发生发展有关。与之相似,PDHA1的表达水平降低与乳腺癌、胃癌、食管癌等肿瘤的发生发展和预后也密切相关[6-10]。乳腺癌中,乙型肝炎X相互作用蛋白(hepatitis B X-interacting protein,HBXIP)通过稳定缺氧诱导因子1α(hypoxia inducible factor-1,HIF-1α)提高miR-96的表达,miR-96在转录水平抑制PDHA1的表达,增强葡萄糖代谢重编程,从而促进乳腺癌细胞的生长[11]。PDHA1 mRNA高表达乳腺癌患者总生存期明显高于低表达者[6]。胃癌中,细胞实验显示PDHA1低表达能促进糖酵解,并导致胃癌细胞增殖、克隆形成和侵袭[7]。胃癌组织中PDHA1表达也显著下调,与预后不良相关[9]。食管癌的研究显示,食管癌细胞中PDHA1基因被敲除后,导致细胞产生代谢重编程,出现Warburg效应以及细胞恶性程度增加[8]。PDHA1蛋白低表达与食管癌预后不良有关[10]。另外,在肾癌组织中,己糖激酶Ⅱ(hexokinase Ⅱ,HKⅡ)可增加PDHA1上Ser293位点磷酸化,PDHC活性降低,从而改变代谢途径,促进了Warburg效应[12]。
以上研究提示,PDHA1通过调控糖代谢抑制肿瘤细胞生长。除了调控糖代谢,PDHA1发挥作用也与其他机制有关。Chen等[13]报道头颈鳞状细胞癌中,PDHA1敲低表达后通过激活丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路促进细胞生长。另外,敲低PDHA1基因,可诱导肺癌细胞发生上皮间质转化 (epithelial-mesenchymal transition,EMT),进而导致肺癌细胞对顺铂产生耐药[14]。Sun等[15]发现高表达PDHA1可激活促凋亡BCL2关联X蛋白(bcl-2 associated X protein,Bax)信号通路,调节下游蛋白半胱天冬酶3/9,进而诱导肝癌细胞凋亡。
为了进一步探讨PDHA1低表达促进ccRCC细胞生长的机制,我们对PDHA1高表达后的705个差异基因进行了GO注释和KEGG富集分析,两者均显示PDHA1与凝血通路有关。多个研究显示,止血因子和肿瘤的生物特征在多方面都存在相互联系,肿瘤细胞能激活凝血系统,凝血因子参与肿瘤进展,凝血级联反应还可能特异性调节抗肿瘤免疫,凝血通路中相关分子有望成为新的抗肿瘤药物靶标[16-18]。因此,PDHA1可能通过凝血通路相关分子影响肿瘤进展。GO 注释及KEGG富集分析为深入研究PDHA1在ccRCC发生发展中的机制提供了方向。
猜你喜欢 差异基因生存期克隆 克隆狼环球时报(2022-09-20)2022-09-20浙江:诞生首批体细胞克隆猪今日农业(2020年24期)2020-12-15基于RNA 测序研究人参二醇对大鼠心血管内皮细胞基因表达的影响 (正文见第26 页)心电与循环(2020年1期)2020-02-27紫檀芪处理对酿酒酵母基因组表达变化的影响江苏农业科学(2017年5期)2017-04-15感染性心内膜炎手术治疗的疗效观察中国现代医生(2016年31期)2017-03-02肝癌TACE术后生存期小于1年及大于3年的相关影响因素分析中国现代医生(2016年32期)2017-03-02属于“我们”小资CHIC!ELEGANCE(2015年14期)2015-09-23属于“我们”小资CHIC!ELEGANCE(2015年15期)2015-09-01SSH技术在丝状真菌功能基因筛选中的应用湖北农业科学(2014年3期)2014-07-21肾阳虚证骨关节炎温针疗效的差异基因表达谱研究云南中医学院学报(2011年4期)2011-07-31推荐访问:丙酮酸 细胞 表达