凝结芽孢杆菌BC2000联合鞣花酸改善高脂饮食诱导的小鼠胰岛素抵抗
来源:优秀文章 发布时间:2023-04-25 点击:
党红阳,李欣悦,齐 策,王 亮,孙 进,*
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;
2.青岛大学营养与健康研究院,山东 青岛 266000)
膳食性肥胖症是全球关注的健康问题。有研究表明,肥胖症患者常伴有胰岛素抵抗症,导致机体营养代谢失衡和脂类积聚,并由此增大了高血脂、高血糖等并发疾病及心血管疾病、非酒精性脂肪肝等慢性病患病风险[1]。
目前,缓解胰岛素抵抗的主要药物有曲格列酮、罗格列酮等二酮类化合物,其通过促进胰岛素分泌、增强胰岛素信号活性来提高胰岛素敏感性,改善胰岛素抵抗[2]。但是,长期服用上述药物会对肝脏产生一定程度的毒副作用,所以寻找天然有效的膳食补充剂缓解胰岛素抵抗十分关键[3]。益生菌可以改善宿主内源性肠道菌群的组成,促进生理稳态。但是,传统的益生菌(如乳杆菌和双歧杆菌)对温度非常敏感[4],而凝结芽孢杆菌(Bacillus coagulans)的芽孢体具有耐胃酸、耐胆盐、耐热、耐氧和产品货架期稳定性高等优点[5],在食品中具有更广的应用价值。
凝结芽孢杆菌能够进入人体结肠,具有改善宿主肠道菌群[6]、调节免疫、缓解炎症[7]和调节糖脂代谢[8-10]等生理功能。凝结芽孢杆菌BC2000和BC30被广泛添加于混合坚果和果干产品中,不仅可以改善混合坚果的风味,更能强化这些食物潜在的生理调节作用[11]。鞣花酸(ellagic acid,EA)是一种天然多酚类化合物,广泛存在于水果、坚果中,如石榴、蔓越莓、草莓和核桃等。EA具有调节糖脂代谢的作用[12-13]。但是,EA的生物有效性和生物利用度较低,90%~95%的EA在小肠中不能被消化和吸收,需要被特定的结肠细菌转换为尿石素A等产物后才可发挥作用[14]。肥胖个体肠道菌群结构改变,转化EA的效率降低。凝结芽孢杆菌可能具有转化多酚活性[15]和调节肠道菌群构成的作用[16],也可以预防肥胖等慢性疾病[17]。因此,添加凝结芽孢杆菌可能促进EA生理调节作用,本研究旨在探讨凝结芽孢杆菌BC2000和BC30对EA调节血脂及胰岛素抵抗作用的影响,为BC2000作为益生菌在富含EA食品配方中的应用提供进一步的理论依据。
1.1 动物、材料与试剂
50 只6 周龄雄性C57BL/6J小鼠(体质量(21.0±0.8)g),购于北京斯贝福实验动物技术有限公司,动物生产许可证号:SCXK(京)2019-0010,在青岛大学实验动物中心饲喂。
凝结芽孢杆菌BC2000从东北酸菜中分离得到,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号CGMCC No.21621。
凝结芽孢杆菌BC30(凝结芽孢杆菌GBI-30,6086),从美国Schiff公司生产的Digestive Adantage益生菌胶囊分离获得,并经生化和16S rRNA基因测序鉴定确认。
EA(纯度99.9%) 上海源叶生物科技有限公司;
甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒南京建成生物工程研究所;
胰岛素、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、脂多糖(lipopolysaccharide,LPS)、连蛋白(zonulin)和超敏C反应蛋白(highsensitivity C-reactive protein,hs-CRP)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒江苏晶美生物科技有限公司。
1.2 仪器与设备
卓越纤巧型血糖仪 德国罗氏诊断有限公司;
3k-15离心机 德国Sigma公司;
Multiscan Go多功能酶标仪 美国Thermo公司。
1.3 方法
1.3.1 动物实验设计
本研究的动物实验方案经青岛大学动物伦理委员会批准(审批号:QDU-AEC-2022259)。50 只雄性C57BL/6J小鼠在青岛大学实验动物中心喂养,饲养环境条件:12 h光照/12 h黑暗循环、温度(22±1)℃、相对湿度(50±5)%。小鼠适应性喂养1 周后随机分为5 组(n=10):低脂饮食(low fat diet,LFD)组、高脂饮食(high fat diet,HFD)、EA干预组(HFD+EA组)、凝结芽孢杆菌BC30联合EA干预组(HFD+EA+BC30组)、凝结芽孢杆菌BC2000联合EA干预组(HFD+EA+BC2000组)。由表1可知,小鼠饲料的脂肪来自于猪油和大豆油。凝结芽孢杆菌BC2000和凝结芽孢杆菌BC30以冻干粉形式添加,每克冻干粉含4×1011CFU益生菌,根据小鼠的采食量(2.3~3.3 g/d),每千克高脂饲料添加0.1 g冻干粉,每只小鼠每天摄入约0.92×108~1.32×108CFU凝结芽孢杆菌BC2000或BC30。每组3 笼,每笼3~4 只,2~3 d给水给料1 次,持续喂养10 周,所有小鼠都可以自由饮水和饮食。

表1 小鼠饲料配方Table 1 Formulation of experimental diets for mice
1.3.2 小鼠体质量、采食量的测定
每周进行小鼠体质量、采食量的测定。
1.3.3 小鼠血糖相关指标的测定
第9周,每组随机选取6 只小鼠,禁食12 h后进行口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)。先测定小鼠空腹血糖浓度,然后以400 mg/mL的葡萄糖溶液灌胃,灌胃量为0.1 mL/20 gmb,分别在0、15、30、60 min和90 min采用尾静脉取血的方式测定小鼠的血糖浓度[18],绘制曲线并计算曲线下面积(area under the curve,AUC),获得小鼠葡萄糖耐受量。
第10周,小鼠禁食12 h,将小鼠麻醉收集血样于抗凝管中,4 ℃、1 500×g离心10 min,得到小鼠血浆样本,测定血糖浓度。参照试剂盒说明书进行血浆胰岛素浓度测定,根据公式(1)计算胰岛素抵抗指数(insulin resistance index,IRI)。
1.3.4 小鼠血脂相关生化指标的测定
按照试剂盒说明书进行血浆TC、TG、LDL-C、HDL-C浓度的测定。
1.3.5 小鼠炎性细胞因子指标的测定
根据ELISA试剂盒说明书测定血浆中TNF-α、IL-6、LPS、Zonulin、hs-CRP的质量浓度和肝脏中TNF-α的质量浓度。
1.3.6 脂肪和肝脏的组织学分析
用组织固定液固定新鲜的肝脏进行石蜡包埋,再准备5 μm厚的组织切片进行苏木精-伊红(hematoxylineosin,H&E)以及油红O染色。用组织固定液固定新鲜的睾周脂肪组织,进行H&E染色。光学显微镜下进行病理组织学观察。
1.3.7 16 S rRNA盲肠内容物菌群结构分析
快速无菌取0.2 g小鼠盲肠内容物,置于干冰中保存,委托北京百迈克生物科技股份有限公司检测。按照16S rRNA V3~V4可变区设计聚合酶链式反应扩增引物序列(正向引物:5'-ACTCCTACGGGAGG CAGCA-3';
反向引物:5'-GGACTACHVGGGTWTCTAAT-3'),采用Illumina NovaSeq平台进行测序。用易扩增子(EasyAmplicon)对测序数据进行下游分析,用ImageGP和microbiomeanalyst在线工具对分析结果进行可视化作图。
1.4 数据统计分析
所有数据以平均值±标准差表示。使用SPSS 20.0软件进行单因素方差分析(ANOVA),利用Tukey多重比较检验进行统计学分析,以P<0.05表示差异显著,P<0.01表示差异极显著。使用GraphPad Prism 8.0软件作图。
2.1 凝结芽孢杆菌BC30和BC2000对高脂小鼠体质量、采食量的影响
如图1A所示,高脂饲料喂养5 周后,与LFD组相比,HFD组小鼠体质量显著增加(P<0.05)。实验结束时,高脂饮食诱导的小鼠体质量是低脂饮食的1.2 倍。喂养9 周后,与HFD组相比,HFD+EA组体质量显著降低(P<0.05)。实验过程中,HFD+EA+BC30和HFD+EA+BC2000喂养没有引起小鼠肥胖。喂食期间,与LFD组相比,高脂饮食可以显著降低小鼠的采食量(P<0.05)(图1B)。

图1 凝结芽孢杆菌BC30和BC2000对高脂小鼠体质量(A)、采食量(B)的影响(n=10)Fig.1 Effect of Bacillus coagulans BC30 and BC2000 on body mass (A)and food intake (B) in high-fat diet-fed mice (n = 10)
2.2 凝结芽孢杆菌BC30和BC2000对高脂小鼠血糖相关指标的影响
OGTT可以定量测定胰岛β细胞功能和胰岛素敏感性,反映机体对血糖的调节能力[19]。如图2A所示,灌胃葡萄糖后,LFD组小鼠血糖浓度在30 min后升至最高,并在90 min内恢复到正常水平。HFD组小鼠的血糖浓度在30 min后达到最大值,90 min时未恢复到正常水平,表明HFD组小鼠胰岛素分泌紊乱,血糖调节能力失衡,葡萄糖耐量受损。与HFD组相比,灌胃30 min时,HFD+EA+BC2000组血糖浓度显著降低(P<0.05),90 min时,HFD+EA+BC30组血糖浓度显著降低(P<0.05)。
如图2B所示,与LFD组相比,HFD组AUC显著升高(P<0.05)。与HFD组相比,HFD+EA+BC2000组AUC显著降低(P<0.05),HFD+EA和HFD+EA+BC30组无显著性差异。图2C显示,与HFD组相比,添加EA能显著降低胰岛素水平(P<0.05)。与HFD+EA相比,添加凝结芽孢杆菌BC2000可以显著降低胰岛素水平(P<0.05),但添加凝结芽孢杆菌BC30没有显著降低胰岛素水平。如图2D所示,添加EA能显著降低高脂肪饮食导致的IRI升高(P<0.05)。与HFD+EA组相比,添加凝结芽孢杆菌BC2000可以显著降低IRI(P<0.05),添加凝结芽孢杆菌BC30无显著性变化。综上表明EA和BC2000协同作用能够降低葡萄糖的吸收速率,增强胰岛β细胞功能,降低胰岛素水平,缓解高脂小鼠葡萄糖耐量受损,进而缓解胰岛素抵抗,且作用效果优于EA和EA+BC30。

图2 凝结芽孢杆菌BC30和BC2000对高脂小鼠血糖相关指标的影响(n=6)Fig.2 Effect of Bacillus coagulans BC30 and BC2000 on blood glucose-related indicators in high-fat diet-fed mice (n = 6)
2.3 凝结芽孢杆菌BC30和BC2000对高脂小鼠血脂相关指标的影响
高脂饮食通常伴随着脂质代谢异常。高脂饲料喂养10 周后,与LFD组小鼠相比,HFD组小鼠血浆TG、TC、LDL-C浓度和LDL-C/HDL-C比值显著升高(P<0.05)(图3)。补充EA可显著减低高脂饮食小鼠血浆TG、TC浓度和LDL-C/HDL-C比值(P<0.05)。与HFD+EA组相比,补充凝结芽孢杆菌BC2000可显著降低血浆TC浓度(P<0.05)。HFD+EA+BC30组与HFD+EA+BC2000组各血脂相关指标无显著性差异。5 组小鼠HDL-C浓度无显著性差异。综上,补充凝结芽孢杆菌BC30、BC2000可以有效促进EA改善高脂饮食引起血脂水平紊乱的作用,作用效果优于单独使用EA,并且补充EA+BC2000更有利于预防高脂饮食导致的TC浓度升高。
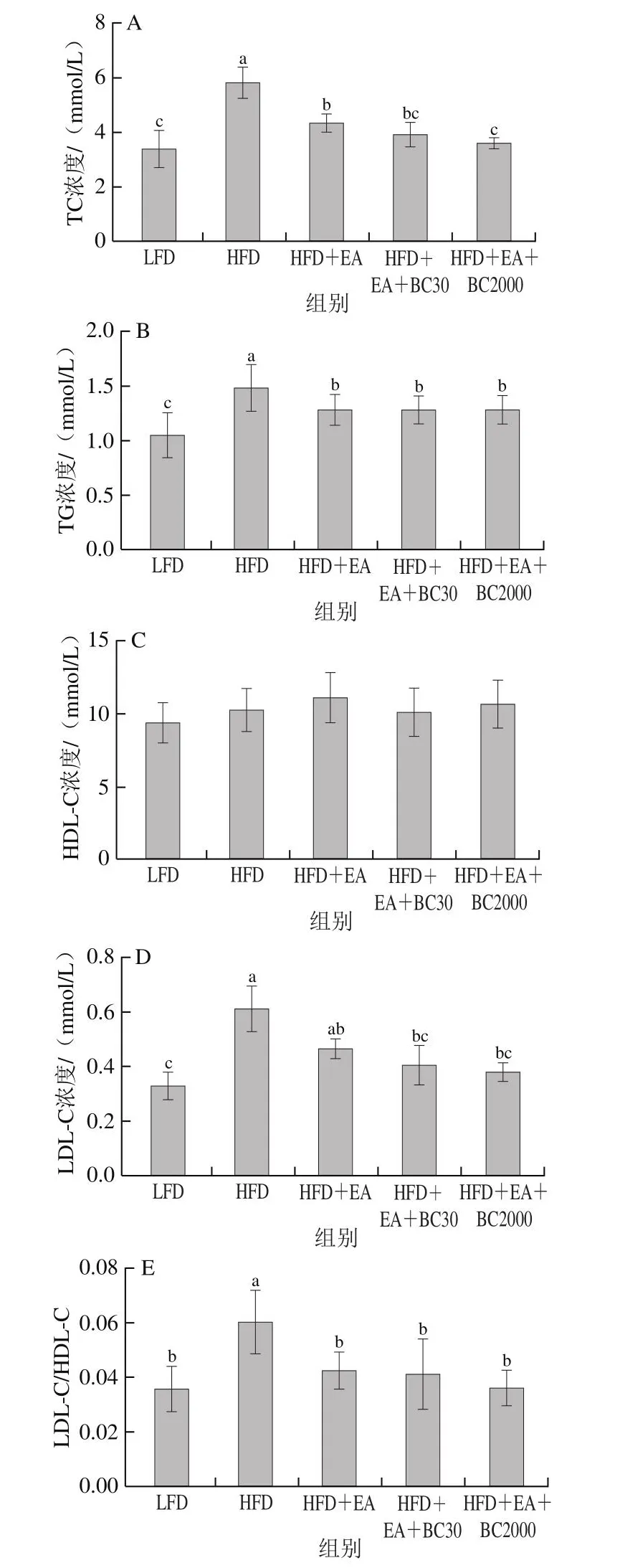
图3 凝结芽孢杆菌BC30和BC2000对高脂小鼠血脂相关指标的影响(n=10)Fig.3 Effect of Bacillus coagulans BC30 and BC2000 on blood lipid-related indexes in high-fat diet-fed mice (n = 10)
2.4 凝结芽孢杆菌BC30和BC2000对高脂小鼠炎性细胞因子的影响
由图4可知,与HFD组相比,补充EA可以显著降低高脂饮食引起的血浆LPS、hs-CRP、Zonulin和IL-6的水平及肝脏TNF-α水平的升高(P<0.05);
与HFD+EA组相比,补充凝结芽孢杆菌BC30可以显著降低血浆hs-CRP和Zonulin水平(P<0.05),补充凝结芽孢杆菌BC2000可以显著降低血浆LPS、hs-CRP和Zonulin水平(P<0.05)。与HFD+EA+BC30相比,BC2000可以显著降低血浆Zonulin水平。LPS和Zonulin是表征肠道黏膜通透性的重要标识物[20],血浆LPS、Zonulin水平升高表明肠道黏膜通透性升高,黏膜屏障受损,产生炎症细胞因子,如hs-CRP、TNF-α和IL-6进入血液循环,进而导致全身低水平炎症。这些结果表明,EA能够改善高脂饮食引起的全身低水平炎症。但EA和BC30、BC2000协同作用能够更好地改善黏膜通透性,维护肠道屏障结构与功能,从而减少炎症细胞因子的分泌。

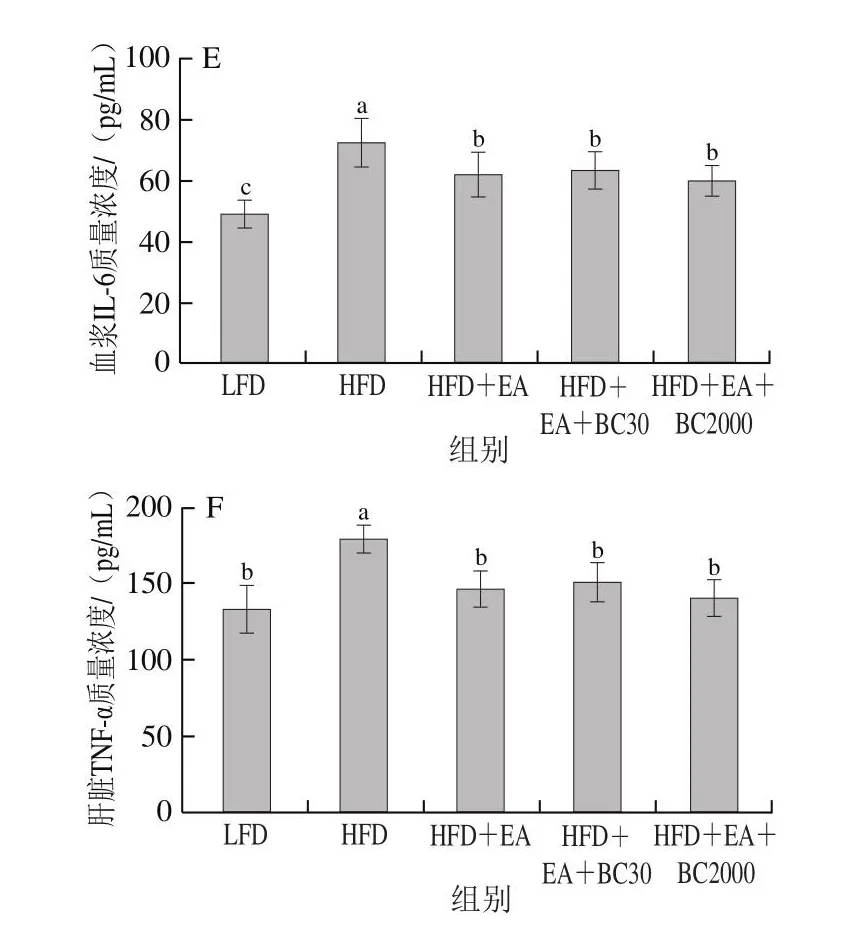
图4 凝结芽孢杆菌BC30和BC2000对高脂小鼠炎性细胞因子的影响(n=9)Fig.4 Effect of Bacillus coagulans BC30 and BC2000 on inflammatory cytokines in high-fat diet-fed mice (n = 9)
2.5 凝结芽孢杆菌BC30和BC2000对高脂小鼠肝脏和睾周脂肪形态的影响
由图5A可知,高脂肪饮食小鼠H&E染色肝脏切片可见炎性细胞浸润和脂质空泡化。肝脏油红O染色结果显示,HFD组小鼠肝脏脂肪着色明显,可见大量的脂肪滴,相同视野范围内HFD组肝脏中的脂滴面积百分比显著高于其他组(图5B、D)。与HFD组相比,补充EA、EA+BC30和EA+BC2000均可以显著降低肝脏脂质积聚(P<0.05),但HFD+EA、HFD+EA+BC30及HFDEA+BC2000组之间的肝脏脂滴面积百分比无显著性差异(图5D)。与LFD组相比,HFD组睾周脂肪细胞明显增大(图5C),补充EA、EA+BC30及EA+BC2000可以显著减小高脂小鼠的睾周脂肪细胞面积(P<0.05)(图5E),但HFD+EA、HFD+EA+BC30及HFDEA+BC2000组肝脏和睾周脂肪组织形态无显著性差异。这些结果表明,EA、EA+BC30及EA+BC2000均能够有效抑制高脂肪饮食导致的脂肪细胞肥大和肝脏脂肪变性。
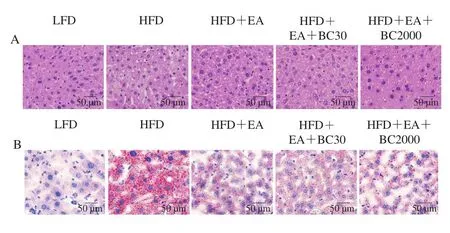
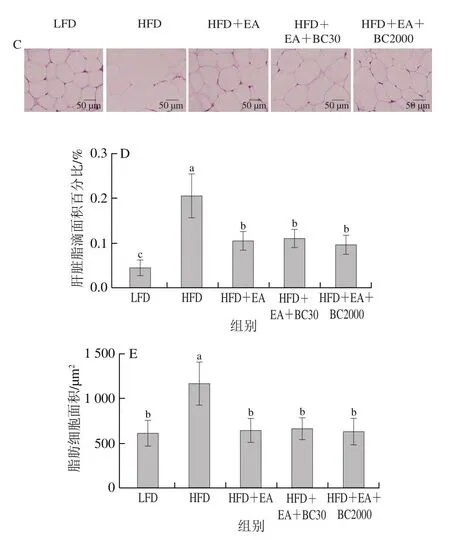
图5 凝结芽孢杆菌BC30和BC2000对高脂小鼠肝脏和睾周脂肪组织形态的影响(n=10)Fig.5 Effect of Bacillus coagulans BC30 and BC2000 on the morphology of liver and epididymal adipose tissues in high-fat-fed mice (n = 10)
2.6 凝结芽孢杆菌BC30和BC2000对高脂小鼠盲肠内容物菌群多样性的影响
通过Chao1指数、Shannon指数、Simpson指数评估高脂小鼠盲肠内容物菌群的Alpha多样性。如图6A~C所示,高脂喂养引起了盲肠内容物菌群Alpha多样性的变化,与HFD组相比,HFD+EA小鼠盲肠菌群的Shannon多样性指数和Simpson多样性指数极显著降低(P<0.01),补充凝结芽孢杆菌BC2000或BC30对盲肠内容物菌群Alpha多样性有提高作用,但无统计学差异。Beta多样性主要反映菌群构成的群体间差异。基于UniFrac加权矩阵主坐标分析(principal coordinates analysis,PCoA)显示,HFD组与其他组之间5 种肠道菌群组成差异显著(P<0.05)(图6D)。基于UniFrac未加权矩阵PCoA表明,与LFD组相比,高脂喂养显著改变了肠道菌群的组成(P<0.015),与HFD组相比,添加EA或EA+BC30可以显著改变肠道菌群的组成(P<0.012、P<0.003),但添加EA+BC2000无显著性改变(图6E)。与HFD+EA相比,添加BC2000可以显著改变肠道菌群的组成(P<0.003)。

图6 凝结芽孢杆菌BC30和BC2000对高脂小鼠盲肠内容物细菌多样性的影响(n=6)Fig.6 Effect of Bacillus coagulans BC30 and BC2000 on the bacterial diversity of cecum contents in high-fat diet-fed mice (n = 6)
2.7 凝结芽孢杆菌BC30和BC2000对高脂小鼠盲肠内容物菌群组成的影响
为探究EA和凝结芽孢杆菌BC2000在肠道菌群中的作用,对盲肠内容物的细菌的构成进行分析。如图7A所示,在门水平上,Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Desulfobacterota(脱硫杆菌门)、Actinobacteria(放线菌门)是肠道菌群主要优势菌群。与LFD组相比,HFD喂养降低了Bacteroidetes的相对丰度,提高了Desulfobacterota相对丰度。与HFD组相比,EA处理显著提高了Firmicutes的相对丰度(P<0.05),EA复合BC2000处理降低了Desulfobacterota相对丰度,提高了Actinobacteria的相对丰度,但无显著性差异。研究表明,Firmicutes与Bacteroidetes丰度比值(F/B)在肥胖小鼠肠道内明显升高[21],如图7D所示、LFD、HFD、HFD+EA、HFD+EA+BC30及HFD+EA+BC2000组小鼠F/B比值分别为9.7、19.2、17.1、11.5和10.4,HFD+EA+BC30和HFD+EA+BC2000可以降低高脂肪饮食导致的F/B比值的升高,且优于EA单独作用,但相互之间无显著性差异。
如图7B所示,在属水平上(相对丰度前10 位的菌属),与LFD组相比,HFD组肠道机会致病菌Desulfovibrio相对丰度高度极显著提高(P<0.001),补充EA+BC2000可以得到改善。与HFD组相比,HFD+EA干预明显提高了Faecalibaculum相对丰度。与HFD组相比,添加EA和EA+BC2000可以显著或极显著提高有益菌Lactobacillus的相对丰度(P<0.05、P<0.01)。这表明,HFD+EA、HFD+EA+BC30和HFD+EA+BC2000干预可以显著改善属水平上的肠道菌群的组成,促进有益菌Faecalibaculum和Lactobacillus生长,抑制机会致病菌Desulfovibrio的生长。
采用线性判别分析(linear discriminant analysis,LDA)和LDA差异贡献分析(LDA effect size,LEfSe)可以检验微生物物种丰度的组间差异(错误发现率(false discovery rate,FDR)<0.05、LDA≥2为组间菌属相对丰度具有显著性差异的筛选标准)。如图7C所示,在属水平上,差异显著的菌属共10 个,在LFD组中Akkermansia、Lachnospiraceae_FCS020_group、Sphingopysix、Lachnospiraceae_UCG_010是标志性菌属。HFD组的标志性菌属是Desulfovibrio和Enteractinococccus。HFD+EA+BC2000组的标志性菌属为Lactobacillus、Monoglobus、Bacillus和Psedograilibacillus。

图7 凝结芽孢杆菌BC30和BC2000对高脂小鼠盲肠内菌群构成的影响(n=6)Fig.7 Effect of Bacillus coagulans BC30 and BC2000 on the bacterial composition of cecum contents in high-fat diet-fed mice (n = 6)
2.8 小鼠肠道菌群与生化指标的相关性分析
将HFD+EA组与HFD+EA+BC2000组相对丰度具有差异显著的菌属(FDR<0.05)与生化指标的相关性分析结果如图8A所示。Bacillus(芽孢杆菌属)相对丰度与TC、LDL-C、IRI、Zonulin、hs-CRP、血浆TNF-α水平呈显著(P<0.05)或极显著(P<0.01)负相关,Enteractinococcus(肠球菌属)相对丰度与IRI、Zonulin、hs-CRP水平呈显著(P<0.05)或极显著(P<0.01)负相关,Pseudogracilibacillus(假纤细芽孢杆菌属)、Alistipes(另枝菌属)与IRI呈显著负相关(P<0.05),Clostridium_sensu_stricto_1(梭状芽孢杆菌属)、Turicibacter(苏黎世杆菌属)相对丰度与TC浓度呈显著正相关(P<0.05),Lachnospiraceae_FSC02_group(毛螺菌属)相对丰度与TC、LDL-C和Zonulin浓度呈显著正相关(P<0.05),UCG_009相对丰度与Zonulin浓度和IRI分别呈显著(P<0.05)和极显著(P<0.01)正相关。如图8B所示,血浆TC、LDL-C水平与炎性细胞因子hs-CRP、IL-6、LPS、肝脏TNF-α水平呈极显著或高度显著正相关(P<0.01、P<0.001);
IRI与IL-6水平呈高度显著正相关(P<0.001)。表明Bacillus、Enteractinococcus、UCG_009、Pseudogracilibacillus、Alistipes、Clostridium_sensu_stricto_1、Lachnospiraceae_FSC02_group、Turicibacter菌群与高脂小鼠的胰岛素抵抗、黏膜屏障能力显著相关。肠道菌群失调导致黏膜屏障受损,炎性细胞因子通过受损的屏障进入淋巴系统、血液、浸润脂肪和肝脏组织,导致肝脏脂肪累积,进一步导致小鼠血脂代谢失衡(TC、LDL-C水平升高),从而产生胰岛素抵抗。

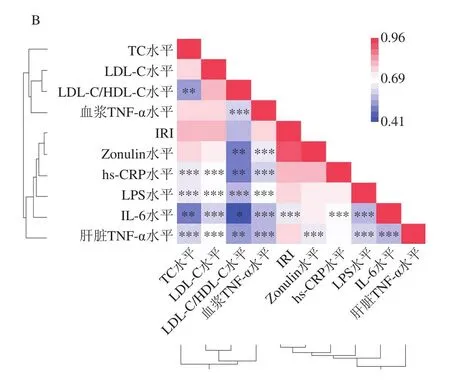
图8 小鼠肠道菌群与生化指标的相关性分析Fig.8 Correlation analysis between intestinal flora and biochemical indexes
糖脂代谢异常导致机体产生胰岛素抵抗,胰岛素抵抗与肥胖、非酒精性脂肪肝病等代谢类疾病密切相关[22]。大量研究表明,EA能够有效缓解高脂饮食引起的糖脂代谢紊乱[23],还可以增加肠道菌群多样性、刺激有益菌的生长并延缓致病菌株的生长、抑制炎症因子的表达[12-13],但是,在肥胖个体中EA的生物有效性和生物利用度较低,需要结肠细菌转化后吸收。凝结芽孢杆菌能够在结肠环境中存活[14]。因此,本研究利用益生菌缓解高脂引起的肠道菌群紊乱,探究了EA预防血脂代谢紊乱和胰岛素抵抗的作用。
本研究发现,EA和BC2000联合食用不会引起高脂饮食诱导小鼠的肥胖,可减少脂肪细胞肥大和肝脏脂肪变性,改善肠道菌群组成,显著降低高脂饲喂小鼠血浆的TC、LDL-C浓度及IRI,显著降低血浆黏膜屏障生物标志LPS和Zonulin质量浓度,以及慢性炎症标识TNF-α、hs-CRP和IL-6质量浓度,且作用效果优于单独使用EA。
肠道屏障能够维护肠道和机体健康,由黏液层、肠上皮细胞、肠道上皮细胞间紧密连接和黏附连接蛋白、免疫细胞和肠道菌群组成[24]。大量研究表明,高脂饮食会降低肠道上皮紧密连接蛋白的表达、削弱肠黏液层的完整性、增加致病菌的丰度及提高致炎细胞因子水平,进而破坏肠道屏障功能的完整性[25]。本研究发现,高脂饮食导致黏膜屏障生物标志LPS、Zonulin水平显著升高,黏膜屏障受损,可能有以下原因:1)LPS直接刺激Toll样受体4(Toll-like receptor 4,TLR4)-CD14促炎信号通路促进靶基因TNF-α、IL-6的表达;
2)LPS通过TLR4-CD14介导的核因子(nuclear factor,NF)-κB激活直接调节紧密连接蛋白的表达[26];
3)LPS诱导小肠上皮细胞功能障碍[27]。添加BC2000和EA显著抑制了炎性细胞因子IL-6和TNF-α的表达,与增强黏膜屏障有关。此外IL-6、TNF-α与胰岛素抵抗密切相关,可以通过降低胰岛素受体底物(insulin receptor substrate,IRS)的磷酸化或抑制IRS转录来诱导肝脏和脂肪细胞的胰岛素抵抗[28]。
肠道菌群与糖尿病、结肠炎及癌症等疾病密切相关[29]。高脂饮食会引起肠道菌群紊乱[30]。在本研究中,补充EA和凝结芽孢杆菌BC2000可以重塑HFD小鼠的肠道菌群,使其接近正常状态。在门水平上,补充EA和凝结芽孢杆菌BC2000提高了Actinobacteria(放线菌门)的相对丰度,降低了F/B比值,从而缓解F/B比值升高导致的能量吸收增加[31]。在属水平上,HFD+EA+BC2000干预可以极显著提高Lactobacillus(乳杆菌属)的相对丰度,降低Desulfovibrio(脱硫弧菌属)的相对丰度,HFD+EA+BC30干预可以降低Desulfovibrio(脱硫弧菌属)的相对丰度。这与LEfSe分析结果一致。LEfSe分析结果表明,凝结芽孢杆菌BC2000可以促进有益菌的生长,如Lactobacillus(乳杆菌属)、Bacillus(芽孢杆菌属)和Pseudogracilibacillus(假纤细芽孢杆菌),并抑制了有害菌Desulfovibrio(脱硫弧菌)的生长。Bacillus(芽孢杆菌属)、Pseudogracilibacillus(假纤细芽孢杆菌属)相对丰度与IRI呈显著负相关。芽孢杆菌具有调节微生态平衡,促进肠道健康等功能。乳杆菌具有预防慢性炎症和胰岛素抵抗恶化的潜能[32-33],可以通过调节肠道菌群来抑制高脂饮食引起的肠道黏膜通透性的增加,从而减少体内循环的LPS和炎症细胞因子(IL-6和TNF-α)水平,并最终缓解炎症和胰岛β细胞功能障碍[34-35]。
酚类化合物与益生菌之间存在互利的相互作用,益生菌和肠道菌群已经被证明能够改善酚类化合物的代谢和生物利用度,而酚类化合物可以通过提高益生菌的黏附性和存活率,抑制肠内致病菌和刺激肠内有益菌来调节肠道菌群[36]。研究表明,EA对肥胖者糖脂代谢的改善作用与其细菌代谢物尿石素类化合物有关[37]。EA在胃肠道中吸收较差,未被吸收的EA到达结肠,被肠道菌群代谢为尿石素[14],尿石素A和尿石素B,可以降低高脂小鼠血糖浓度并增加葡萄糖耐量和胰岛素敏感性,保护细胞免受炎症反应和氧化应激[38]。在本研究中,与仅补充EA喂食的高脂小鼠相比,添加凝结芽孢杆菌BC2000能够显著降低高脂饮食导致的IRI和TC浓度升高,而补充凝结芽孢杆菌BC30虽然也能降低高脂饮食导致的IRI和TC浓度升高,但没有显著性影响,这表明凝结芽孢杆菌BC2000和EA协同调节效果优于单独使用EA和联合使用EA+BC30,所以推测凝结芽孢杆菌BC2000和肠道菌群的相互作用更好地促进了EA在肠道中转化为细菌代谢产物尿石素,提高了EA的吸收效率和生物利用度,正反馈调节肠道菌群,提高凝结芽孢杆菌的存活率和黏附性,进而缓解机体炎症。但凝结芽孢杆菌BC2000对EA代谢途径的具体影响机制仍有待进一步研究。
综上所述,凝结芽孢杆菌BC2000和EA联合补充可以显著降低高脂饮食小鼠的脂肪积累和血脂水平,改善肝组织脂肪性损伤,缓解低水平全身慢性炎症,增强肠道黏膜屏障,调节肠道菌群紊乱,促进与胰岛素抵抗相关的有益菌生长,抑制有害菌的生长,从而有效缓解高脂饮食诱导所致胰岛素抵抗,且效果优于单独补充EA,本实验可为开发凝结芽孢杆菌BC2000和在富含EA食物中的补充应用提供进一步的理论依据。
猜你喜欢高脂芽孢菌群“云雀”还是“猫头鹰”可能取决于肠道菌群中老年保健(2022年2期)2022-08-24“水土不服”和肠道菌群科学(2020年4期)2020-11-26高脂血标本对临床检验项目的干扰及消除对策中华养生保健(2020年5期)2020-11-16解淀粉芽孢杆菌Lx-11农药科学与管理(2019年6期)2019-11-23解淀粉芽孢杆菌的作用及其产品开发农药科学与管理(2019年6期)2019-11-23侧孢短芽孢杆菌A60农药科学与管理(2019年8期)2019-11-23运动降低MG53表达及其在缓解高脂膳食大鼠IR中的作用中国运动医学杂志(2016年3期)2016-07-1030L发酵罐培养枯草芽孢杆菌产高密度芽孢的研究当代化工研究(2016年7期)2016-03-20肉牛剩余采食量与瘤胃微生物菌群关系动物营养学报(2015年10期)2015-12-01高脂饮食诱导大鼠生精功能障碍医学研究杂志(2015年12期)2015-06-10推荐访问:芽孢 小鼠 胰岛素推荐文章
- [高考励志:倒计时冲刺语录] 高考倒计时励志语录
- 2018江苏高考成绩查询入口,点击进入:江苏高考2018成绩查询
- [英语阅读:细数英语中那些出口的汉语]带汉语的英语阅读视频
- 双语阅读:英文吐槽“变凉”的天气_喜剧中心吐槽大会2018
- 2018年福建高考成绩查询网址:http://www.eeafj.cn/:2018福建二建成绩查询
- 小学五年级下册语文阅读理解练习题五道_5年级下册语文书人教版
- 河北教育考试院2018高考查分_福建教育考试院网2018年高考查分系统
- 2018年山西省拟录用公务员公示 [2018年浙江瑞安市各级机关公务员拟录用人员公示(五)]
- 好舌头绕口令 [英语绕口令:挑战你的舌头]
- [2018福建高考成绩什么时候可以查询] 2018中级会计成绩查询