硒酸化乳清分离蛋白抗前列腺癌细胞活性
来源:优秀文章 发布时间:2023-04-25 点击:
殷春雁,张 男,林 洁*,李灿鹏,*
(1.云南大学化学科学与工程学院,云南 昆明 650091;
2.西南林业大学材料与化学工程学院,云南 昆明 650224;
3.云南大学生命科学学院,云南 昆明 650091)
逐年上升的癌症发生率和相关的死亡率令全人类担忧[1]。随着肿瘤细胞对标准的化学疗法和放射疗法产生更强的抗性,含硒化合物的抗癌作用逐渐成为研究焦点[2-3]。含硒化合物包括无机硒(亚硒酸盐、硒酸盐)和有机硒化合物,两者均表现出良好的抗癌作用。例如,无机硒中,亚硒酸盐和亚硒酸钠能较好地抵抗前列腺癌[4-5]、乳腺癌[6]、肺癌[7]、肝癌[8]、膀胱癌[9]、恶性胶质瘤[10]、骨肉瘤[11]。有机硒中,硒代蛋氨酸[12]、甲基硒代半胱氨酸[13]、硒代半胱氨酸[14]、硒代胱氨酸[15]对各种癌细胞均具有良好的抑制作用。然而,体内研究表明,无机硒化合物的毒性强于有机硒[10,16]。适中剂量(0.3~0.5 mg Se/kgmb)和饮食剂量(0.01 mg Se/kgmb)的亚硒酸盐在体内代谢为硒化物(Se2-),然后整合到蛋白质中形成硒蛋白[17]。高剂量(>0.5 mg Se/kgmb)的亚硒酸盐会产生细胞毒性和遗传毒性[2,18-21],遗传毒性可能导致基因突变,不应长期摄入高剂量的亚硒酸盐[22]。然而,有机硒(如硒代氨基酸)在体内能够非特异地整合到蛋白质中形成硒蛋白(如谷胱甘肽过氧化物酶)或代谢为低分子质量的化合物[23],更容易随饮食摄入并在组织中保留[22,24-25],并且表现出低细胞毒性和非遗传毒性[15,22,25]。综上所述,若将无机硒整合到蛋白质中使之转变为有机硒蛋白,则可能兼具抗癌作用、低细胞毒性和非遗传毒性的特点。干燥加热法是一种新型、高效、绿色、环保、安全的食品改性方法[26-30]。基于此,本实验以亚硒酸钠和乳清分离蛋白(whey protein isolate,WPI)为研究对象,采用干燥加热法制备硒酸化乳清分离蛋白(selenated whey protein isolate,Se-WPI),并检测Se-WPI对前列腺癌细胞的作用,旨在初步发掘可能会对癌症具有预防、治疗作用的功能食品。
1.1 动物、材料与试剂
雄性昆明小鼠(体质量(20±2)g)由昆明医科大学实验动物学部提供,生产许可证号:SCXK(滇)2015-0004;
使用许可证号:SYXK(滇)K2021-0002。
人前列腺癌细胞株LNCaP(CRL-1740)、DU145(HTB-81)均购自美国ATCC细胞资源中心。
WPI(蛋白质量分数90%) 德国Müller公司;
亚硒酸钠(Na2SeO3)、二甲基硒 上海晶纯试剂有限公司。
碱性蛋白酶(200 U/mg)、胃蛋白酶(USP级,1∶30 000)、胰凝乳蛋白酶(USP级,1 500 U/mg)上海源叶生物科技有限公司;
链霉蛋白酶(7 000 U/g)上海阿达玛斯试剂有限公司;
改良型RPMI-1640培养基、0.25%胰蛋白酶(USP级,1∶2 500)溶液(1×) 美国HyClone公司;
胎牛血清 美国Gibco公司;
结晶紫、苏木精-伊红染色试剂盒、20 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、牛血清白蛋白(bovine serum albumin,BSA)、聚赖氨酸、层黏连蛋白、纤连蛋白、基底膜基质 上海碧云天生物科技有限公司;
Cell Counting Kit-8(CCK 8) 日本同仁化学研究所;
BCA蛋白定量试剂盒 天根生化科技(北京)有限公司;
多聚甲醛 无锡耐思生命科技股份有限公司;
细胞DNA含量(细胞周期)即时检测试剂盒江苏凯基生物技术股份有限公司;
异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-Annexin V细胞凋亡检测试剂盒 美国BD公司;
Caspase 3活力检测试剂盒英国Abcam公司;
Millicell细胞培养小室 北京明阳科华生物科技有限公司;
实验所用试剂均为分析纯。
1.2 仪器与设备
DZF-6050型真空干燥箱 上海博迅实业有限公司;
TG46离心机 长沙英泰仪器有限公司;
DK-98-II型1KW万用电炉 天津泰斯特仪器有限公司;
HH-S数显恒温水浴锅 江苏金坛医疗仪器厂;
T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;
F4500型荧光光度计 日本日立公司;
CK40-F200倒置显微镜 日本Olympus公司;
酶标仪 瑞士Tecan公司;
Astell 040高压灭菌锅 日本Hirayama公司;
血球计数板 上海求精生化试剂仪器有限公司;
C6流式细胞仪 美国BD公司;
半自动生化分析仪 合肥金浩峰生物科技有限公司;
Avance DRX500核磁共振(nuclear magnetic resonance,NMR)仪 美国Bruker公司。
1.3 方法
1.3.1 干燥加热法制备硒酸化乳清分离蛋白
采用Li Canpeng等[27-28]提出的干燥加热法制备Se-WPI。配制质量分数为2% WPI溶液,加入等质量Na2SeO3,调节pH值为3.0,将上述溶液冷冻干燥72 h获得固体,继续在80 ℃干燥加热24 h后溶解到适量蒸馏水中,置于截留分子质量10 kDa透析袋中,在蒸馏水中透析48 h,以除去粗产品中所含未反应的Na2SeO3,冷冻干燥,得到Se-WPI。以未作任何处理的天然WPI和干燥加热但未经硒酸化的乳清分离蛋白(dry heating whey protein isolate,DH-WPI)作为对照样品。
1.3.2 Se-WPI中有机硒质量分数的测定
Se-WPI中总硒质量分数的测定:采用2,3-二氨基萘荧光法[31]测定,称取20 mg Se-WPI于凯氏分解瓶中,分别加入高氯酸、浓硝酸、体积分数30%过氧化氢溶液各1 mL,电炉上400 ℃加热4 h使其分解完全,至瓶中溶液呈无色透明停止加热,冷却,加入2 mL去离子水,沸水浴煮沸20 min,冷却后定容至10 mL。1 000 μg/mL硒标准溶液经稀释后配制硒质量浓度依次为0、0.05、0.1、0.15、0.2、0.3 μg/mL的系列标准溶液,以硒质量浓度为横坐标,荧光强度为纵坐标,绘制标准曲线。根据标准曲线方程计算Se-WPI中总硒质量分数(Set)。
Se-WPI中无机硒质量分数的测定:4 mL离心管中加入Se-WPI样品5~6 mg,加入2 mL蒸馏水,再加入2 mL质量分数10%三氯乙酸(trichloroacetic acid,TCA)溶液,5 000 r/min离心20 min。取3 mL上清液于凯氏分解瓶中,其余步骤与总硒质量分数测定相同,根据标准曲线方程计算Se-WPI中无机硒质量分数(Sei)。
有机硒质量分数(Seo)按式(1)计算。
1.3.377Se-WPI的制备及77Se-NMR分析
参照Duddeck[32]的方法,准确称量20 mg硒粉(77Se),加入3 mL体积分数30%的硝酸溶液,沸水浴中加热30 min后,用酒精灯加热至白色结晶物生成,然后加入2 mL蒸馏水和60 mg WPI,调节pH值至3.0,冷冻干燥,将冷冻干燥后的产物在80 ℃下加热24 h,然后溶解于4 mL蒸馏水中,6 000 r/min离心30 min,重复2~3 次,收集沉淀和上清液。上清液冷冻干燥,回收77Se。
将沉淀溶解在适量蒸馏水中,于0.3 mol/L NaCl溶液中透析24 h,再于蒸馏水中透析48 h,冷冻干燥,得到77Se-WPI。将77Se-WPI样品15 mg溶于1 mL D2O中,然后将溶液装入核磁管中。用融封法将二甲基硒封入毛细管中,再将该毛细管装入核磁管中作为内标。采用NMR仪扫描得到77Se-NMR谱图,扫描参数:温度4 ℃、延迟时间范围0.01~15 s。
1.3.4 Se-WPI中硒酸根稳定性的测定
将一定质量Se-WPI样品溶解于50 mmol/L pH 7.0的Tris-HCl缓冲溶液中,使其终质量浓度为2 mg/mL。用Britton-Robinson广域缓冲溶液(H3PO4-HAc-H3BO3溶液,各溶质浓度均为0.04 mol/L)和0.2 mol/L NaOH溶液调节样品溶液至不同pH值(1、2、3、4、5、6、7、8、9、10、11)。将调节pH值后的所有样品溶液于37 ℃水浴24 h。取出蛋白样品溶液,按体积比1∶1加入10% TCA溶液以沉淀蛋白,在3 000 r/min离心30 min,收集上清液。用2,3-二氨基萘荧光法[31]测定Se-WPI样品溶液中上清液所含硒的质量分数。Se-WPI中硒酸根稳定性以脱硒率表示,脱硒率按式(2)计算。
1.3.5 Se-WPI消化率的测定
采用Li Canpeng等[33]的方法进行蛋白质消化实验。称取一定量的WPI、DH-WPI和Se-WPI溶于50 mmol/L Tris-HCl缓冲液(pH 7.0)中,使其质量浓度均为2 mg/mL。边搅拌边加入一定体积的10 g/L不同蛋白酶溶液,蛋白质与酶的最佳比例分别为碱性蛋白酶200∶1、胃蛋白酶50∶1、链霉蛋白酶100∶1、胰凝乳蛋白酶200∶1。分别在消化0、2、4、6、8、10、20 min时,各取2 mL溶液,加入2 mL 10% TCA溶液,混匀,3 000 r/min离心20 min,取上清液。采用Lowry法[34]测定上清液蛋白质量浓度并计算氮质量。蛋白消化率按式(3)计算。
1.3.6 Se-WPI抑制前列腺癌细胞增殖实验
1.3.6.1 LNCaP和DU145细胞的培养
LNCaP、DU145细胞均在改良型RPMI-1640完全培养基中,于37 ℃、5% CO2、饱和湿度的培养箱中培养,每隔1 d更换一次培养基。当细胞贴壁成致密单层(融合度达85%~95%)时,分瓶扩大培养。
1.3.6.2 WPI、Se-WPI、Na2SeO3抗LNCaP细胞增殖最佳作用水平的确定
用pH 7.4的磷酸盐缓冲液(phosphate buffered saline,PBS)配制系列不同浓度的Se-WPI、WPI、Na2SeO3溶液,充分溶解后过0.22 µm滤膜以除去杂质。采用BCA蛋白定量试剂盒测定蛋白质量浓度,采用2,3-二氨基萘荧光法[31]测定硒含量。加入不同终浓度的Se-WPI、WPI、Na2SeO3溶液培养LNCaP细胞24、48、72 h,根据细胞活力确定WPI、Se-WPI、Na2SeO3抗LNCaP细胞增殖最佳作用水平。
1.3.6.3 LNCaP和DU145细胞增殖率的测定
采用CCK-8法[35]检测细胞增殖情况。胰蛋白酶消化处理培养至对数生长期的LNCaP、DU145细胞,制备细胞悬液(LNCaP细胞5 000 个/mL、DU145细胞3 000 个/mL),按每孔100 μL接种于96 孔板,培养24 h。然后分别将Se-WPI、WPI、Na2SeO3用RPMI-1640完全培养基配制成一定浓度的溶液,每孔加入100 µL,PBS组为加入100 µL PBS,每组4 个复孔。继续培养24、48 h及72 h后,每孔加入10 μL CCK-8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定450 nm波长处OD值,按式(4)计算细胞活力,并计算Se-WPI、WPI、Na2SeO3对LNCaP细胞半数抑制浓度(50% inhibition concentration,IC50)。
1.3.6.4 结晶紫染色观察LNCaP细胞、DU145细胞克隆形成情况
12 孔板每孔中加入1 mL 5 000 个/mL LNCaP细胞或DU145细胞悬液,37 ℃、5% CO2条件下培养24 h,分别加入1 mL体积分数1% PBS、6 µmol/L Na2SeO3和质量浓度均为22 µg/mL的WPI和Se-WPI溶液(RPMI-1640完全培养基配制),继续培养12 d。吸除旧培养基,用质量分数4%多聚甲醛溶液固定10 min,蒸馏水洗涤2 min,换用新鲜蒸馏水再洗2 min,结晶紫染色10 min,用水充分洗涤,拍照,观察两种细胞形成集落的情况。
1.3.7 Se-WPI对前列腺癌细胞凋亡及黏附影响实验
1.3.7.1 LNCaP细胞周期检测
参照朱孝峰等[36]的方法。6 孔板每孔中加入5×105个/mL LNCaP细胞悬液1 mL,37 ℃、5% CO2条件下培养24 h,分别加入1 mL含体积分数1% PBS和不同终浓度的Na2SeO3、Se-WPI及WPI溶液,Na2SeO3终浓度分别为1.5、3.0 µmol/L,Se-WPI、WPI终质量浓度均分别为6、11 µg/mL(Se-WPI对应硒浓度分别为1.5、3.0 µmol/L),培养48 h。细胞经胰蛋白酶消化,收集细胞,用预冷的PBS洗涤细胞两次,末次洗涤时保留100 µL残留液,将细胞轻轻吹打成单细胞悬液。取50 µL(含1×105个细胞)加入到试管底部,按细胞DNA含量(细胞周期)即时检测试剂盒说明书,加入100 μL A液与细胞悬液轻轻混匀,尽量避免产生气泡,室温孵育10 min;
再加入100 µL B液,操作同上,室温孵育10 min;
加入150 µL C液,操作同上,室温避光孵育15 min。过200 目筛后用流式细胞仪检测。
1.3.7.2 LNCaP细胞率凋亡率检测
参照孔宪涛[37]的方法,6 孔板每孔中加入5×105个/mL LNCaP细胞悬液1 mL,37 ℃、5% CO2条件下培养24 h,分别加入1 mL体积分数1% PBS、3或6 µmol/L Na2SeO3、22 µg/mL WPI、22 µg/mL Se-WPI,(RPMI-1640完全培养基配制),培养48 h。用不含EDTA的胰蛋白酶消化收集细胞,预冷的PBS洗涤细胞两次,加入100 µL Binding Buffer重悬细胞(5 000 个/mL),加入5 µL FITC-Annexin V和5 µL碘化丙啶(propidium iodide,PI),室温避光孵育15 min,加入400 µL Binding Buffer,过200 目筛用流式细胞仪检测。
1.3.7.3 Caspase-3活力的检测
参照Philchenkov[38]的方法。当培养瓶中细胞融合度约为70%时,吸除旧培养基,加入6 mL体积分数0.5% PBS、1.5 µmol/L Na2SeO3和质量浓度均为11 µg/mL WPI和Se-WPI溶液(RPMI-1640完全培养基配制),培养48 h。消化收集细胞(包括悬浮细胞),PBS洗涤两次。每1×106~5×106个细胞加入50 µL预冷的细胞裂解缓冲液重悬细胞,冰浴10 min,10 000×g离心1 min,上清液转移至新的离心管中,分装,-80 ℃冻存备用。BCA法测定蛋白质量浓度,将蛋白质量浓度稀释至4 mg/mL。于96 孔板每孔中加入45 µL蛋白样品溶液,空白对照孔内加入等体积双蒸水,然后加入50 µL 2×Reaction Buffer(含10 mmol/L二硫苏糖醇),5 µL 4 mmol/L Caspase 3显色底物,37 ℃孵育2 h。用酶标仪于450 nm波长处测定吸光度。Caspase-3在1 min内水解产生1 pmol对硝基苯胺为一个酶活力单位(U),Caspase-3活力单位为U/μg。
1.3.7.4 LNCaP细胞对基底膜成分黏附能力的测定
参照Busk等[39]的方法,96 孔板每孔中分别加入30 µL含1% BSA溶液(PBS配制,阴性对照)、3 µmol/L Na2SeO3、22 µg/mL WPI、22 µg/mL Se-WPI和质量浓度均为30 µg/mL的层黏连蛋白、纤连蛋白和基底膜基质溶液,37 ℃孵育1 h。PBS洗一次,加入1% BSA溶液于37 ℃环境中封闭30 min,吸除封闭液,PBS洗一次。每孔加入细胞悬液(LNCaP细胞5 000 个/mL、DU145细胞3 000 个/mL)100 µL,平行3 组,37 ℃孵育2 h。弃除培养基,PBS洗两次,除去未结合的细胞,质量分数4%多聚甲醛溶液固定10 min,蒸馏水洗涤2 min,换用新鲜的蒸馏水再洗2 min,结晶紫染色10 min,用蒸馏水充分洗涤,拍照并计数。按式(5)计算细胞黏附率。
1.4 数据处理与分析
采用SPSS软件,用方差分析法对实验数据进行统计学处理,采用Origin 9软件作图。
2.1 Se-WPI中的硒质量分数及77Se-NMR分析结果
pH 3.0、80 ℃干燥加热24 h制备的Se-WPI中硒质量分数为2.09%。如图1所示,在77Se-NMR谱中δ1 317处出现硒的吸收峰,与已报道的H2SeO3(δ1 300)[32]、NaHSeO3(δ1 308)[40]非常接近,说明亚硒酸根与WPI发生了如下反应[32]:P-OH+H2SeO3→P-OHSeO2+H2O(P表示蛋白),即H2SeO3与WPI的羟基形成酯,故硒以亚硒酸酯的形式存在于Se-WPI中。

图1 Se-WPI的77Se-NMR谱Fig.1 77Se-NMR spectrum of Se-WPI
2.2 Se-WPI中硒酸根的稳定性
如图2所示,当Se-WPI溶液pH值小于等于10.0,脱硒率较低,均低于3%,说明Se-WPI中硒酸根的稳定性很好;
当Se-WPI溶液pH值增大至11,脱硒率陡增至74.5%,表明强碱环境中Se-WPI上的硒酸根不稳定。该结果进一步验证了O型亚硒酸酯的存在[32,40]。

图2 不同pH值下Se-WPI的脱硒率Fig.2 Rate of selenium removal from Se-WPI under different pH conditions
2.3 Se-WPI的消化性
蛋白被消化后会产生具有生物活性的肽,可以提高蛋白的营养价值、安全性和生理保健功能[41]。一般蛋白质保持原有结构时很难被蛋白酶消化,但当蛋白质经过处理,结构展开,暴露出更多的酶切位点时,其消化性提高[27-28]。本实验采用碱性蛋白酶、胃蛋白酶、链霉蛋白酶和胰凝乳蛋白酶对WPI、DH-WPI和Se-WPI进行消化。如表1所示,与WPI和DH-WPI相比,Se-WPI的消化性明显提高。可能是因为在干燥加热条件下,硒酸化过程中WPI暴露出更多的酶切位点,因此Se-WPI的消化性明显优于WPI和DH-WPI。

表1 WPI、DH-WPI和Se-WPI的消化率Table 1 Digestibility of WPI, DH-WPI and Se-WPI%
2.4 Se-WPI对LNCaP、DU145细胞增殖的影响
2.4.1 Se-WPI对LNCaP、DU145细胞生长的抑制作用
选择雄激素依赖型的人前列腺癌细胞(LNCaP细胞)和雄激素非依赖型的人前列腺癌细胞(DU145细胞)两种细胞株,加入不同水平受试药物培养不同时间,评价WPI、Se-WPI和Na2SeO3对前列腺癌细胞生长的影响。
如图3所示,通过实验优化得到WPI、Se-WPI、Na2SeO3抗LNCaP细胞增殖的最佳作用水平分别为WPI质量浓度20 μg/mL,Se-WPI中蛋白质量浓度20 μg/mL、其中硒浓度为5 μmol/L,Na2SeO3浓度5 μmol/L。如图4所示,在最佳作用水平下,相同培养时间,Se-WPI、Na2SeO3对LNCaP细胞生长抑制活性明显强于DU145细胞,且Se-WPI对于两种细胞生长的抑制作用均低于Na2SeO3。WPI对于两种细胞活力均无明显的抑制作用。如表2所示,相同作用时间下,Na2SeO3对LNCaP细胞的IC50均低于Se-WPI,而WPI本身没有明显抑制癌细胞增殖的活性。

表2 Se-WPI、Na2SeO3对LNCaP细胞的IC50Table 2 Fifty percent inhibition concentration (IC50) of Se-WPI and Na2SeO3 against LNCaP cells µmol/L

图3 WPI、Se-WPI和Na2SeO3对LNCaP细胞活力的影响Fig.3 Comparison of the effects of WPI, Se-WPI and Na2SeO3 on cell viability of LNCaP cells

图4 WPI、Se-WPI和Na2SeO3对LNCaP、DU145细胞活力的影响Fig.4 Comparison of the effects of WPI, Se-WPI and Na2SeO3 on cell viability of LNCaP and DU145 cells
2.4.2 Se-WPI对LNCaP、DU145细胞克隆形成的影响
在1% PBS、6 µmol/L Na2SeO3、22 µg/mL WPI、22 µg/mL Se-WPI条件下培养12 d后,两种细胞形成集落的情况如图5所示,Se-WPI、Na2SeO3处理组两种细胞集落分散、疏松,进一步证明Se-WPI、Na2SeO3对LNCaP细胞和DU145细胞生长有一定抑制作用,且对LNCaP细胞的抑制作用强于DU145细胞,即LNCaP细胞对于硒化合物的抑制作用更为敏感。因此,在后续实验中主要采用LNCaP细胞作为研究对象。

图5 WPI、Se-WPI、Na2SeO3对LNCaP、DU145细胞克隆形成的影响Fig.5 Effects of WPI, Se-WPI, and Na2SeO3 on clones formation of LNCaP and DU145 cells
以上实验结果均表明,Se-WPI抑制LNCaP细胞增殖的效果明显。虽然Se-WPI对LNCaP细胞增殖的抑制作用略低于Na2SeO3,然而,大量研究表明高剂量(>0.5 mg Se/kgmb)的Na2SeO3会产生细胞毒性和遗传毒性[2,18-21],遗传毒性可能导致基因突变,不应长期摄入高剂量的Na2SeO3[22]。而有机硒在体内表现出低细胞毒性和非遗传毒性[15,22,25],更易随饮食摄入并在组织中保留[22,24-25]。因此,本研究所制备Se-WPI可使硒由于从无机形态转为有机形态,其生物安全性优于Na2SeO3。
2.5 Se-WPI对LNCaP细胞周期及凋亡的影响
细胞周期是指从一次细胞分裂结束开始,经过物质积累,直到下一次细胞分裂结束为止[39]。凋亡细胞中DNA含量会减少,用PI对其进行染色,PI荧光强度会降低。用流式细胞术进行分析时,在DNA直方图中正常G0/G1细胞群前会出现凋亡细胞峰——亚二倍体峰(sub-G0/G1)。如图6所示,不同水平WPI、Se-WPI和Na2SeO3对LNCaP细胞作用48 h时,体积分数1% PBS处理下细胞生长周期正常,有1.1%的细胞处于凋亡细胞峰。加入6、11 µg/mL的WPI处理相同时间,LNCaP细胞周期未受到影响,处于凋亡的细胞数基本不变。加入Se-WPI或Na2SeO3,细胞周期发生明显变化,处于sub-G0/G1峰的细胞数明显增多,且Na2SeO3处理后处于凋亡状态的细胞分布比例明显高于Se-WPI,Se-WPI或Na2SeO3对细胞周期的诱导呈剂量依赖性。


图6 WPI、Se-WPI和Na2SeO3对LNCaP细胞周期的影响Fig.6 Effects of WPI, Se-WPI and Na2SeO3 on cell cycle in LNCaP cells
细胞凋亡由遗传机制决定,受到严格的程序调控。正常情况下,磷脂酰丝氨酸位于细胞膜脂质双分子层内侧,但在细胞凋亡早期,磷脂酰丝氨酸从细胞膜内侧翻转到外侧,暴露在细胞所处环境中。Annexin V是一种Ca2+依赖性磷脂结合蛋白,能与磷脂酰丝氨酸特异性结合。因此,细胞处于调亡或坏死状态时,FITCAnnexin V染色为阳性。PI是一种不能透过完整细胞膜的核酸染料,但其能够透过处在凋亡晚期和坏死细胞的细胞膜,使细胞核染红。因此,通过FITC-Annexin V与PI双染可以区分正常、凋亡和坏死细胞[42]。如图7、8所示,Se-WPI或Na2SeO3诱导LNCaP细胞发生凋亡,后者的诱导作用更强。培养48 h时,PBS组的细胞凋亡率为(0.95±0.07)%,而22 µg/mL Se-WPI组凋亡细胞比例达(6.95±0.64)%,是正常状态的7 倍以上,3 µmol/L Na2SeO3组细胞凋亡率为PBS组的20 倍以上,WPI组无明显变化。这说明干燥加热硒酸化修饰赋予WPI诱导细胞凋亡的活性。
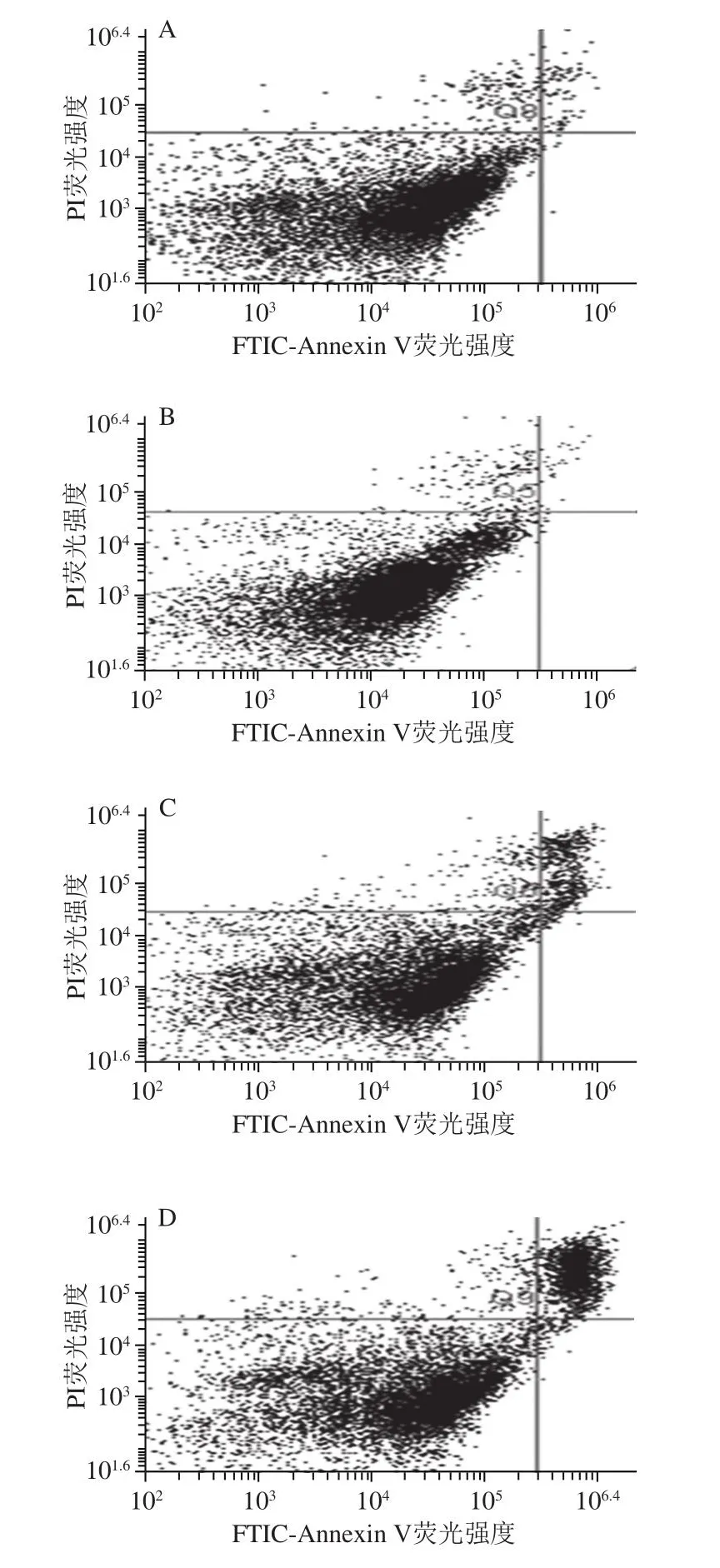
图7 WPI、Se-WPI和Na2SeO3对LNCaP细胞凋亡的影响Fig.7 Effects of WPI, SE-WPI and Na2SeO3 on apoptosis of LNCaP cells

图8 WPI、Se-WPI和Na2SeO3对LNCaP细胞凋亡的影响Fig.8 Effects of WPI, Se-WPI and Na2SeO3 on apoptosis of LNCaP cells
Caspase-3可以特异性断裂天冬氨酸残基后的肽键,在介导细胞凋亡的过程中发挥着非常重要的作用[43]。Caspase-3常以酶原的形式存在于胞浆中,在细胞凋亡早期被激活,是早期凋亡细胞的标志物。活化的Caspase-3裂解相应的胞浆和胞核底物,进而导致细胞凋亡[38]。如图9所示,相对于PBS组,WPI对Caspase-3活力几乎无影响,Se-WPI和Na2SeO3能够明显提高细胞内Caspase-3活力。表明Se-WPI和Na2SeO3均可以通过活化Caspase-3蛋白,从而诱导LNCaP细胞凋亡。
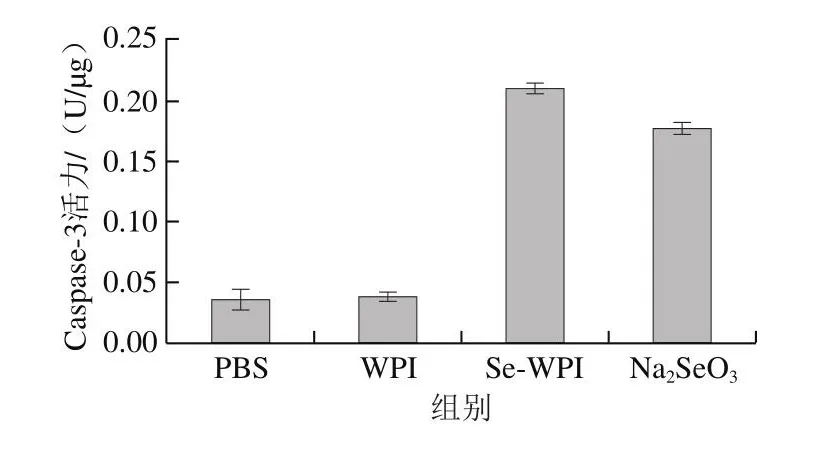
图9 WPI、Se-WPI和Na2SeO3对LNCaP细胞Caspase-3活力的影响Fig.9 Effects of WPI, Se-WPI and Na2SeO3 on caspase-3 activity in LNCaP cells
2.6 Se-WPI对LNCaP细胞对基底膜成分黏附能力的影响
转移是恶性肿瘤的基本特征,而细胞黏附是肿瘤转移过程中不可缺少的重要环节[39]。如图10所示,WPI对LNCaP细胞的黏附能力基本没有影响,与PBS组一致,而Se-WPI与Na2SeO3均可明显降低LNCaP细胞对层黏连蛋白、纤连蛋白和基底膜基质的黏附率,表明干燥加热硒酸化改善了WPI的活性,使其具有硒的生物学功能。
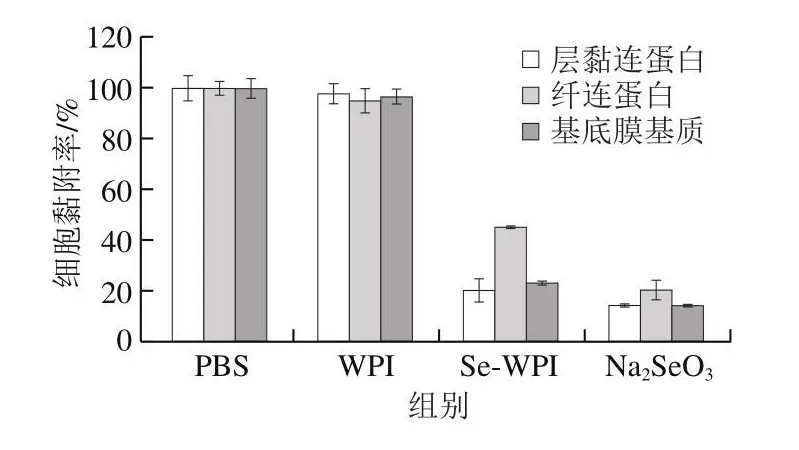
图10 WPI、Se-WPI和Na2SeO3对LNCaP细胞黏附能力的影响Fig.10 Effects of WPI, Se-WPI and Na2SeO3 on the adhesion of LNCaP cells to basement membrane components
以上实验从不同方面验证了Se-WPI具有与Na2SeO3相同的抑制LNCaP细胞凋亡的活性。含硒化合物的抗癌机制以诱导细胞凋亡为基础[44],此外,这些化合物也影响基因表达或各种细胞信号途径,包括DNA修复/损伤、血管再生等[45]。研究表明,由Na2SeO3诱导的细胞凋亡,线粒体是主要的参与者[8,18]。Na2SeO3很容易扩散进入线粒体[20],与线粒体内还原型谷胱甘肽反应产生过氧化物,进一步引起细胞器表面蛋白质的巯基被氧化。产生的过氧化物和被氧化的巯基打开线粒体膜通透性转运孔[8,46],线粒体膜电位降低[8,9,20,46],细胞色素释放到细胞质中[2,46],激活Caspase级联反应,诱导细胞凋亡[38,43]。本研究中,Se-WPI和Na2SeO3均能显著提高细胞内Caspase-3活力,推测Se-WPI诱导的细胞凋亡途径属于Caspase依赖型[5,20,47],具体机制还需进一步研究。
本实验采用干燥加热法成功将Na2SeO3整合到WPI中,得到Se-WPI,77Se-NMR和硒酸根稳定性实验结果表明Se-WPI中的硒以亚硒酸酯的形式存在。Se-WPI的消化性得到明显改善;
细胞毒性及集落形成实验结果表明,Se-WPI与Na2SeO3类似,都具有抑制LNCaP细胞、DU145细胞增殖的活性,且呈时间和剂量依赖性,而WPI对两种细胞的增殖没有影响;
LNCaP细胞对硒化合物的抑制作用较敏感;
细胞周期、细胞凋亡和Caspase-3活力检测从不同角度验证Se-WPI具有诱导LNCaP细胞凋亡的作用;
此外,Se-WPI还能够抑制LNCaP细胞与基底膜成分的黏附。本研究结果初步表明,Se-WPI具备作为新型防癌抗癌有机补硒剂的潜力,但其抗癌机制以及细胞毒性和遗传毒性等方面还需进一步研究。