刺梨自然发酵制酒过程中化学成分、,抗氧化活性及优势菌的变化
来源:优秀文章 发布时间:2023-04-25 点击:
彭欢,黄子健,吴涛,刘亮秀,陈国浚,杨翕淼,廖振林,方祥,王洁
(华南农业大学食品学院,广东广州 510642)
刺梨(Rosa roxburghiiTratt)又称为刺石榴、木梨子、送春归,是一种表面带刺、果肉酸甜可口的蔷薇科植物,主要分布在四川、贵州和湖南等地,少量分布于云南[1]。刺梨果肉不仅具含有丰富的维生素C、氨基酸和微量元素,享有“三王水果”美誉[2],而且含有丰富刺梨多糖、类黄酮、多酚和有机酸等,具有抗氧化性、增强免疫力、防治癌症和预防粥动脉硬化等保健功能[3-6]。由于潜在的“药食两用”价值,刺梨作为国内饮料、酒类以及营养保健品产业的一种重要原料,已被开发研制成多种产品,如刺梨果脯、刺梨果酒、刺梨糕胶、刺梨口服液、刺梨冻干粉胶囊以及刺梨复合维生素C等[7]。
刺梨果酒是对刺梨进行一定的发酵加工而制成的,保留了刺梨原有的维生素、氨基酸和矿物质,使其既有悦人的刺梨原果香又有协调的酒香,同时还能增强免疫力,起到保健、养生、健体作用。目前关于刺梨果酒的研究主要集中在刺梨果酒的工艺优化方面,如赵驰等[8]以刺梨原汁为原料,蜂蜜为微生物碳源进行发酵,通过感官评定和理化性质来优化发酵工艺;
韦唯等[9]以理化成分和感官评价为刺梨果酒品质的评价指标,结果表明不同发酵因素和不同发酵方式对刺梨酒品质有较大影响;
贺红早等[10]对全果发酵、无籽刺梨果汁发酵以及无籽刺梨汁渣混合发酵的次生代谢产物进行了定量测定,结合感官指标对3个处理的发酵产品进行综合分析。然而,刺梨酒发酵过程中的理化性质、抗氧化活性、微生物多样性等研究较少。
自然发酵是利用天然微生物发酵来获得最终产物,是一种历史比较悠久的传统发酵方式;
通过自然发酵后,食品中的多数营养成分和活性功能会得到提高和改善[11]。新鲜刺梨果实在自然条件下酿制成刺梨果酒,不仅能最大限度的保留刺梨本身的营养价值,还能改善刺梨原本的苦涩味。鉴于此,本文监控刺梨自然发酵制酒过程中的总酸、还原糖、酒精度等理化指标及总酚、总黄酮等抗氧化成分的含量及抗氧化能力的动态变化,并对抗氧化成分与抗氧化能力进行相关性分析,为进一步阐明刺梨果酒保健功能机理和综合开发提供理论基础;
与此同时,进一步深入研究刺梨自然发酵制酒过程中微生物群落动态变化,明确刺梨果酒发酵的主要优势菌株,对刺梨酿酒适制性菌种的选育及刺梨果酒品质的控制具有重要的指导意义。
1.1 材料和试剂
刺梨,购买于贵州贵阳市;
蔗糖、白醋,市购;
甲醇、乙腈,色谱纯,天津市科密欧化学试剂有限公司;
芦丁标准品(含量>98%)、鞣花酸标准品(含量>98%),阿拉丁;
葡萄糖、亚硝酸钠、碳酸钠、硝酸铝、硫酸铁、过硫酸钾、琼脂、氢氧化钠、LB肉汤培养基,分析纯,广州化学试剂厂;
微生物检测配套试剂(革兰氏染色液)、MRS肉汤培养基、马铃薯葡萄糖琼脂(PDA)培养基,广东环凯微生物有限公司;
通用引物ITS1、ITS4、27F、1492R、Taq酶,生工生物工程(上海)股份有限公司;
真菌基因组DNA提取试剂盒,杭州博日科技有限公司。
1.2 主要仪器设备
BSM-2200.2型电子天平,上海卓精电子科技有限公司;
e2695型高效液相色谱仪,美国Waters公司;
TG-16W台式高速离心机,长沙湘智离心机仪器有限公司;
TP600型PCR仪,德国Eppendorf公司;
DYY-8C电泳仪,北京六一生物科技有限公司;
WB-2000型水浴锅,郑州长城科工贸有限公司;
YXQ-LS-50A立式压力蒸汽灭菌锅,合肥华泰医疗设备有限公司;
SPX-250BⅢ生化培养箱,天津市泰斯特仪器有限公司;
THZ-300C恒温培养摇床,上海一恒科学仪器有限公司;
BA310-T电子显微镜,麦克奥迪(成都)仪器有限公司。
1.3 主要试验方法
1.3.1 刺梨自然发酵
称取1 kg新鲜刺梨,去除表面小刺,洗净后阳光暴晒2 h,使其表面水分蒸干。将处理好的刺梨放入已灭菌2 L发酵坛中,加入1 500 mL 40%蔗糖溶液和50 g白醋,水封后进行自然发酵。每隔3 d从发酵坛中分别取3份发酵液,每份800~1 000 μL置于-20 ℃冰箱保存备用。
1.3.2 微生物的分离与鉴定
1.3.2.1 微生物的分离
每隔4 d取10 mL刺梨自然发酵液,用无菌生理盐水进行不同梯度稀释,并将合适梯度的稀释液分别与MRS、PDA培养基及LB培养基混匀倾注于平板,将平板倒置于厌氧袋,放入37 ℃培养箱培养。48 h后,计算各个平板菌落总数[12],挑取不同形态的菌落进行划线纯化。
1.3.2.2 微生物的鉴定
将(1.3.2.1)纯化的菌落革兰氏染色[13,14]。同时将菌落液体培养基扩大培养,取菌液800 μL于1.5 mL EP管中,10 000 r/min离心10 min,吸净上清液。细菌就在沉淀中加无菌的1% SDS 20 μL,振荡6 min,65 ℃水浴5 min,加入480 μL无菌水混匀即为该菌的基因组,以基因组为模板,使用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)PCR扩增 16s rDNA序列[15];
真菌则用真菌基因组DNA提取试剂盒提取该菌的基因组,以基因组为模板,使用通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)、ITS4(5’-TCCTCCGCTTATTGATATGC-3’)PCR扩增ITS序列[16]。将提取的细菌和真菌DNA送至擎科生物科技有限公司测序,通过与NCBI数据库比对,建立进化树分析菌株亲缘关系。
1.3.3 感官评定
参考韦唯等[9]的评分标准进行适当修改,选择10人组建感官评定小组,依据感官评分标准对刺梨酒进行感官评定,取其平均值作为最终评分结果。感官评分标准如表1。

表1 刺梨果酒的感官评定标准Table 1 Rosa roxburghiiTratt wine sensory scoring criteria
1.3.4 化学成分含量测定
1.3.4.1 基本成分测定
采用pH计和糖度仪分别测定刺梨果酒的pH值和还原糖度;
采用酒精计法测定刺梨果酒酒精度,参考国标GB 5009.225-2016;
采用酸碱滴定法测定总酸含量,参考国标GB 12456-2021。
1.3.4.2 总酚含量测定
分别准确吸取10 μL的样品、不同含量的没食子酸标准溶液(0、100、200、300、400、500 μL)于不同10 mL的容量瓶中,加入2.5 mL的φ=50%福林酚溶液和2 mL的m=7.5% Na2CO3溶液,定容后37 ℃水浴30 min,测量其在765 nm的吸光度值。以没食子酸含量为横坐标,吸光度值OD765为纵坐标作标准曲线,以没食子酸标准曲线计算刺梨果酒中总酚含 量[17]。实验重复3次。
1.3.4.3 总黄酮含量测定
分别准确吸取0.5 mL的样品、不同含量的芦丁标准溶液(0.0、1.0、1.5、2.0、2.5、3.0、4.0 mL)于10 mL的容量瓶中,迅速加入m=5% NaNO2溶液和m=10% Al(NO3)3溶液各0.5 mL混匀后静置5 min;
加入m=4% NaOH溶液4 mL,用φ=60%乙醇定容,摇匀后静置5 min,测量在510 nm处的吸光度值。以芦丁含量为横坐标,吸光度值OD510为纵坐标,作标准曲线,以芦丁标准曲线计算刺梨果酒中总黄酮含 量[18]。实验重复3次。
1.3.4.4 抗坏血酸含量测定
高效液相色谱条件为C18色谱柱(250×4.6 mm, 5 μm),柱温为30 ℃;
检测波长为265 nm,进样量为10 μL;
流动相为0.05 mol/L KH2PO4溶液(pH值2.0):乙腈=97:3,流速1 mL/min。准确吸取250、125、50、25、5 μL的20 mg/mL抗坏血酸母液,超纯水制得5.0、2.5、1.0、0.5、0.1 mg/mL的抗坏血酸标准溶液。记录抗坏血酸(Vc)的色谱峰面积,以Vc色谱峰面积为纵坐标,对Vc浓度作图,绘制抗坏血酸标准曲线,根据标准曲线计算发酵液中Vc的含量[19]。实验重复3次。
1.3.5 抗氧化能力的测定
1.3.5.1 DPPH自由基清除率的测定
取待测酒液2 μL,加入3 mL DPPH·溶液 (0.2 mmol/L),加φ=95%乙醇至4 mL反应体系。涡旋震荡混匀后,置于室温下避光反应30 min后测其在517 nm处的吸光度[20,21]。蒸馏水代替样品作为空白对照,φ=95%乙醇代替DPPH·溶液用作自身对照。实验重复3次。DPPH自由基清除率计算公式如下:
式中:
B——DPPH自由基清除率,%;
At——样品反应溶液的吸光度;
Ar——自身对照溶液的吸光度,其中包括3.998 mL 95%乙醇溶液和2 μL样品溶液;
A0——空白对照溶液的吸光度,其中包括3 mL DPPH和 2 μL 50%乙醇溶液。
1.3.5.2 ABTS自由基清除率的测定
准确吸取2.5 mL ABTS·溶液和2.5 mL过硫酸钾溶液(5 mmol/L)于同一试管中,混合均匀,在室温黑暗中静置12 h,用PBS缓冲液(pH值7.4)稀释至吸光度为0.7的工作液,备用。取1 μL的样品及3 mL ABTS·工作液于试管中,蒸馏水调至总体积为4 mL。振荡混匀后放入30 ℃恒温热水浴中静置5 min,在波长 734 nm,测定在波长734 nm处样品溶液的吸光度[20,21]。实验重复3次。ABTS自由基清除率计算公式如下:
式中:
C——ABTS自由基清除率,%;
At——样品反应溶液的吸光度;
Ar——自身对照溶液的吸光度,其中包括1 μL的样品补加蒸馏水至4 mL;
A0——空白对照溶液的吸光度,其中包括3 mL的ABTS工作液和用1 mL的蒸馏水。
1.3.5.3 羟基自由基清除率的测定
无菌水将H2O2溶液(8.8 mmol/L)稀释10倍备用。取10 μL待测液,依次加入H2O2工作液、9 mmol/L乙醇水杨酸和9 mmol/L FeSO4溶液各1 mL,蒸馏水调至总体积为4 mL反应体系。充分振荡混匀,置于37 ℃恒温水浴锅中,静置30 min,测定其在波长510 nm处的吸光度[20,21]。蒸馏水代替待测液作为空白对照组,蒸馏水代替H2O2溶液作为自身对照组。实验重复3次。羟基自由基清除率计算公式如下:
式中:
D——羟基自由基清除率,%;
At——样品反应溶液的吸光度;
Ar——自身对照溶液的吸光度;
A0——空白对照溶液的吸光度。
1.3.6 数据处理与分析
实验结果以平均值±标准误表示,利用Graph Pad Prism 7统计软件进行绘图。采用DPS 9.01分析软件对数据进行差异显著性分析及相关性分析,以P<0.05为样本间有显著差异。利用MEGA 7绘制进化树,分析菌株的亲缘关系远近。
2.1 刺梨果酒的感官评定
刺梨发酵液的感官评定依据同一个感官评价表作为评分标准,从外观、滋味和香气等多方面来对刺梨发酵液进行评分,得到的数据具有一定参考价值。如表2所示,发酵前23 d,随着发酵天数的延长,刺梨果酒的综合评价越来越好,发酵23 d和更长时间的果酒感官评定分数无明显差别。果酒的生产主要经历两个阶段:酒精发酵和陈酿。在酒精发酵阶段,微生物将糖类分解并转化为酒精。发酵结束后进入陈酿阶段,这个阶段发生的一些化学反应不仅可以减少挥发酸、杂醇油等不良风味物质,提升果酒的香气和口感,酒体更澄清,品质更好[22]。

表2 刺梨果酒的感官评定结果Table 2 Sensory evaluation of Rosa roxburghiiTratt wine
2.2 刺梨果酒中化学成分的变化
在发酵过程中,刺梨果酒总酸、pH值、还原糖、酒精度等理化指标均发生了变化。随着发酵天数的增加,总酸含量总体呈现上升的趋势(图1a),发酵23 d时的总酸含量较初始值上升了2.01倍,随后趋于稳定;
发酵液pH值呈现上升趋势(图1b),pH值在30 d仅从3.20增加至3.50,变化不大,说明刺梨果实发酵过程中有效酸的变化幅度较小[23]。在发酵过程中,总酸含量增加可能是乳酸菌[24]和酵母菌[25]发酵作用产酸导致的;
在刺梨果实发育过程中由于抗坏血酸的不断积累,导致总酸含量随着果实发育不断增加[26],因此刺梨发酵过程中总酸含量变化也可能部分来源于发酵过程产生的抗坏血酸含量的增加。
发酵过程中还原糖的含量随着发酵天数的延长,呈现出总体下降的趋势(图1c),而酒精度则呈现出上升趋势(图1d)。在第13天,发酵液还原糖含量迅速下降50.88%,第29天发酵液还原糖含量缓慢下降23.58%;
在发酵第20天,酒精含量快速上升至9.63%vol,但第29天,酒精含量仅上升1.76%,接近发酵终点。发酵过程中还原糖和酒精度的含量与酵母菌的生长有关[23]。在发酵初期,酵母菌处于对数生长期,需要消耗大量的糖来用于自身生长代谢,而在发酵后期,随着酒精含量升高,酵母菌生长速度下降,耗糖量也下降,所以还原糖含量下降趋势变缓。

图1 刺梨发酵制酒过程中总酸(a)、pH值(b)、还原糖(c)及酒精度(d)含量的变化Fig.1 Changes in the contents of total acid (a), pH (b), total sugar (c) and alcohol (d) during the fermentation of Rosa roxburghiiTratt
2.3 刺梨果酒中抗氧化成分的变化
在发酵过程中,刺梨果酒中总酚、总黄酮和抗坏血酸含量均发生了变化。随着发酵时间的延长,总酚、总黄酮和抗坏血酸含量呈现显著先升高后降低的趋势(图2)。总酚含量第9天上升5.05倍,随后下降16.91%(图2a);
总黄酮含量第9天上升10.37倍,随后下降1.91%(图2b);
抗坏血酸含量第9天上升2.53倍,随后下降5.73%(图2c)。Filannino等[27]研究乳酸菌发酵樱桃汁和西兰花浓浆过程中酚酸和类黄酮的代谢时发现乳酸菌在代谢过程中将大分子的酚类物质水解成小分子酚类,使总酚含量增加;
Danyue Zhao等[28]研究乳酸菌代谢茶酚类物质的能力时发现细菌改变酚类的成分以及使总酚含量的升高;
有文献报道细菌酶能够将多酚代谢成酚酸和其他小分子[29]。因此,我们推测刺梨自然发酵前期总酚含量增加可能是微生物将大分子酚类物质转化成小分子酚类物质而导致的。第9天总酚含量下降,可能是酒精发酵过程中酚类化合物与蛋白质甚至酵母菌的结合或吸附,诱导了这些化合物的损失[30]。总黄酮含量的变化与Escudero-López等[31]的研究一致:发酵过程中乙醇的存在有助于从刺梨的果肉中提取类黄酮;
在第9天总黄酮含量降低可能是由于长时间发酵导致黄酮类化合物的分解。在刺梨果实中,抗坏血酸含量非常高[32],发酵过程中酒精使其溶解在发酵液中,因此抗坏血酸含量增加;
发酵后期抗坏血酸含量下降,可能有一些维生素发生了降解[33]。
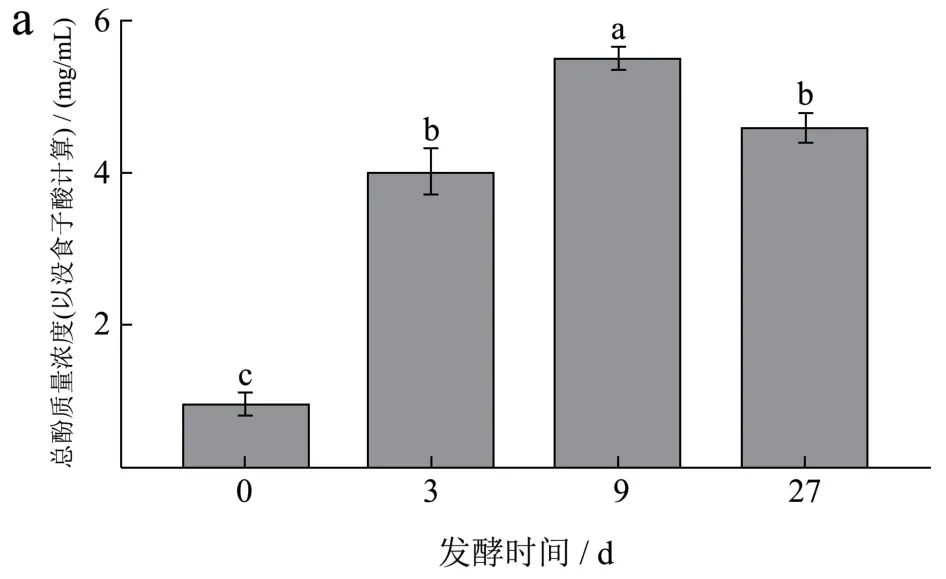

图2 刺梨发酵制酒过程中总酚(a)、总黄酮(b)、抗坏血酸(c)含量的变化Fig.2 Changes in the contents of total phenol (a), total flavonoid (b) and ascorbic acid (c) during the fermentation of Rosa roxburghiiTratt
2.4 刺梨果酒抗氧化活性能力的变化
DPPH、ABTS自由基清除能力和羟基自由基清除率变化趋势能够反映抗氧化活性能力的变化趋势[34]。随着发酵天数延长,刺梨自然发酵液的DPPH自由基清除率(图3a)、ABTS自由基清除率(图3b)和羟基自由基清除率(图3c)呈现显著先上升后降低的趋势。在第9天时各清除率达到最高值,DPPH自由基清除率为30.82%,ABTS自由基清除率为89.80%,羟基自由基清除率为22.90%,随后各清除率逐渐下降,这种趋势与付龙威等[35]的研究结果一致:这可能与酚类物质的变化趋势有关。另外,刺梨发酵后的自由基清除能力增加这一变化与侯金丽等[36]研究刺梨植物乳杆菌饮料时结果相同。


图3 刺梨发酵制酒过程中DPPH自由基清除率(a)、ABTS自由基清除率(b)、羟基自由基清除率(c)变化Fig.3 Changes in DPPH free radical scavenging rate (a), ABTS free radical scavenging rate (b), hydroxyl free radical scavenging rate (c) during the fermentation of Rosa roxburghiiTratt
2.5 抗氧化物质含量变化与抗氧化活性变化的相关性分析
研究表明刺梨果实的抗氧化能力是多物质协同作用的结果,其中总酚、总黄酮和Vc起着决定性作用,且总酚和总黄酮的贡献大于Vc[37,38]。我们发现:刺梨自然发酵制酒过程中总酚含量和抗坏血酸含量的变化与三种自由基清除率的变化都呈极显著的正相关关系(表3),其中,总酚含量与三种自由基清除率的变化相关系数都大于0.90以上(P<0.01),说明酚类物质含量的变化是影响刺梨发酵酒发酵过程中抗氧化活性变化的主要因素[39,40]。此外,总黄酮含量的变化与DPPH、ABTS和羟基自由基清除率的变化都有显著正相关关系(P<0.05),说明黄酮类化合物对刺梨发酵酒中抗氧化活性起着重要作用[41]。综上所述说明发酵过程中抗氧化活性的变化与刺梨果酒中多酚、总黄酮和抗坏血酸含量变化有一定相关性。

表3 刺梨果酒中抗氧化物质含量变化与抗氧化活性变化的相关性Table 3 Correlation between changes in the contents of antioxidant substance and antioxidant activity in Rosa roxburghiiTratt wine
2.6 刺梨发酵过程中的微生物分析
2.6.1 发酵过程中的优势菌菌落总数变化
在发酵过程中进行代谢的微生物种类繁多,发酵过程中的主要微生物包括乳酸菌类和各类酵母菌 等[42,43]。刺梨发酵过程中,如图4所示,酵母菌菌落总数在发酵前17 d增长至1.70×105CFU/mL,第17天后下降80%;
乳酸菌菌落总数在第0~9天内迅速增长至4.27×105CFU/mL,而第9~13天乳酸菌减少75.19%,后13 d缓慢减少。在发酵前期,发酵液中营养物和还原糖含量丰富,酵母菌和乳酸菌繁殖快,且乳酸菌的生长速率比酵母菌快,这是因为乳酸菌的糖代谢能力比酵母菌的强[44];
第9天酵母菌产生酒精使发酵液中酒精度浓度增大,抑制了乳酸菌的生长繁殖,而酵母菌的酒精耐受性比乳酸菌的强,酵母菌生长繁殖数量依然增加。随着发酵液中的营养成分不断减少,酵母菌和乳酸菌生长进入衰亡期。

图4 刺梨发酵制酒过程中酵母菌(a)和乳酸菌(b)菌落总数Fig.4 Changes in total number of yeast (a) and lactic acid bacteria (b) during the fermentation of Rosa roxburghiiTratt
2.6.2 特定优势菌的菌种鉴定
从刺梨发酵制酒样品中分离到的1株真菌及2株细菌,真菌菌落形态为圆形隆起、直径为(3±1)mm、表面光滑、湿润粘稠、边缘整齐、乳白色、不透明、菌落背面为黄色、革兰氏染色试验呈紫色(图5a~b),ITS序列与酿酒酵母SH-4菌株同源性达99.75%(图5c),因此确定该菌为酿酒酵母,命名为WP20201;
细菌1菌落形态为圆形,颜色呈白色(图5d),革兰氏染色试验呈紫色(图5e),16s rDNA序列比对与乳酸片球菌8471同源性达99.79%(图5f),鉴定该菌为乳酸片球菌,命名为WP20202;
细菌2菌落形态为呈圆形,中等大小,凸起,白色,边缘整齐,直径(3±1)mm,菌落背面为白色(图5g),革兰氏染色为红色(图5h),16s rDNA序列与棘皮鞘氨醇单胞菌MT89的同源性达100%(图5i),将该菌定为棘皮鞘氨醇单胞菌,命名为WP20203。
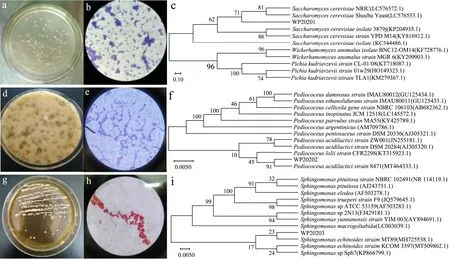
图5 刺梨发酵制酒样品中的1株真菌及2株细菌的鉴定Fig.5 Identification of one fungus and two bacteria from the fermentation of Rosa roxburghiiTratt
本文以刺梨为原料,经过23 d自然发酵后果酒有最佳的品质,酒体颜色金黄,有比较悦人的果香与酒香,味道醇美柔和爽口,酸甜适中,具有刺梨果酒的典型风格。发酵过程中,总酸含量呈现上升的趋势,pH值呈现上升趋势,还原糖含量呈现下降趋势,酒精度总体呈上升趋势;
总酚、总黄酮和抗坏血酸含量先升高后降低;
DPPH自由基清除率、ABTS自由基清除率和羟基自由基清除率呈显著先上升后降低的趋势,这与样品中的总酚、总黄酮和抗坏血酸含量变化呈显著相关;
酵母菌和乳酸菌总数先上升后下降,其优势酵母为酿酒酵母,优势细菌为乳酸片球菌和棘皮鞘氨醇单胞菌。研究结果为进一步阐明刺梨果酒保健功能机理和综合性开发提供理论基础和技术依据,同时为优化刺梨发酵工艺提供依据。然而,刺梨发酵制酒过程中酿酒酵母/乳酸片球菌/棘皮鞘氨醇单胞菌数量的动态变化、营养成分变化等特征还有待于后续进一步研究。