基于HIF1α-Smad/Runx2/Osterix信号轴探讨黄芪补肾活血汤治疗乳腺癌骨转移的作用机制*
来源:优秀文章 发布时间:2023-04-17 点击:
张梦棣,时光喜,浦冬青,冯丹丹,李静蔚
(1.山东中医药大学中医学院 济南 250000;
2.山东中医药大学第一临床学院 济南 250000;
3.山东中医药大学附属医院 济南 250000)
26%-50%乳腺癌患者的首发转移为骨转移,乳腺癌骨转移患者比例高达73%[1]。骨转移不仅会导致剧烈的骨痛,还会引起病理性骨折、高钙血症以及脊髓压迫等骨相关事件[2],严重影响患者生活质量、预后及总生存期。乳腺癌患者确诊骨转移后的5年生存率仅20%-30%[3],不同亚型乳腺癌的预后及转归也有很大差异,其中以激素受体阳性者最容易发生骨转移,发生率为63.7%,其晚期乳腺癌患者中72.1%首次转移的部位为骨[3]。内分泌治疗方案中的芳香化酶抑制剂和卵巢功能抑制剂可以抑制雌激素的产生、氟维司群可下调并降解ER、提高破骨细胞活性、抑制成骨细胞功能、促进肿瘤骨转移。同时乳腺癌骨转移易对治疗产生抗性,疾病易进一步进展,晚期转移很难治愈,此时主要治疗目标是减轻病痛、改善生活质量和延长生存期[4]。
西医的各种治疗手段疗效明显,但伴有一定的副作用,如贫血、胃肠道反应以及食欲下降等。临床研究中越来越多的中药方[5-7]被挖掘出具有治疗乳腺癌骨转移作用,同时可以抗癌止痛、减少副作用、提高身体机能状态及生存质量。本研究在中医理论指导下,总结临床病例,提出在经典方剂补肾活血汤基础上增加补益正气之黄芪用于乳腺癌骨转移治疗,从“补肾益气”、“活血化瘀”论治,标本兼治。通过体外实验探究黄芪补肾活血汤治疗乳腺癌骨转移的作用机制,为乳腺癌骨转移提供更多的方药选择。
1.1 细胞来源
乳腺癌细胞MCF-7、成骨细胞MC3T3-E1购于武汉塞维尔公司。
1.2 药物与试剂
黄芪补肾活血汤中药饮片由山东中医药大学附属医院中药房采购并经过药学部主任马传江鉴定,均符合相应要求。黄芪补肾活血汤制备:黄芪补肾活血汤的组成为:黄芪(Astragali Radix,12 g,产地内蒙古自治区,批号2102230252),熟地(Rehmannia glutinosa,12 g,产地河南,批号 2007280222),补骨脂(Psoralea corylifolia Linn,12 g,产地云南,批号1909030952),菟丝子( Cuscuta chinensis Lam,12 g,产地内蒙古自治区,批号2012300342),杜仲(Eucommia ulmoides Oliver,4 g,产地湖北,批号2012060152),枸杞(Lycium chinense,4 g,产地宁夏回族自治区,批号201201检4),当归(Angelicae Sinensis Radix,4 g,产地甘肃,批号200901检H),山萸肉(Cornus officinalis Sieb. et Zucc,4 g,产地浙江,批号2012150122),肉苁蓉(Cistanches Herba,4 g,产地新疆维吾尔自治区,批号2011080252),独活(Angelicae Pubescentis Radix,4g,产地湖北,2103070122),红花(Carthamus tinctorius L,2 g,产地新疆维吾尔自治区,批号2103280012)。制药后于冰箱中保存(4℃)。具体步骤如下:把煎药器药缸和蒸发浓缩设备用蒸馏水和75%酒精反复冲洗,将补肾活血中药用煎药器加水煎至生药浓度为1.0 g·mL-1的水剂制成黄芪补肾活血汤药母液,将浓缩好的汤液离心(3000 r·min-1,半径16 cm)5 min 5次,滤纸过滤后采用高压蒸气灭菌法灭菌后使用0.22 μm无菌滤器过滤。取滤液备用。我们将水煎液的过程进行了严格的程序化,以保证水煎液细胞实验的可靠性和可重复性。经过3次测试,结果均一致。
胎牛血清(Biological Industries公司,货号04-001-1A),DMEM高糖培养基(中科迈晨科技有限公司,货号CM15019),胰蛋白酶(美国Gibco公司,货号1798320),青-链霉素(中科迈晨科技有限公司,货号cc004),细胞增殖与活性检测(CCK-8)试剂盒(日本北仁,货号CK04),EdU-555细胞增殖检测试剂盒(上海碧云天生物技术有限公司,货号C0075L),Annexin VFITC/PI Apoptosis Detection Kit(Vazyme,货 号 A211-02),缺氧诱导因子1α抗体(HIF1α)、内参β-肌动蛋白(β-actin)、羊抗鼠疫球蛋白(Ig)G二抗、山羊抗兔(Ig)G二抗(武汉三鹰生物技术有限公司,货号分别为20960-1-AP、66009-1-Ig、SA00001-1、SA00001-2);
Smad1、Smad5、Runx2、Osterix抗体(英国Abcam公司,货号分别为ab33902、ab40771、ab192256、ab209484),BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶、SDSPAGE电泳液、一抗稀释液、二抗稀释液(上海碧云天生物技术有限公司,货号分别为P0010、P0012AC、p0562、P0023A、p0023D),电转液(北京索莱宝科技有限公司,货号P0021b)。
1.3 设备
Multiskan Go1510型酶标仪、5424R型低速离心机(美国Thermo Fisher),DK-8D型电热恒温水浴锅(上海比朗),LDZM-80KCS-Ⅱ型立式压力蒸汽灭菌器(上海申安医疗器械厂),SIM-F124型制冰机(日本SANYO),CascadaⅠ型纯化水系统(美国 PALL),Axiovert 40型倒置显微镜(德国Carl zeiss)。
2.1 细胞培养
将MCF-7细胞、MC3T3-E1细胞置于高糖DMEM完全培养基中培养(含胎牛血清10%,青霉素-链霉素1%),37℃,5% CO2条件培养箱中孵育,隔日传代1次。
2.2 共培养
采用Transwell培养板(美国康宁)构建共培养体系,小室上室中铺4×104个MCF-7细胞,下室中铺4×106个MC3T3-E1细胞;
Transwell小室中细胞培养24 h之后,向上室中的MCF-7细胞添加药物,浓度分别0、20、40 mg·mL-1,培养48 h后,收取下室细胞,用于蛋白检测。
2.3 CCK-8法检测细胞活力
取对数生长期的MCF-7细胞,胰蛋白酶消化,完全培养基终止消化。制作浓度为每毫升7×104个的单细胞悬液,加入96孔板中(每孔100 μL)。24 h后实验组加入黄芪补肾活血汤梯度质量浓度(0、20、40、60、120、240 mg·mL-1),对照组加入唑来膦酸梯度质量浓度(0、10、20、40、60 mg·mL-1)。实验药物浓度每个浓度设5个平行孔,培养48 h。每孔加入CCK-8试剂10 μL,37℃恒温培养40 min,酶标仪探测450 nm波长处吸光度A。细胞增殖存活率通过GraphPad软件计算。
2.4 划痕实验检测细胞迁移能力
将细胞接种于6孔板,继续培养至细胞融合度约90%时,使用200 μL枪头于细胞板上划痕,PBS冲洗清除被划下的贴壁细胞,然后加入无血清培养基继续培养。分别于划痕后0 h、24 h时取样并拍照记录。最后使用Image J软件测量划痕面积,并计算细胞迁移率。
2.5 Transwell实验检测细胞侵袭能力
取750 μL完全培养基加入24孔板中,取适量细胞铺入上室,滴加无血清培养基补全至200 μL。将上层小室中的培养基弃掉,并用PBS清洗,在新的孔中添加750 μL多聚甲醛,将上层小室转移至多聚甲醛固定20 min。固定结束后,将小室取出,用PBS清洗,用棉签将内膜细胞轻轻旋转擦拭,在新的孔中添加750 μL 10%结晶紫染色液,将上层小室转移至其中染色20 min。取出小室,用PBS清洗,显微镜拍照。
2.6 流式细胞术检测细胞凋亡
离心收集MCF-7细胞加入PBS重悬清洗细胞,然后先后加入FITC Annexin V及PI进行染色,避光孵育15 min后,使用流式细胞仪进行检测。
2.7 平板克隆实验检测细胞克隆增殖能力
将细胞接种于培养皿,置于恒温细胞培养箱内常规培养1-3周。有集落生成时,终止培养。使用PBS洗涤细胞2次后,分别以4%甲醇、10%结晶紫对细胞进行固定与染色,作用时间均为20 min。PBS清洗,待干燥后在显微镜低倍镜下观察拍照并计数。其中,将超过10个细胞的集落作为一个有效克隆,以克隆数与接种细胞数的百分比表示各组细胞的克隆形成率。
2.8 Edu增殖实验检测细胞增殖能力
将细胞接种于6孔板培养24 h,弃去原培养基,加入500 μL 2x的EdU工作液继续孵育2 h。EdU标记细胞完成后,进行细胞涂片,加入4%的多聚甲醛,室温固定15 min。冲洗后,每孔用通透液室温孵育15 min,再次冲洗后加入Click反应液均匀覆盖样品,室温避光孵育30 min。冲洗后吸除,每孔加11×Hoechst 33342溶液,室温避光孵育10 min。吸除后洗涤,然后进行荧光拍照检测。
2.9 蛋白免疫印迹法(Western blot)检测细胞蛋白表达情况
细胞加药分组处理48 h,取沉淀,各加含1%PMSF的裂解液约80-100 μL,取上清。BCA试剂盒测蛋白浓度。电泳,每个泳道上样30 μg;
转膜,然后5%脱 脂 奶 粉 室 温 封 闭 1 h。
HIF1α、Smad1、Smad5、Runx2、Osterix抗体在4℃下过夜孵育。二抗室温孵育1 h,显影。相对蛋白表达量=灰度值(目的)/灰度值(内参)。
2.10 统计学分析
所有实验均重复3次,采用SPSS 26及GraphPad Prism 9软件进行统计学分析及作图,多组间比较使用单因素方差分析,P<0.05为差异有统计学意义。
3.1 黄芪补肾活血汤抑制MCF-7细胞活力
细胞系选取最容易发生骨转移的Luminal A型乳腺癌细胞MCF-7,在干预48 h时,CCK-8法检测显示在20-120 mg·mL-1黄芪补肾活血汤的干预下相对于空白组具有明显抑制作用,特别是40-120 mg·mL-1剂量的药物对MCF-7细胞抑制作用最明显,得半数抑制浓度(IC50)为(28.58±1.79)mg·mL-1。唑来膦酸组显示药物浓度在10-40 mg·mL-1时相对于空白组抑制明显。见图1。
3.2 黄芪补肾活血汤有效抑制MCF-7迁移
迁移实验显示,黄芪补肾活血汤(20 mg·mL-1、40 mg·mL-1)组 细 胞 迁 移 率 分 别 为(22.2±4.1)% 、(17.3±3.4)%,与control组(30.0±7.9)%相比,迁移率明显降低(P<0.05),差异具有统计学意义。见表1和图2。
3.3 黄芪补肾活血汤显著抑制MCF-7细胞侵袭
Transwell检测结果显示,黄芪补肾活血汤(20 mg·mL-1、40 mg·mL-1)组穿膜细胞数分别为 414.7±34.0、374.7±58.6,与control组(514.7±24.11)相比,明显减少(P<0.05),差异具有统计学意义。见表1和图3。
3.4 黄芪补肾活血汤明显促进MCF-7细胞凋亡
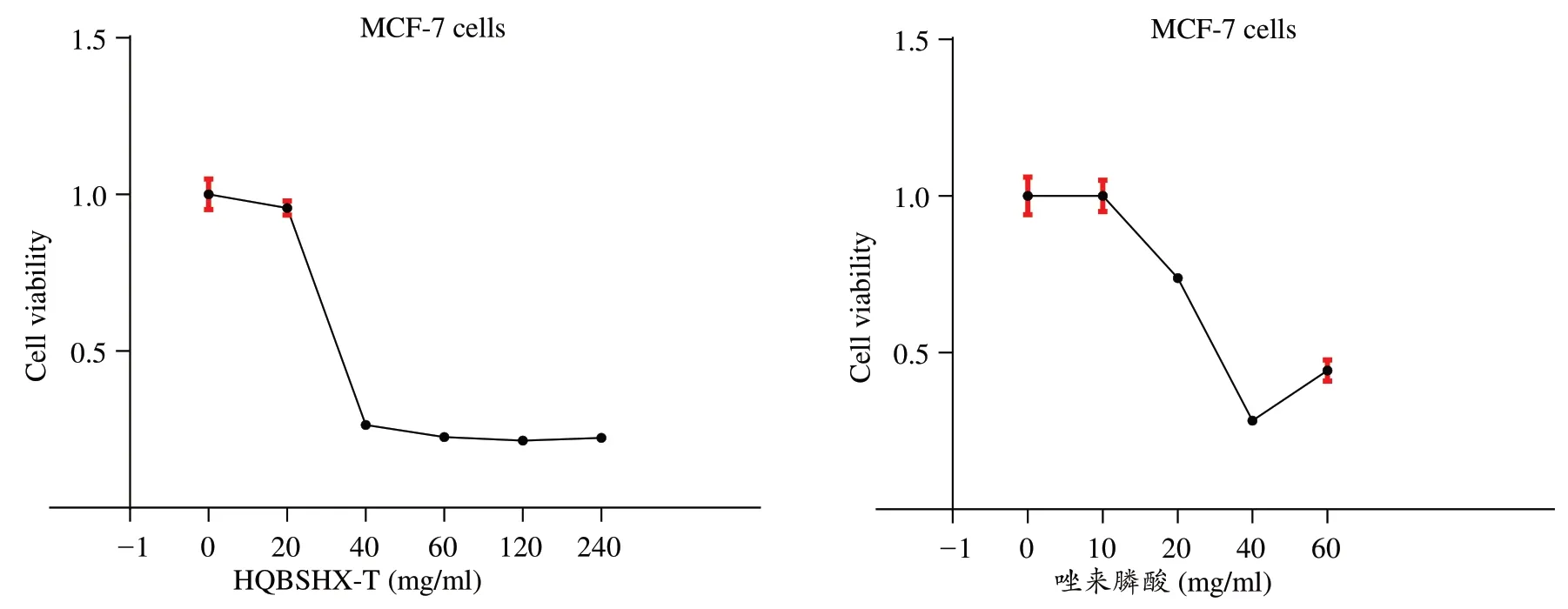
图1 CCK-8 法检测不同质量浓度黄芪补肾活血汤、唑来膦酸干预MCF-7细胞48 h后的活力变化

图2 迁移实验检测不同质量浓度黄芪补肾活血汤干预MCF-7细胞24 h后的迁移变化

图3 Transwell检测不同质量浓度黄芪补肾活血汤干预MCF-7细胞的侵袭变化
流式细胞术检测结果显示,黄芪补肾活血汤(20 mg·mL-1、40 mg·mL-1)组细胞凋亡率分别为(6.3±0.1)%、(6.2±0.1),较 control组(3.8±0.2)%明显升高(P<0.05),差异具有统计学意义。见表1和图4。
3.5 黄芪补肾活血汤有效抑制MCF-7细胞克隆增殖能力
平板克隆实验检测MCF-7细胞黄芪补肾活血汤(20 mg·mL-1、40 mg·mL-1)组的细胞克隆个数分别为392.0±51.1、325.3±50.3,与control组(437.3±31.1)相比较,差异具有统计学意义(P<0.05)。见表1和图5。

表1 不同质量浓度黄芪补肾活血汤对MCF-7细胞迁移、凋亡、侵袭、克隆的影响
3.6 黄芪补肾活血汤明显降低EDU细胞阳性率
EDU增殖实验检测黄芪补肾活血汤对MCF-7细胞增殖的影响,control组、黄芪补肾活血汤(20 mg·mL-1、40 mg·mL-1)组的 EDU 细胞阳性率分别为(22.4±1.5)%、(21.9±1.6)%、(20.2±0.6)%,3 组相比较,差异具有统计学意义(P<0.05)。见表1和图6。
3.7 黄芪补肾活血汤抑制HIF1α、Osterix的蛋白表达,提高Smad1、Smad5、Runx2的蛋白表达
乳腺癌细胞选取最容易发生骨转移的Luminal A型乳腺癌细胞MCF-7,骨细胞选取成骨细胞MC3T3-E1,共培养后收取蛋白。根据IC50,分别选取低、高质量浓度20、40 mg·mL-1用于Western blot中检测黄芪补肾活血汤对HIF1α、Osterix、Smad1、Smad5和Runx2蛋白表达的影响,见图6。结果提示与空白组相比,20 mg·mL-1组和40 mg·mL-1组HIF1α、Osterix的表达均明显降低(P<0.05),Smad1、Smad5、Runx2的表达明显升高(P<0.05),且 40 mg·mL-1组作用更明显。见表 2和图7。

图4 流式凋亡术检测不同质量浓度黄芪补肾活血汤干预MCF-7细胞的凋亡变化

图5 平板克隆实验检测不同质量浓度黄芪补肾活血汤干预MCF-7细胞克隆的变化

图6 EDU增殖实验检测不同质量浓度有效黄芪补肾活血汤抑制MCF-7细胞增殖
表2 黄芪补肾活血汤对HIF1α、Osterix、Smad1、Smad5、Runx2蛋白表达的影响()

表2 黄芪补肾活血汤对HIF1α、Osterix、Smad1、Smad5、Runx2蛋白表达的影响()
注:与control组比较,1)P=0.05,2)P<0.05,3)P<0.01。
Smad5 0.90±0.11 1.53±0.143)1.56±0.123)组别Control黄芪补肾活血汤组 20 mg·mL-1 40 mg·mL-1蛋白相对表达量HIF1α 1.07±0.02 0.84±0.042)0.60±0.133)Osterix 1.16±0.13 0.68±0.121)0.61±0.153)Runx2 0.71±0.12 1.06±0.023)1.66±0.143)Smad1 0.44±0.006 0.84±0.083)1.01±0.023)

图7 Western blot检测低、高浓度黄芪补肾活血汤抑制MCF-7细胞HIF1α、Osterix蛋白表达,促进smad1、smad5、Runx2蛋白表达
乳腺癌骨转移是一个多种因子参与、多步骤和连续性的级联反应过程[8],分为局部浸润、进入脉管系统、在脉管系统中存活、到达转移组织或器官、逸出循环系统、形成转移灶和形成克隆转移灶等过程[9]。转移至骨骼的乳腺癌细胞会通过干扰破骨细胞介导的骨吸收和成骨细胞介导的骨形成而打破正常骨骼重塑的平衡[10]。目前主要从抑制骨转移灶中肿瘤细胞的生长和抑制破骨细胞的活性两方面来减少骨相关事件的发生,常用药物有双膦酸盐、地诺单抗等[9],但远期疗效仍不理想,且伴有严重的副作用。祖国医学认为“肾损”是乳腺癌骨转移的主要病因,癌症日久,复经手术、放化疗等,损伤正气,耗竭肾精,肾主骨生髓,肾精亏虚则骨空髓枯,邪气乘虚而入,凝结于骨,阻滞经络,引起疼痛[11-12]。治疗上强调整体观念,根据各个患者不同的临床症状,调整机体阴阳、气血、脏腑功能的平衡,标本兼治,扶正祛邪,从而减少肿瘤的复发与转移以及延长生存期与提高生活质量。
近年来,中医药治疗乳腺癌骨转移在作用机制探索、临床疗效观察上的研究均取得了重要进展[13]。冯丹丹等[2]研究证明小金丸通过HIF、VEGF等相关信号通路作用于AR、MMP-9等主要靶点蛋白,改善肿瘤微环境缺氧,抑制血管生成,降低细胞侵袭性和细胞活力。赖琦等[14]通过网络药理学发现白术附子汤中的核心药对“白术-附子”通过AKT1、IL6、MAPK3等核心靶点及雌激素信号通路、破骨细胞分化通路、HIF-1信号通路等治疗乳腺癌骨转移。杨争等[15]基于循证医学对比发现,传统中药联合唑来膦酸在改善乳腺癌骨转移病灶、缓解疼痛、提高生活质量、减少不良反应方面优于单用唑来膦酸的效果。目前对乳腺癌骨转移的研究主要是抑制乳腺癌细胞转移、缓解骨转移引起的骨相关事件,较少的目光集中在骨转移形成后新骨形成和骨骼重塑[16]。本研究主要探究体外实验探究黄芪补肾活血汤通过HIF1α-Smad/Runx2/Osterix信号轴抑制乳腺癌骨转移、促进骨骼重塑的作用机制。
4.1 黄芪补肾活血汤通过抑制HIF1α的表达进而抑制乳腺癌的转移
肿瘤内缺氧是转移性癌症的常见表现,缺氧诱导因子(HIF)是缺氧的标志,肿瘤内缺氧可导致HIF-1的激活。HIF-1是由HIF1α和HIF-1β两个亚基组成的异源二聚体,α-亚基是HIF-1的主要活性成分,介导对缺氧的适应性反应。HIF1α与原发性乳腺癌预后不良和化疗耐药性相关,HIF1α过表达会激活血管生成、厌氧糖酵解、侵袭和转移等一系列过程,导致乳腺癌患者肿瘤转移和死亡的风险增加[17]。而骨髓是一种缺氧的微环境,富含生长因子和血管,并且很容易被乳腺癌来源的肿瘤细胞定植。骨基质是生长因子的储存库,以及成骨细胞、破骨细胞、巨噬细胞和T细胞,都分泌细胞因子和趋化因子。骨髓内的低氧水平诱导HIF1α,不仅对恶性肿瘤的转移有影响,还对骨骼发育、重塑有深远的影响[18]。
4.2 黄芪补肾活血汤上调Smad1、Smad5诱导成骨形成
Smad1、Smad5属于由BMP激活的R-Smads蛋白家族,参与BMP所介导的成骨信号通路[19]。在该信号通路中,Smads及其转录因子对成骨诱导至关重要。Smads家族的蛋白质之间相互作用导致转录活性复合物的形成,这些复合物具有调节各种发育和生物过程的潜力[20]。在软骨形成的整个过程中,Smad蛋白在软骨细胞中普遍表达。软骨内骨形成中的大多数BMP信号转导是由典型的Smad1/5通路而不是非典型通路介导的,Smad1、Smad5的缺失导致凝结阶段的软骨形成完全停滞[21]。激活的Smad1/5可以调节目标基因—Runx2[22]。在成骨诱导过程中,Runx2通过直接结合转录激活复合物与Smads一起发挥作用[23]。Smad1/5和Runx2的联合作用已在多种细胞系统中得到广泛研究。Runx2的羧基末端通过与核基质靶向信号(NMTS)重叠的Smad相互作用域(SMID)与R-Smads相互作用[24]。Smad1/5是Runx2的上游调节因子[25],与Runx2共同作用可诱导间充质干细胞中成骨细胞特异性基因表达,从而促进成骨细胞分化[26]。目前研究发现Smad1/5在细胞成骨的各个周期都发挥重要作用,比如骨髓间充质细胞的成骨、增殖等,并与下游的Runx2产生协同作用,从而上调其他成骨关键基因,达到促进骨髓间充质细胞向成骨细胞分化的目[21]。研究表明,Smads在亚核基因座中的定位由Runx2调节激活,亚核结构域中的Smads与Runx2形成共调节复合物以调节基因转录[24]。Smad/Runx2复合物诱导成骨细胞分化[27],并调节成骨细胞中RANKL的表达[20]。考虑到抑制这种转录因子作为调节事件上游的治疗策略的潜力,这有助于治疗机制复杂的骨转移。
4.3 黄芪补肾活血汤上调Runx2表达发挥肿瘤抑制作用并促进新骨形成
Runx2是属于Runx家族的成骨特异性转录因子,在骨髓间充质细胞成骨分化过程中表达相对较早,是成骨过程中最具特异性的基因。Runx2的表达往往标志着成骨分化的开始,通过调控成骨基因的转录来影响成骨细胞的成熟水平[28]。Runx2促进骨髓间充质细胞成骨分化,促进骨骼发育和促进骨再生,但同时也对骨髓间充质细胞的迁移也有一定的影响。Runx2是一种在成骨中起主要作用的转录因子,但也在人类乳腺癌中表达,可以使乳腺癌细胞与骨微环境相互作用[29]。在ER阳性乳腺癌中,Runx2显示出肿瘤抑制特性,这与其在三阴性乳腺癌中的作用相反[30]。在某些细胞中,已知Runx2在乳腺癌期间会被雌激素抑制,否则会作为抗转移因子发挥作用[31]。骨转移细胞释放骨微环境蛋白并由Runx2控制的骨代谢的典型细胞信号传导,在缺氧下的骨转移细胞中可以观察到Runx2下调[32]。根据以往的研究报道,有许多成骨相关基因在骨再生过程中起关键作用,Runx2就是其中之一[33]。Runx2可以促进成骨细胞的增殖和由未连接的间充质细胞组成的凝聚细胞层的骨形成[34],并通过Wnt和转录因子的相互调节发挥多种功能[35]。
4.4 黄芪补肾活血汤下调Osterix表达抑制乳腺癌细胞转移
Osterix(OSX)是一种锌指转录因子,可以通过增加S100A4基因的表达来促进乳腺癌细胞迁移和肿瘤血管生成,这表明Osterix参与了乳腺癌的发生发展,并可能作为乳腺癌治疗的潜在靶点。在转移级联反应的早期和晚期通过上调Osterix蛋白来促进乳腺癌的骨转移。Osterix上调与淋巴结转移有关,对总生存期有负面影响。通过敲低Osterix下调参与侵袭、血管生成和骨溶解的相关蛋白可以抑制乳腺癌的侵袭和溶骨性转移[36]。
目前,针对乳腺癌骨转移的药物和治疗主要集中在抑制乳腺癌细胞的转移和侵袭,关于骨转移后的新骨形成和骨骼重塑等方面仍缺乏针对性的有效药物。本研究通过体外实验探索经典方加减的黄芪补肾活血汤基于HIF1α-Smad/Runx2/Osterix信号轴抑制乳腺癌转移及促进新骨形成、骨骼重塑的潜在机制,论证了补肾活血法治疗肾虚血瘀型乳腺癌骨转移患者的可行性,期望可以为乳腺癌骨转移治疗提供新的治疗靶点和思路,未来将通过动物实验及临床证据进一步证明黄芪补肾活血汤治疗乳腺癌骨转移的确切疗效。
猜你喜欢成骨成骨细胞黄芪Huangqi decoction (黄芪汤) attenuates renal interstitial fibrosis via transforming growth factor-β1/mitogen-activated protein kinase signaling pathways in 5/6 nephrectomy miceJournal of Traditional Chinese Medicine(2022年5期)2022-10-14“补气之王”黄芪,你吃对了吗?今日农业(2022年13期)2022-09-15经典Wnt信号通路与牙周膜干细胞成骨分化口腔医学(2021年10期)2021-12-02黄芪是个宝海峡姐妹(2019年3期)2019-06-18糖尿病大鼠Nfic与成骨相关基因表达的研究中华老年口腔医学杂志(2016年2期)2017-01-15淫羊藿次苷Ⅱ通过p38MAPK调控成骨细胞护骨素表达的体外研究安徽医科大学学报(2016年12期)2017-01-15土家传统药刺老苞总皂苷对2O2诱导的MC3T3-E1成骨细胞损伤改善中国民族医药杂志(2016年6期)2016-05-09液晶/聚氨酯复合基底影响rBMSCs成骨分化的研究中国病理生理杂志(2015年8期)2015-12-2130例Ⅰ型成骨不全患者股骨干骨折术后康复护理天津护理(2015年4期)2015-11-10Bim在激素诱导成骨细胞凋亡中的表达及意义中国医科大学学报(2015年10期)2015-03-01推荐访问:黄芪 活血 补肾