儿童抗结核药物耐药比例法、微孔板法、全基因组测序检测对比研究
来源:优秀文章 发布时间:2023-04-16 点击:
张 颖 任巧丽 赵瑞秋 许红梅 龙晓茹
国家儿童健康与疾病临床医学研究中心 儿童发育疾病研究教育部重点实验室 儿童感染免疫重庆市重点实验室 重庆医科大学附属儿童医院感染科(重庆 400014)
结核病仍是危害人类健康的感染性疾病[1]。据估计,2020年全球有990万人患有结核病,相当于每10 万人口中有127 例,其中11.0%为儿童[2]。2009年至2015 年中国大陆31 个省份上报至国家疾病控制中心的肺结核中,0~14 岁儿童平均每年发病率为十万分之2.4,西部地区发病率最高[3]。儿童肺结核临床表现不典型,病原学阳性率低,易延误诊治[4]。虽然儿童耐多药结核病(multidrug resistant tuberculosis,MDR-TB)通常比成人有更好的治疗效果(儿童治愈率78.0 %,成人为50.0 %),但不足5.0 %的儿童接受了适当的治疗[5]。因此,尽早明确儿童感染结核分枝杆菌(Mycobacterium tuberculosis,MTB)的耐药谱,选择合适治疗方案,提高治疗成功率,有利于儿童结核病的防控。本研究对比比例法、微孔板法和全基因组测序(whole genome sequencing,WGS)3 种方法用于异烟肼(isoniazid,INH)、利福平(rifampicin,RFP)、乙胺丁醇(ethambutol,EMB)和链霉素(streptomycin,SM)4种儿童常用抗结核药物耐药性检测的检验效能。
1.1 材料收集
选取2015 年10 月至2020 年9 月在重庆医科大学附属儿童医院感染科化验室送检标本中分枝杆菌培养阳性的保存菌株87株,使用接种环接种到中性罗氏培养基上置于37 ℃恒温培养箱中培养4~8周,共复苏成功61株。
调取对应患儿的治疗方案与治疗结局,其中治疗结局根据世界卫生组织(WHO)2021年最新的结核病的治疗结局定义分为治疗成功组和治疗失败或死亡组[6]。
1.2 方法
1.2.1 表型药物敏感性试验 对所有成功复苏菌株分别采用比例法和微孔板法(试剂盒均购自珠海银科生物科技有限公司)行表型药物敏感性试验(drug susceptibility test,DST)及菌株鉴定。挑取罗氏固体培养基上培养的分枝杆菌菌落,移到含0.5 %吐温80 的生理盐水试管中,使用细菌超声分散仪(购自广东体必康生物科技有限公司)分散菌落,配成1 mg/mL 的菌悬液。比例法DST:根据《结核病诊断实验室检验规程》[7],比浊后的菌悬液,在样本稀释瓶中利用含0.5 %吐温80的生理盐水,把菌悬液稀释到10-2mg/mL 和10-4mg/mL。采用标准接种环取0.01 mL,将两种浓度菌悬液分别接种到对照培养基及含药的罗氏培养基表面。置于斜面处37 ℃培养,松开盖子,培养24~48 h 后,旋紧盖子继续培养4~6 周。当对照中性罗氏培养基的菌体生长良好后,比较含药培养基和对照培养基上的菌落数,计算耐药百分比,耐药百分比>1 %报告耐药,否则为敏感。含药罗氏培养基的RFP 浓度为40 μg/mL,INH 为0.2 μg/mL,EMB 为2 μg/mL,SM 为4 μg/mL[7]。使用含0.005 mg/mL 的噻吩-2-羧酸肼(thiophene-2-carboxylic acid hydrazine,TCH)和0.5mg/mL的对硝基苯甲酸(P-nitrobenzoic acid,PNB)进行菌株鉴定,区分非结核分支杆菌和牛分枝杆菌。TCH 生长为结核分枝杆菌复合群和非结核分支杆菌,TCH 未生长为牛分枝杆菌;
PNB 生长阳性提示非结核分枝杆菌,PNB 未生长提示结核分枝杆菌复合群和牛分枝杆菌。微孔板法DST:按照产品使用操作说明书,将无菌稀释液全部加入冻干杂菌抑制剂混匀,使用移液器取100 μL加入米氏7H9液体培养基混匀后,取200 μL加入C1、D1阴性对照孔,180 μL分别加入A1、B1阳性对照孔。100 μL浓度为1 mg/mL的菌悬液加入液体培养基中混匀,取200 μL 分别加入含浓度为0.2、0.4、0.8和1.6 μg/mL的含INH孔,0.25、0.5、1 和2 μg/mL 含RFP 孔,2.5、5、10 和20 μg/mL 的含EMB 孔,1、2、4 和8 μg/mL 的含SM 孔。另吸取20 μL 加入A 1 对照孔,制成1/10 阳性对照孔,在A1中吸取20 μL加入B1孔,为1/100阳性对照孔。置37 ℃恒温培养箱中孵育,在10~21 d 根据阳性对照孔菌落直径情况进行结果判读。记录最小抑菌浓度(minimum inhibitory concentration,MIC)值,MIC 定义为与菌落生长半径小于1/10 阳性对照孔的最低浓度。耐药表示MIC 值大于临界浓度,敏感为MIC 小于或等于临界浓度。INH 的临界浓度为0.2 μg/mL,RFP 为1 μg/mL,EMB 为5 μg/mL,SM为2 μg/mL[7]。
1.2.2 全基因组测序(WGS)用接种环从分离培养好的罗氏固体培养基上刮下绿豆大小的菌体,放入含500 μL TE缓冲液的离心管中,置80 ℃水浴30 min灭菌,干冰寄送至上海晶诺生物科技有限公司行基因组提取、质控、建库,使用Illumina 平台行全基因组测序,测序结果和H 37 Rv 标准菌株比对,行变异位点分析。
1.3 统计学分析
采用SPSS 22.0 统计软件进行数据分析。非正态分布的计量资料以中位数(M)和四分位数(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2或Fisher精确概率法检验。以比例法为金标准,计算微孔板法和WGS对INH、RFP、EMB、SM耐药预测的敏感度、特异度、阳性预测值、阴性预测值、符合率及Kappa值;
其中Kappa值0~0.2提示无一致性,0.21~0.39为具有较低的一致性,0.40~0.59 为一致性较弱,0.60~0.79为中等一致性,0.80~0.90为高度一致性,>0.90 为几乎完全一致[8]。以P<0.05 为差异有统计学意义。
2.1 药物敏感性试验结果
经鉴定,61株菌株均为MTB菌株。比例法DST结果中共有48株(78.7%)对4种药物均敏感,13株(21.3%)对至少1 种药物耐药,对4 种药物共同耐药的3株(4.9%);
共有耐INH的11株(18.0%),耐RFP的7株(11.5%),耐EMB的5株(8.2%),耐SM的10株(16.4%),7株(11.5%)为多药耐药(MDR)。见图1A。
微孔板法中,44株(72.1%)对4种药物均敏感。2株(3.3%)EMB的MIC值为5.0 μg/mL,余59株为2.5 μg/mL,均为EMB 敏感菌株。46 株(75.4 %)INH 的MIC 值为0.2 μg/mL,4 株(6.6 %)为1.6 μg/mL,11 株(18.0 %)>1.6 μg/mL,共计15株(24.6 %)为耐INH菌株。50株(82.0 %)RFP的MIC 值为0.3 μg/mL,4 株(6.6 %)为0.5 μg/mL,7 株(11.5 %)>2.0 μg/mL 为耐RFP 菌株。52 株(85.2 %)SM的MIC值为1.0 μg/mL,1株(1.6 %)为4.0 μg/mL,2株(3.3%)为8.0 μg/mL,6株(9.8 %)>8.0 μg/mL,共计耐SM 的菌株为9 株(14.7 %)。见图1B。

图1 比例法、微孔板法和WGS 鉴定61 株结核分枝杆菌耐药结果分布
在WGS中,全敏感菌株46株(75.4 %),对4种药物共同耐药的4 株(6.6 %);
共有耐INH 的13 株(21.3 %),耐RFP的8株(13.1 %),耐EMB的6株(9.8 %),耐SM的9株(14.7 %),见图1C。
2.2 三种方法耐药结果一致性检验
以比例法DST为金标准,微孔板法检验INH耐药性的敏感度、特异度和Kappa 值分别为100 %、92.0 %和0.81,RFP分别为85.7 %、98.2 %和0.84,EMB分别为0 %、10 0%和0.00,SM分别为80.0 %、98.0 %和0.81,符合率为91.8 %~96.7 %;
WGS检验INH 耐药性的敏感度、特异度和Kappa 值分别为90.9 %、94.0 %和0.79,RFP的分别为100.0 %、98.2 %和0.92,EMB的分别为60.0 %、94.6 %和0.50,SM的分别为80.0 %、98.0 %和0.81,符合率为91.8 %~98.4 %。见表1。

表1 微孔板法和WGS对四种一线抗结核药物耐药性检测的诊断价值分析
2.3 抗结核药物耐药相关基因变异位点在耐药和敏感菌株间分布
比例法的11 株INH 耐药菌株中,有1 株包含2个INH耐药位点,fabG1-15C>T和inhAIle194Thr。katG基因Ser 140 Asn 变异位点仅分布在ING 敏感的菌株,而Ser 315 Thr 在耐药和敏感菌株中分别有9 和2 株,分布差异有统计学意义(P<0.01)。在15株MIC 值≥1.6 μg/mL 的菌株中,有13 株经WGS发现耐INH相关基因变异,仅katGSer315Thr在两种不同MIC 值菌株间的分布差异存在统计学意义(P<0.01)。见表2。

表2 INH耐药相关基因变异位点在比例法和微孔板法中鉴定为不同耐药性菌株分布[n (%)]
7 株经比例法DST 鉴定为RFP 的耐药菌株中,经WGS 鉴定出的5 个rpoB基因中仅His 445 Leu 位于RFP 敏感菌株中,该位点在两组间的分布差异无统计学意义(P>0.05)。在微孔板法MIC 值>2.0 μg/mL的7株菌株中,共有分别存在rpoB基因Ser 450 Leu(n=4)、His 445 Asp(n=1)、His 445 Leu(n=1)和His445Tyr(n=1)4个不同的变异位点。而rpoBHis445Asn存在于MIC为0.5μg/mL的1株菌株中。仅Ser450Leu位点在不同MIC值的菌株中的分布差异有统计学意义(P<0.05)。见表3。

表3 RFP耐药相关基因变异位点在比例法和微孔板法中鉴定为不同耐药性菌株分布[n (%)]
在5株经比例法鉴定为EMB耐药的菌株中,有3 株分别包含embB基因Gln 497 Arg、Met 306 Ile 和Met 306 Val 位点,而在敏感菌株中有3 株分别包括Ala356Val、Gly406Ser和Met306Val位点,各位点的分布差异均无统计学意义(P>0.05)。微孔板法中,2株MIC值为5.0 μg/mL的菌株均存在Met306Val位点,不同MIC 值菌株之间差异有统计学意义(P<0.01)。见表4。
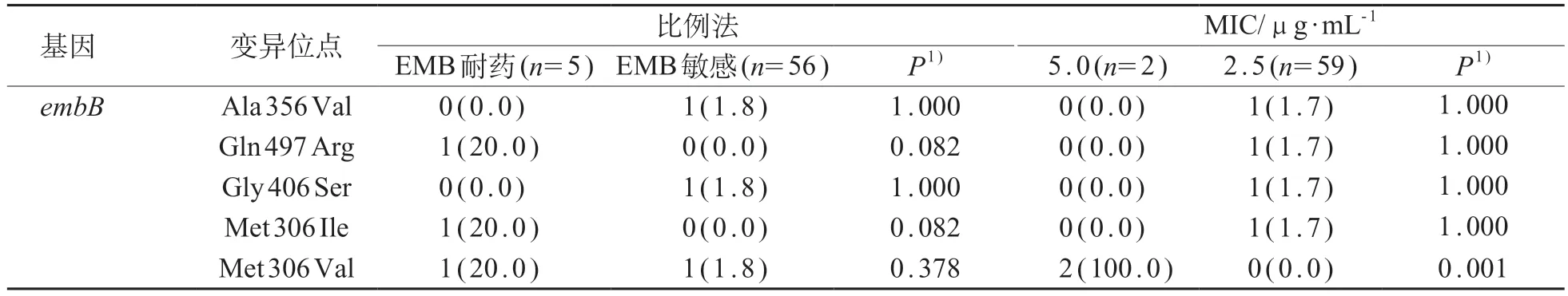
表4 EMB耐药相关基因变异位点在比例法和微孔板法中鉴定为不同耐药性菌株分布[n (%)]
在10 株经比例法鉴定为SM 耐药菌株的8 株分别存在rpsL基因Lys43Arg(n=6)和Lys88Arg(n=1)位点以及rrs基因514a>c位点(n=1);
而在51株SM敏感菌株中,仅有1 株存在rpsL基因Lys 43 Arg 变异位点,该位点在两组中的分布差异有统计学意义(P<0.01)。在8 株MIC ≥8 μg/mL 的菌株中,有rpsLLys43Arg(n=7)和rrs514a>c(n=1)的耐药相关变异位点。在1株MIC为4.0μg/mL的菌株中存在rpsLLys88Arg变异。rpsL基因Lys43Arg和Lys 88 Arg 变异位点在不同MIC 值菌株中的分布差异有统计学意义(P<0.05)。见表5。
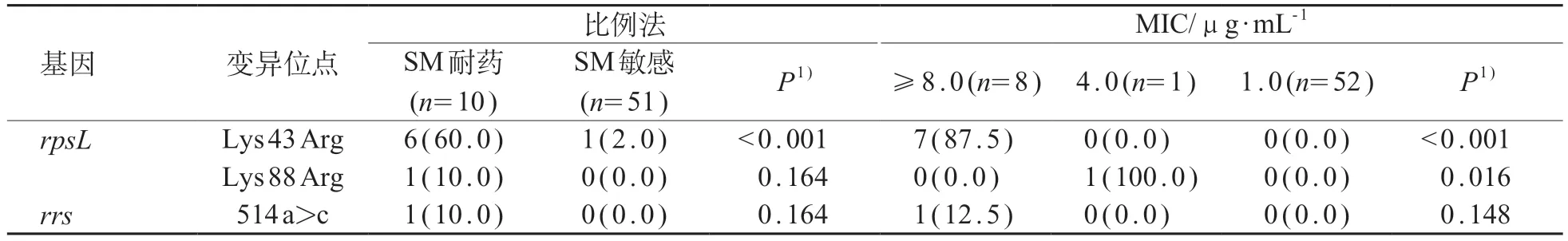
表5 SM耐药相关基因变异位点在比例法和微孔板法中鉴定为不同耐药性菌株分布[n (%)]
2.4 治疗结局与抗结核药物的耐药属性相关性
菌株对应61 例患儿均接受抗结核治疗,其中6例(9.8%)治疗失败或死亡,其余55例(90.2%)治疗成功。治疗成功组和治疗失败或死亡组采用3 种方法鉴定出的4种抗结核药物的耐药属性差异均无统计学意义(P>0.05)。见表6。

表6 结核病患儿61例不同治疗结局的菌株耐药属性分布[n (%)]
目前,MTB耐药性检测仍以比例法和BACTEC分枝杆菌生长指示管960 系统为金标准。而比例法DST 检测时间长达4~8周,BECTEC仪器设备造价较高,且表型DST 由于生物安全问题,均不适用于结核病发病率较低的发展中地区使用。微孔板法DST为改良的液体培养法,其操作便捷,观察结果时间较短,并可明确药物的MIC 值,已逐渐应用于临床。随着分子生物学技术的发展,二代测序技术逐渐成熟且价格明显降低,WGS 可用于MTB 的菌种鉴定、耐药预测、异质性耐药及菌群传播的研究[8],已渐从科研走向临床应用。而本研究为WGS和微孔板法的儿童感染的MTB 耐药性检测的临床应用提供了基础数据。
本研究以比例法DST 为金标准,WGS 检验对INH 和RFP 耐药性诊断的敏感度和特异度处于90.9%~100%,与既往研究结果相近[9]。在一项总结了20项研究的综述中,WGS对RFP耐药性检验的敏感度与特异度分别为98.0 %(95 %CI:93.0 %~98.0 %)和98.0 %(95 %CI:98.0 %~100.0 %),而INH 分别为97.0 %(95 %CI:94.0 %~99.0 %)和93.0 %(95 %CI:91.0 %~96.0 %)[9]。在近期同类研究中,与表型DST 相比,WGS 检测RFP、INH、EMB 和SM 耐药的敏感度与特异度分别为96.7 %和98.6 %、75.5 %和97.1 %、93.1 %和93.7 %、68.6 %和99.6 %[10]。除了EMB外,其余3种药物的检测结果与本研究均较为接近,提示WGS 对检测INH、RFP和SM的耐药性与比例法DST具有高度的一致性。
本研究的微孔板法检验结果,除EMB外,INH、RFP和SM的敏感度与特异度处于80.0%~100.0%,与比例法DST 具有高度的一致性,与同类研究中RFP敏感度和特异度分别为97.1%、100.0%的结果较一致[11]。类似研究中的INH、RFP和SM的敏感度、特异度和Kappa 值分别为93.9%、98.8%和0.94,93.8%、99.6%和0.95,88.7%、100%和0.93[12],与本研究结果相近。因此,微孔板法检测RFP、INH和SM的耐药性均与比例法具有高度一致性。
为探索3 种检测耐药方法存在差异的原因,本研究分析了4 种药物耐药相关基因变异位点在2 种表型DST 鉴定为敏感和耐药的菌株中的分布差异。MDR-TB的出现是在INH耐药的基础上增加了RFP耐药,因此更应关注MTB的INH耐药相关变异[13]。本研究中,比例法DST鉴定为INH敏感的菌株而在微孔板法或WGS 中鉴定为耐药的菌株分别有4 株和3株,分别存在katG基因Ser315Thr和Ser140Asn变异位点。既往已证实katG基因Ser315Thr变异位点与INH 高水平耐药相关[14]。在本研究中,包含该变异位点菌株INH 的MIC 值均≥1.6 μg/mL,再次证实该位点与INH耐药相关。而含Ser140Asn变异位点的菌株MIC 值为1.6 μg/mL,且本研究中变异率较低,在比例法中鉴定为INH 敏感菌株。而在相关研究中发现106 株耐INH 的菌株中仅有1 株存在katGSer140 Asn和Ala139Pro 共同变异[10]。因此,该位点是否与耐药有关仍需更多研究验证。
虽然与其他抗结核药物相比,RFP 耐药相关基因变异不易出现,但由于RFP广泛用于抗结核治疗,耐药率正逐年上升[15]。超过95.0%的RFP 耐药相关变异集中在编码RNA聚合酶的β亚单位的rpoB基因上[16]。多数存在于81 bp 的426~452 位(大肠杆菌编码507~533位)氨基酸的RFP耐药决定区域(rifampicin resistance determining region,RRDR),其中90.0%位于435、445 和450 位点,且均为RFP 高水平耐药相关的基因变异位点[17]。本研究中耐RFP菌株的rpoB基因变异位点集中在445(50.0 %)和450(50.0 %)位点上,均处于RRDR,多数菌株的MIC值大于2.0 μg/mL,进一步证实该位点与高水平RFP耐药相关。相关研究使用基因芯片技术检测MDRTB时,发现耐RFP变异位点集中在445(16.7 %)和450(63.3 %)位点上,且替换氨基酸与本研究一致[16]。因此,考虑在本研究中3 种方法存在差异原因可能与本研究使用的为复苏菌株,表型DST可能表现不稳定有关。
随着新型抗结核药物的出现,SM 已较少用于儿童结核病的治疗。在既往研究中,存在rpsL基因Lys43Arg突变位点的MTB菌株SM的MIC值均大于32 μg/mL,考虑该位点与SM耐药相关[18]。而本研究中,比例法鉴定为SM敏感而WGS鉴定为耐药的1株MTB菌株中仅存在该耐药位点,考虑可能与表型DST表现不稳定有关。
本研究中,WGS 和微孔板法检测EMB 耐药性的结果与比例法DST 一致性较差,考虑与表型DST 中EMB 的错误率较高有关。表型DST 是MTB耐药性检测的金标准,该观点会混淆耐药基因突变位点的识别,尤其是EMB,据报道表型DST 中EMB耐药性检测的错误率较高[19]。而本研究中,微孔板法中未鉴定出EMB 耐药菌株,可能本研究使用耗材的EMB 的MIC 值低于WHO 的界定值。约50.0%~70.0%的EMB 耐药的MTB 分离株存在embB基因306~497 位密码子的基因变异[20]。已证实306、406 和497 位密码子变异可导致低水平和中等水平的EMB耐药[21]。在泰国的一项筛查EMB耐药的MTB临床分离株embB变异分布的研究中发现,306位密码子存在氨基酸错义变异的概率为50.6%,其中含有Met306Val变异的菌株占44.1%[22]。本研究中,在3株经比例法DST鉴定为EMB敏感而WGS耐药的菌株中分别含有Met 306 Val、Gly 406 Ser 和Ala356Val变异位点。仅Ala356Val的功能不详,在EMB耐药菌株中的报道罕见,功能仍待验证。
本研究中菌株对应的61例患儿治疗结局与3种方法鉴定的耐药和敏感菌株分布的相关性分析发现,差异均无统计学意义,提示治疗结局与患儿感染的MTB对4种药物是否耐药无关。有研究发现与MDR-TB不良治疗结局相关的独立风险因素包括高水平莫西沙星耐药、环丝氨酸耐药、导致高水平氟喹诺酮耐药性的变异和ethA变异,与EMB耐药及相关基因变异无关[23]。但本研究结果也可能存在偏倚,与样本量偏少,耐药菌株比例偏小有关。
综上所述,本次研究仍存在样本量偏小,DST使用菌株为复苏菌株而非临床分离株等不足。本研究证实微孔板法和WGS 检测INH、RFP 和SM 耐药的效果与比例法DST 高度一致,可应用于临床。而EMB的耐药性检测可结合比例法DST和WGS结果综合判断。
猜你喜欢微孔耐药性变异长丝鲈溃烂症病原分离鉴定和耐药性分析当代水产(2021年8期)2021-11-04变异危机趣味(数学)(2020年4期)2020-07-27变异支部建设(2020年15期)2020-07-08婴幼儿感染中的耐药菌分布及耐药性分析云南医药(2019年3期)2019-07-25WHO:HIV耐药性危机升级,普及耐药性检测意义重大中国生殖健康(2019年12期)2019-01-07强疏水性PDMS/PVDF微孔膜的制备及其性能研究中国塑料(2016年4期)2016-06-27膜蒸馏用PDMS/PVDF/PTFE三元共混微孔膜制备中国塑料(2015年3期)2015-11-27微孔发泡塑料中成核剂的研究中国塑料(2015年7期)2015-10-14变异的蚊子百科知识(2015年18期)2015-09-10美洲大蠊逆转肝癌多药耐药性的研究中国生化药物杂志(2015年4期)2015-07-07推荐访问:微孔 耐药 基因组