MicroRNA-133b调节FGFR1-ERK1/2-SOX2信号通路对裸鼠肺癌NCI-H1975细胞移植瘤生长的影响*
来源:优秀文章 发布时间:2023-03-24 点击:
褚翔鹏,万人安,王鹏,韩浩,陈小波
[1.日照市人民医院 胸外科,山东日照 276800;
2.云南省肿瘤医院(昆明医科大学第三附属医院) 胸外一科,云南 昆明 650118]
肺癌是指气管、支气管、肺部的恶性肿瘤,其中腺癌占比最高,肺癌发病率、病死率均较高,属于重大公共卫生问题[1-2]。MicroRNA (miRNA)在肿瘤中发挥的作用众所周知,miRNA 可通过影响肿瘤的增殖、凋亡、浸润等参与肿瘤的恶性进展[3-5]。MicroRNA-133b(miR-133b)在包括肺癌在内的多种肿瘤中异常表达,如miR-133b 在胃肠道间质瘤中下调[6];
miR-133b 可抑制人类抗原R,克服前列腺癌细胞的化疗耐药性[7];
miR-133b 可通过靶向PKM2基因促进肺癌A549 干细胞增殖,并降低A549 细胞药物敏感性[8]。前期试验表明,体外试验中miR-133b 在肺癌细胞中异常低表达,有关miR-133b 在肺癌体内研究仍缺乏,因此本研究重点探讨miR-133b 在肺癌裸鼠移植瘤中的抑瘤作用,并初步探讨相关机制。WANG 等[9]研究表明,FGFR1-ERK1/2-SOX2 轴为信号促进FGFR1 促进肺癌细胞增殖、上皮间质转化和转移。前期体外实验中,miR-133b 可通过靶向负调控FGFR1 抑制肺癌NCI-H1975 细胞增殖和转移,生物信息网站分析可知miR-133b 与FGFR1 存在结合位点,FGFR1-ERK1/2-SOX2 在肺癌裸鼠移植瘤中如何表达、且与miR-133b 的关系将是本研究研讨的内容。
1.1 动物、细胞与试剂
SPF 级BALB/C 雄性裸鼠40 只[SCXK(苏)2021-0013]购自常州卡文斯实验动物有限公司。人肺成纤维细胞HLF-α(BFN6021545)、肺癌细胞株NCIH1975(BFN608006102)、A427(BFN60870154)、NGE-1(BFN60808930)、A549(BFN608007142)购自青旗(上海)生物技术发展有限公司。miR-133b mimic、mimic NC 由生工生物工程(上海)股份有限公司构建,FGFR1 抑制剂——AZD4547(S2801)购自上海Selleck 生物科技有限公司,CCK-8 试剂盒(C0037)、TUNEL 试剂盒(C1091)、HE 染色试剂盒(C0105S)购自上海碧云天生物技术有限公司,总RNA 抽提试剂盒(12183016)、逆转录试剂盒(4366597)、总蛋白提取试剂盒(89842)购自赛默飞世尔(上海)科技公司,Ki-67(GTX16667)、Cyclin D1(GTX27958)、VEGF-A(GTX21316)、FGFR1(GRX10646)、p-ERK1/2(GTX635617) 、 ERK1/2 (GTX134462) 、 SOX2(GTX101507)、GAPDH(GTX124502)抗体购自美国GeneTex 公司,山羊抗兔(ab6721)购自美国Abcam公司。
1.2 实验方法
1.2.1 qRT-PCR检测人肺成纤维细胞、肺癌细胞株miR-133b 表达提取人肺成纤维细胞HLF-α、肺癌细胞株NCI-H1975、A427、NGE-1、A549 细胞总RNA,将2 μg RNA 逆转录,cDNA 稀释至50 ng/μL 上样。反应体系:共10 μL,miScript SYBR®Green Mix 5 μL,cDNA(50 ng/μL)1 μL,正反向引物各0.5 μL,ddH2O 3.0 μL。反应条件:95℃预变性5 s,95℃ 变性15 s,60℃退火30 s,72℃延伸15 s,共38 个循环。以U6为对照,2-ΔΔCt法计算目的基因miR-133b mRNA 相对表达量。见表1。

表1 qRT-PCR引物序列
1.2.2 荧光显微镜下观察各组细胞的miR-133b 转染效率体外培养NCI-H1975 细胞,于高糖DMEM培养基(添加10%胎牛血清)中培养细胞,并置于5%二氧化碳培养箱中,设置温度为37℃,每2天更换培养基,待细胞生长至80%左右时进行传代。转染前1 天,消化细胞并调整细胞浓度至2×105个/mL,接种在6 孔板上,细胞贴壁至80%左右进行转染,通过Lipofectamine 3000 试剂盒分别转染mimic NC 和miR-133b mimic 作为mimic NC 组和miR-133b mimic组,另常规培养细胞作为对照组。培养24 h 后,荧光显微镜下观察转染效率,转染效率(%)=阳性细胞数/总细胞数。
1.2.3 miR-133b 过表达调控FGFR1 对肺癌细胞NCI-H1975 细胞增殖、迁移的影响将NCI-H1975细胞分为对照组、mimic NC 组、miR-133b mimic 组、miR-133b mimic+pcDNA3.1 组、miR-133b mimic+pcDNA3.1 FGFR1 组。CCK-8 法检测各组NCI-H1975细胞增殖抑制率。细胞增殖抑制率(%)=(对照组OD 值- 实验组OD 值)/对照组OD 值×100%。Transwell 实验检测NCI-H1975 细胞侵袭、迁移。细胞侵袭:于Transwell 小室中添加Matrigel,37℃固化3 h,加入NCI-H1975 细胞(5×104个),下室中添加RPMI 1640 培养基(含血清,500 μL),培养箱中培养48 h,经多聚甲醛(4%)固定,0.1%结晶紫染色,光学显微镜下观察。细胞迁移:实验步骤除不加入Matrigel 胶外其余步骤均同侵袭试验。
通过Targetscan 网站预测miR-133b 与FGFR1 结合位点。
1.2.4 人肺癌裸鼠移植瘤模型复制并分组取对数生长期细胞消化后,离心弃上清,计数,调整细胞密度,各组小鼠均在后背部接种4×106个细胞,待肿瘤体积变大至100 mm3时,将裸鼠分为对照组、mimic NC 组、miR-133b mimic 组、miR-133b mimic+AZD4547 组,每组10 只。mimic NC 组、miR-133b mimic 组、miR-133b mimic+AZD4547 组采用5 点注射法注射转染试剂(100 μL),对照组以无血清培养基代替,miR-133b mimic+AZD4547 组再额外注射12.5 mg/kg AZD4547[10]。1 次/5 d,共4 次。观察各组小鼠一般状况。
1.2.5 HE 染色观察肿瘤组织变化小鼠最后1 次观测后断头处死,剥离肿瘤,称重并测量肿瘤体积,肿瘤体积=1/2(长径×短径2),将肿瘤置于多聚甲醛中固定,制备石蜡切片。脱蜡水化后,经HE 染色试剂盒进行染色、脱水、透明、封片后,光学显微镜下观察肿瘤组织变化情况。
1.2.6 TUNEL 检测肿瘤细胞凋亡取石蜡切片,TUNEL 细胞凋亡试剂盒进行肿瘤细胞的凋亡检测,光学显微镜下观察,棕黄色染色代表凋亡细胞。凋亡率(%)=(阳性细胞数/总细胞数)×100%。
1.2.7 免疫组织化学法观察小鼠肿瘤组织VEGFA、Cyclin D、Ki-67 表达对石蜡切片进行脱水(梯度法:100%无水乙醇、95%乙醇、90%乙醇、85%乙醇、70%乙醇),抗原修复(枸橼酸钠),H2O2封闭,山羊血清封闭,添加VEGF-A、Cyclin D、Ki-67 兔源一抗(稀释比分别为1∶20、1∶500、1∶500),清洗后添加山羊抗兔二抗,DAB 显色,苏木精复染、分化、反蓝、水化、透明、封片,光学显微镜下观察。
1.2.8 Western blotting 检测FGFR1、p-ERK1/2、ERK1/2、SOX2 蛋白相对表达量称量100 mg 移植瘤组织,眼科剪剪碎,加入预冷裂解液匀浆器内匀浆,转移至离心管内,离心(12 000 r/min,15 min)取上清液,置入-80℃冰箱冷冻保存待用。BCA 试剂盒测定蛋白浓度。SDS-PAGE 凝胶电泳,转膜至PVDF 膜上,封闭,加入稀释一抗FGFR1、p-ERK1/2、ERK1/2、SOX2,稀释比分别为1∶200、1∶200、1∶200、1∶400,以GAPDH(1∶5 000)为内参,封闭,24 h 加山羊抗兔二抗(1∶5 000),封闭,ECL 显色液,分析FGFR1、p-ERK1/2/ERK1/2、SOX2 蛋白相对表达量。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,两组间比较用t检验;
多组间比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2.1 各细胞miR-133b表达的比较
人肺成纤维细胞HLF-α,肺癌细胞株NCIH1975、A427、NGE-1、A549 中miR-133b mRNA 相对表达量比较,差异有统计学意义(P<0.05),与人肺成纤维细胞HLF-α 比较,肺癌细胞株NCI-H1975、A427、NGE-1、A549 中miR-133b mRNA 相对表达量均降低(P<0.05),其中NCI-H1975 细胞中miR-133b mRNA 相对表达量最低,本研究选择NCI-H1975 细胞作为研究细胞。见表2。
表2 各细胞miR-133b表达的比较 (±s)

表2 各细胞miR-133b表达的比较 (±s)
注:†与HLF-α 比较,P <0.05。
组别HLF-α NCI-H1975 A427 NGE-1 A549 F 值P 值miR-133b mRNA 1.02±0.12 0.16±0.02†0.52±0.06†0.74±0.09†0.46±0.05†106.965 0.000
2.2 miR-133b过表达NCI-H1975细胞
对照组、mimic NC 组、miR-133b mimic 组miR-133b mRNA 相对表达量比较,差异有统计学意义(P<0.05),miR-133b mimic 组miR-133b mRNA相对表达量较对照组和mimic NC 组升高(P<0.05)(见表3)。miR-133b mimic 组的miR-133b 转染效率较高,提示构建的转染细胞株成功(见图1)。
表3 各组细胞的miR-133b转染效率比较 (±s)
表3 各组细胞的miR-133b转染效率比较 (±s)
注:①与对照组比较,P <0.05;
②与mimic NC组比较,P <0.05。
组别对照组mimic NC组miR-133b mimic组F 值P 值miR-133b mRNA 1.02±0.12 1.01±0.12 3.17±0.39①②154.033 0.000

图1 荧光显微镜下观察的转染效率
2.3 miR-133b 调控FGFR1 对NCI-H1975 细胞增殖、侵袭、迁移的影响
各组细胞增殖抑制率、侵袭细胞数、迁移细胞数比较,差异有统计学意义(P<0.05),与对照组比较,miR-133b mimic 组增殖抑制率升高(P<0.05),侵袭细胞数、迁移细胞数降低(P<0.05);
与 miR-133b mimic 组 比 较 ,miR-133b mimic+pcDNA3.1 FGFR1 组增殖抑制率降低(P<0.05),侵袭细胞数、迁移细胞数增加(P<0.05)(见表4 和图2)。生信网站预测显示,miR-133b 与FGFR1存在靶向关系(见图3)。
表4 各组细胞增殖抑制率、侵袭细胞数、迁移细胞数的比较 (±s)
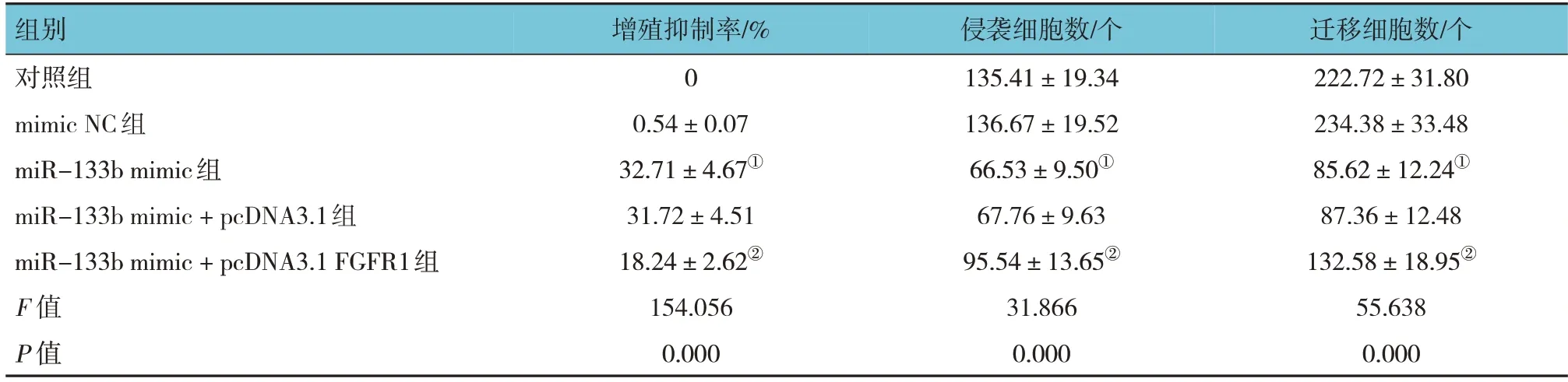
表4 各组细胞增殖抑制率、侵袭细胞数、迁移细胞数的比较 (±s)
注:①与对照组比较,P <0.05;
②与miR-133b mimic组比较,P <0.05。
组别对照组mimic NC组miR-133b mimic组miR-133b mimic + pcDNA3.1组miR-133b mimic + pcDNA3.1 FGFR1组F 值P 值增殖抑制率/%0 0.54±0.07 32.71±4.67①31.72±4.51 18.24±2.62②154.056 0.000侵袭细胞数/个135.41±19.34 136.67±19.52 66.53±9.50①67.76±9.63 95.54±13.65②31.866 0.000迁移细胞数/个222.72±31.80 234.38±33.48 85.62±12.24①87.36±12.48 132.58±18.95②55.638 0.000
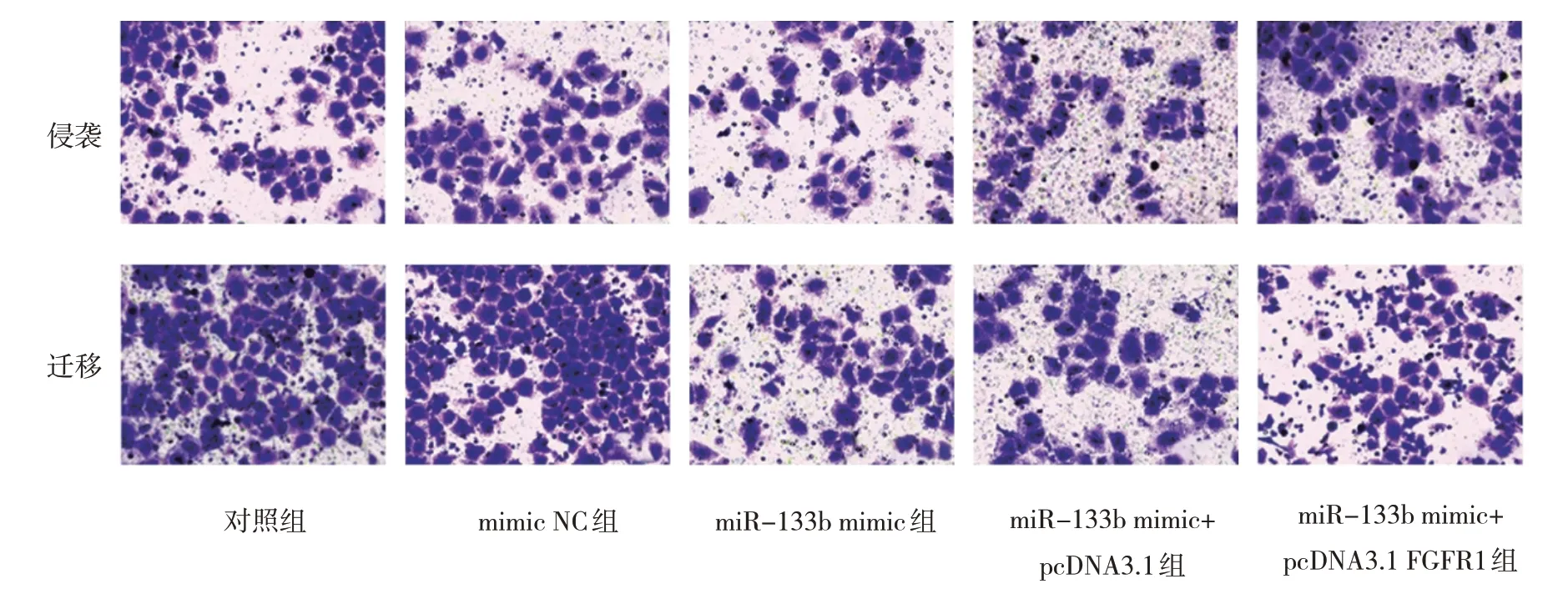
图2 各组细胞侵袭、迁移情况

图3 Targetscan网站预测FGFR1与miR-133b的关系
2.4 各组裸鼠成瘤后情况
裸鼠成瘤后,逐渐萎靡不振,摄食、饮水量均减少,消瘦,皮毛晦暗,双目呆滞,行动缓慢;
转染干预后,miR-133b mimic 组裸鼠症状较mimic NC 组和对照组轻,miR-133b mimic+AZD4547 组症状较miR-133b mimic 组轻。肺癌细胞裸鼠皮下移植瘤均复制成功,成功率100%。
2.5 各组裸鼠移植瘤体积和重量的比较
对照组、mimic NC 组、miR-133b mimic 组、miR-133b mimic+AZD4547 组裸鼠处死时移植瘤重量和体积比较,差异有统计学意义(P<0.05)。miR-133b mimic 组移植瘤重量较对照组降低,体积缩小(P<0.05),miR-133b mimic+AZD4547 组重量移植瘤较miR-133b mimic 组降低,体积缩小(P<0.05)。见表5 和图4。

图4 各组裸鼠处死后肿瘤形态
表5 各组裸鼠处死时移植瘤重量和体积的比较(n =10,±s)

表5 各组裸鼠处死时移植瘤重量和体积的比较(n =10,±s)
注:①与对照组比较,P <0.05;
②与miR-133b mimic 组比较,P <0.05。
组别对照组mimic NC组miR-133b mimic组miR-133b mimic+AZD4547组F 值P 值重量/g 0.52±0.06 0.54±0.07 0.21±0.02①0.11±0.01②126.311 0.000体积/mm3 481.82±60.21 523.61±65.45 182.74±22.84①124.62±13.11②115.676 0.000
2.6 各组肺裸鼠移植瘤肿瘤组织病理变化
裸鼠皮下移植瘤与周围组织分界清晰,容易剥除。HE 染色结果显示,对照组、mimic NC 组肿瘤细胞空泡样变性明显、细胞结构消失、细胞红染,miR-133b mimic 组空泡样变性程度较对照组、mimic NC 组轻,miR-133b mimic+AZD4547 组细胞病变程度较miR-133b mimic 组轻。见图5。

图5 各组肺癌裸鼠移植瘤肿瘤组织染色结果 (HE染色×400)
2.7 各组肺癌裸鼠移植瘤肿瘤组织细胞凋亡情况
各组肺癌裸鼠移植瘤组织细胞凋亡率比较,差异有统计学意义(P<0.05),miR-133b mimic 组肿瘤组织细胞凋亡率较对照组升高(P<0.05);
miR-133b mimic+AZD4547 组较miR-133b mimic 组肿瘤组织细胞凋亡率升高(P<0.05)。见表6 和图6。
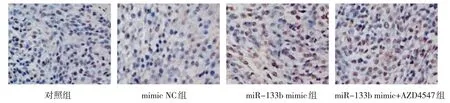
图6 各组肺癌裸鼠移植瘤肿瘤细胞凋亡情况 (TUNEL染色×400)
表6 各组肺癌裸鼠移植瘤肿瘤组织细胞凋亡率比较(n =10,%,±s)

表6 各组肺癌裸鼠移植瘤肿瘤组织细胞凋亡率比较(n =10,%,±s)
注:①与对照组比较,P <0.05;
②与miR-133b mimic组比较,P <0.05。
组别对照组mimic NC组miR-133b mimic组miR-133b mimic+AZD4547组F 值P 值凋亡率18.24±2.28 19.72±2.46 42.76±6.34①51.72±6.46②72.108 0.000
2.8 各组裸鼠肿瘤组织VEGF-A、Cyclin D1、Ki-67蛋白表达
免疫组织化学检测结果显示,VEGF-A 定位于细胞浆,Ki-67、Cyclin D 均定位于细胞核。miR-133b mimic 组Ki-67、Cyclin D、VEGF-A 阳性细胞比例较对照组低,miR-133b mimic+AZD4547 组VEGF-A、Cyclin D、Ki-67 阳性细胞比例较miR-133b mimic组低。见图7。
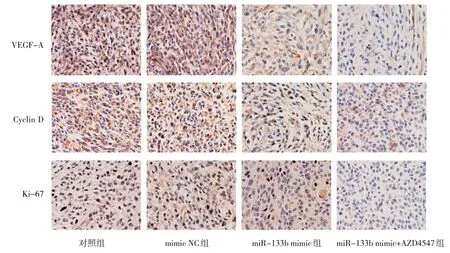
图7 各组裸鼠肿瘤组织VEGF-A、Cyclin D1、Ki-67蛋白表达 (免疫组织化学×400)
2.9 各组裸鼠肿瘤组织FGFR1、p-ERK1/2/ERK1/2、SOX2表达比较
各组裸鼠肿瘤组织FGFR1、p-ERK1/2/ERK1/2、SOX2 蛋白相对表达量比较,差异有统计学意义(P<0.05)。miR-133b mimic 组FGFR1、p-ERK1/2/ERK1/2、SOX2 相对表达量较对照组降低(P<0.05),miR-133b mimic+AZD4547 组FGFR1、 p-ERK1/2/ERK1/2、 SOX2 相对表达量较miR-133b mimic 组降低(P<0.05)。见表7 和图8、9。
表7 各组裸鼠肿瘤组织FGFR1、p-ERK1/2/ERK1/2、SOX2蛋白相对表达量的比较 (n =10,±s)

表7 各组裸鼠肿瘤组织FGFR1、p-ERK1/2/ERK1/2、SOX2蛋白相对表达量的比较 (n =10,±s)
注:①与对照组比较,P <0.05;
②与miR-133b mimic组比较,P <0.05。
组别对照组mimic NC组miR-133b mimic组miR-133b mimic+AZD4547组F 值P 值FGFR1 2.03±0.25 2.01±0.25 0.97±0.12①0.52±0.09②93.671 0.000 p-ERK1/2/ERK1/2 0.86±0.11 0.84±0.10 0.25±0.03①0.13±0.02②151.453 0.000 SOX2 1.38±0.17 1.37±0.17 0.41±0.05①0.11±0.03②440.435 0.000
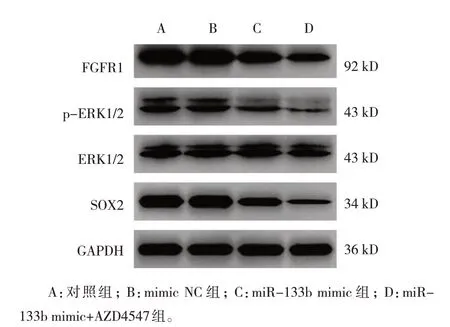
图8 各组裸鼠肿瘤组织各蛋白表达

图9 各组裸鼠肿瘤组织各蛋白相对表达量的比较(n = 10,±s)
肺癌是我国较常见的恶性肿瘤,治疗靶点的研究是永恒课题。随着miRNA 在肿瘤领域的研究不断深入,许多miRNA 被证实在肺癌中发挥作用。miR-133b 在许多恶性肿瘤中发挥抑癌基因作用,miR-133b 过表达可抑制人胃癌AGS 细胞株增殖、迁移与侵袭[14];
miR-133b 可通过CTGF 调控卵巢癌上皮间质转化[15];
miR-133b 通过靶向HOXA9 抑制结直肠癌转移[16];
miR-133b 可充当LncRNA HOXDAS1 与MMP9 的中间桥梁参与非小细胞肺癌的迁移与侵袭[17]。与人肺成纤维细胞HLF-α 比较,肺癌细胞株(NCI-H1975、A427、NGE-1、A549) 中miR-133b 表达均降低,其中NCI-H1975 细胞中表达最低,因此本研究选取NCI-H1975 细胞作为miR-133b 与肺癌体内实验关系的研究细胞株。本研究细胞实验证实,miR-133b 可通过负调控FGFR1 抑制肺癌NCI-H1975 细胞增殖及迁移,因此复制肺癌NCI-H1975 细胞皮下移植瘤,待裸鼠成瘤后,裸鼠逐渐萎靡不振、摄食、饮水量减少,消瘦,皮毛晦暗,双目呆滞,行动缓慢,肿瘤体积、重量呈升高趋势,满足实验需求。裸鼠处死后,裸鼠肿瘤体积与重量均低于对照组与mimic NC 组,证明miR-133b 在体内也可发挥抑癌作用,与体外实验具有一致性[17]。HE 染色、TUNEL 检测结果显示miR-133b mimic 组空泡样变性程度、细胞凋亡率均降低,提示miR-133b 过表达在抑制NCI-H1975裸鼠移植瘤皮下增长、促进凋亡中发挥关键作用。Cyclin D1、Ki67 是细胞增殖相关蛋白,可作为评价细胞增殖状态指标,可在一定程度上反应肺癌细胞的恶性增殖。新生血管为肿瘤生长提供营养与通道,抑制新生血管的生成也是抑癌的主要手段之一,VEGF-A 可促血管生成。本研究免疫组织化学检测结果发现,miR-133b 过表达可降低VEGF-A、Cyclin D1、Ki67 阳性表达,微血管密度降低,即miR-133b 过表达可抑制NCI-H1975 细胞体内增殖与新生血管生成而延缓肿瘤生长速度。
FGFR1 在肺癌中被广泛研究,被认为是调控肺部肿瘤侵袭、迁移的关键靶点,其激活可增强肺部肿瘤干细胞样特性与抗凋亡能力,同时可观察到SOX2 的上调[18]。SOX2 是肿瘤干性标志物,可调控肺癌的肿瘤生长,其激活可促进肿瘤的侵袭转移[19]。实体瘤的致死与肿瘤的侵袭转移关系密切。FGFR1 上调SOX2 的机制与其激活多种下游通路有关,MAPK 是FGFR1 的关键下游[20]。FGFR1/MAPK 在多种肿瘤细胞的生物学进展中属于关键一环。WANG 等[9]研究显示,FGFR1 抑制可通过促使下游ERK1/2 磷酸化进而上调SOX2 表达,促进肺癌细胞增殖。上皮间质转化与转移;
LIN 等[21]研究显示,FGF21 通过FGFR1-ERK1/2-Elk-1 途径抑制HepG2 细胞载脂蛋白的表达;
FANG 等[22]研究显示,SOX2 与FGFR1 升高与小细胞肺癌患者的预后不良相关;
本研究中,miR-133b 过表达可降低p-ERK1/2、SOX2 相对表达量,提示miR-133b 过表达抑体内移植瘤的作用可能是通过FGFR1-ERK1/2-SOX2 轴实现的,但具体机制仍待进一步分析。为此本研究通过瘤内注射FGFR1 抑制剂AZD4547,发现AZD4547 可进一步加大miR-133b 过表达导致的抑瘤作用。因此笔者认为miR-133b 过表达对裸鼠肺癌NCI-H1975 细胞皮下移植瘤生长具有抑制作用,且可能是通过调控FGFR1-ERK1/2-SOX2 信号通路实现的。
综上所述,miR-133b 过表达可能通过抑制FGFR1-ERK1/2-SOX2 轴,对裸鼠肺癌NCI-H1975细胞皮下移植瘤生长具有抑制作用。但本研究也存在一定不足,仅用FGFR1 抑制剂验证了FGFR1在FGFR1-ERK1/2-SOX2 中发挥的作用,下一步将继续尝试使FGFR1 过表达观察小鼠肿瘤的变化,并对其下游机制进行充分验证。
猜你喜欢 细胞株抑制率试剂盒 双酶水解鱼鳞蛋白制备ACE抑制肽的工艺优化研究现代农村科技(2022年1期)2022-01-21血栓弹力图评估PCI后氯吡格雷不敏感患者抗血小板药物的疗效中国循证心血管医学杂志(2021年10期)2021-11-05农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-30试剂盒法制备细胞块的效果及其技术要点天津医科大学学报(2019年6期)2019-08-13日本荚蒾叶片中乙酰胆碱酯酶抑制物的提取工艺优化*台州学院学报(2018年6期)2018-02-26基于CLSI-M43国际标准改良的Mycoview-AST试剂盒检测性能评估现代检验医学杂志(2016年2期)2016-11-14稳定敲低MYH10基因细胞株的建立医学研究杂志(2015年11期)2015-06-10Rab27A和Rab27B在4种不同人肝癌细胞株中的表达中国当代医药(2015年16期)2015-03-01稳定抑制PAK2蛋白表达的HUH—7细胞株的建立中国医药导报(2015年27期)2015-02-28EV71-CA16肠道病毒荧光定量RT-PCR诊断试剂盒的研制现代检验医学杂志(2015年6期)2015-02-06推荐访问:肺癌 通路 移植