lncRNA,SNHG10下调miR-154-5p对非小细胞肺癌细胞的影响
来源:优秀文章 发布时间:2023-03-23 点击:
万冬冬,徐 俊,储赏奇
南通市海门区人民医院:1.肿瘤科;2.呼吸与危重症医学科,江苏南通 226100
肺癌是全球最常见的恶性肿瘤,也是导致癌症死亡的最主要原因,每年导致160万人死亡[1]。非小细胞肺癌(NSCLC)是最常见的肺癌类型,多数患者确诊时,通常处于晚期或已发生转移[2]。紫杉醇(PTX)是NSCLC常用化疗药物,但长期治疗后,部分患者可产生耐药性,严重影响化疗疗效[3]。探讨NSCLC的PTX耐药机制,可为临床治疗提供新的思路,使更多患者从中受益。长链非编码RNA(LncRNA)在药敏、耐药肺癌细胞中异常表达,可能影响化疗耐药性[4]。研究发现,小核仁RNA宿主基因10(SNHG10)是肝癌中的一种致癌LncRNA,其在NSCLC癌组织中表达下调,过表达SNHG10可抑制NSCLC细胞增殖[5]。LncRNA可作为竞争性内源性RNA(ceRNA)与靶mRNA竞争性结合对抗微小RNA(miRNA),发挥海绵活性,抑制miRNA功能,影响肿瘤的发生、发展[6]。了解上述干扰方式,可为疾病发展及治疗提供新思路。miR-154-5p在多种癌症中异常表达,NCBI的GEO数据库显示,miR-154-5p在NSCLC中表达上调[7]。此外,Sratbase数据库在线预测SNHG10与miR-154-5p存在结合位点,二者均在NSCLC中发挥调控作用,但与PTX耐药性的关系尚未可知。因此本研究通过分析SNHG10对NSCLC细胞增殖、迁移及PTX耐药性的影响及可能机制,以期为逆转NSCLC患者PTX耐药提供理论支持。
1.1主要材料及仪器 人NSCLC A549细胞株购自美国ATCC公司;
MTT试剂盒(C0009S)、RIPA裂解液(P0013B)、BCA蛋白浓度测定试剂盒(P0010S)购自上海碧云天生物技术有限公司;
Dual Luciferase试剂盒(E1910)购自美国Promega公司;
多药耐药相关蛋白1(MRP1)、微小染色体维持蛋白(MCMP)、Bcl-2、Bax、β-actin兔单克隆抗体(ab233383、ab218242、ab32124、ab32503、ab213262)购自英国Abcam公司;
TRIzol试剂(15596018)、High Capacity cDNA反转录试剂盒(4368813)、LipofectamineTM2000试剂(11668-027)购自美国Invitrogen公司;
紫杉醇注射液(国药准字H20059962)购自哈药集团有限公司;
pcDNA-SNHG10、pcDNA阴性对照(pcDNA-NC)、miR-154-5p抑制物(anti-miR-154-5p)、抑制物阴性对照(anti-NC)、miR-154-5p类似物、mimics阴性对照(miR-NC)质粒均由自上海吉玛制药技术有限公司提供。
实时荧光定量PCR(qPCR)仪(型号:QuantStudioTM3,美国Applied Biosystems公司),酶标仪(型号:Multiskan GO,美国ThermoFisher公司);
电泳仪、蛋白转膜装置(美国Bio-Rad公司)。
1.2方法
1.2.1细胞培养及分组 在RPMI 1640培养液(含100 mg/mL链霉素、100 U/mL青霉素和10%胎牛血清)中培养A549细胞,37 ℃、5%CO2,细胞密度达85%以上,传代培养。将对数期A549细胞以2×105个/孔接种于6孔板中,LipofectamineTM2000试剂盒分别或同时将pcDNA-SNHG10、pcDNA-NC、anti-miR-154-5p、anti-NC、miR-154-5p mimics与pcDNA-SNHG10、miR-NC与pcDNA-SNHG10质粒转染至A549细胞,记为pcDNA-SNHG10组、pcDNA-NC组、anti-miR-154-5p组、anti-NC组、miR-154-5p mimics+pcDNA-SNHG10组、miR-NC+pcDNA-SNHG10组;
每组6个复孔。
1.2.2双荧光素酶报告实验验证SNHG10与miR-154-5p的靶向关系 生物信息网站Starbase预测,SNHG10与miR-154-5p有结合片段。构建野生型SNHG10-WT质粒,并利用基因定点突变技术构建突变型SNHG10-MUT质粒,由广州市锐博生物科技有限公司设计合成。将miR-154-5p mimics、miR-NC与SNHG10-WT、SNHG10-MUT共转染A549细胞,采用Dual Luciferase试剂盒检测各组A549细胞荧光素酶活性。
1.2.3MTT法检测细胞增殖及PTX敏感性 细胞增殖:各组A549细胞接种至96孔板(2×103个/孔),各孔加200 μL RPMI 1640培养液(含10%胎牛血清),37 ℃、5%CO2培养24 h,加MTT溶液(20 μL/孔),培养4 h,加DMSO(150 μL/孔),震荡5 min,酶标仪测定490 nm处吸光度值(A490),计算细胞增殖抑制率[(对照组A490-实验组A490)/对照组A490×100%]。PTX敏感性:分别在培养基中加入1、5、10、20、40 nmol/L PTX,培养48 h,其余步骤同细胞增殖。计算药物半数抑制浓度(IC50)值。
1.2.4Transwell检测细胞迁移、侵袭 迁移实验:采用无血清RPMI 1640培养液将各组A549细胞密度调整为1×105个/mL。Transwell小室上室加入细胞悬液100 μL,RPMI 1640培养基(含10%胎牛血清)500 μL加入下室中。培养48 h,多聚甲醛固定、结晶紫染色,倒置显微镜下观察、记录穿膜细胞数。
侵袭实验:将Matrigel基质胶(无血清RPMI 1640培养液1∶8稀释)平铺于Transwell小室上室,室温固化30 min,其余步骤与迁移实验相同。
1.2.5qPCR检测SNHG10与miR-154-5p表达 TRIzol法提取A549细胞总RNA,反转录试剂盒合成cDNA。使用合成的cDNA作为模板在荧光定量PCR仪上进行扩增。反应体系(20 μL):9.0 μL SYBR mix、0.5 μL正向引物、0.5 μL反向引物、2.0 μL cDNA模板、8.0 μL RNase dH2O。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,共40个循环;
然后72 ℃延伸1 min。2-ΔΔCt法分别计算SNHG10、miR-154-5p相对于GAPDH、U6的表达水平。引物序列见表1。

表1 引物序列
1.2.6Western blot法检测MRP1、MCMP、Bcl-2、Bax蛋白表达 使用RIPA裂解液提取各组A549细胞总蛋白,BCA法测定蛋白浓度后,取30 μg蛋白上样,进行SDS-PAGE、转膜、封闭,加入β-actin、MRP1、MCMP、Bcl-2、Bax一抗(1∶1 000),4 ℃孵育过夜,次日加羊抗兔IgG二抗(1∶2 000),孵育1 h,ECL显色、拍照,分析各条带灰度值。

2.1过表达SNHG10对A549细胞增殖、迁移、侵袭、PTX敏感性的影响 pcDNA-SNHG10组A549细胞miR-154-5p水平、PTX IC50、迁移细胞数、侵袭细胞数、MRP1、MCMP及Bcl-2蛋白水平低于pcDNA-NC组(P<0.05),SNHG10水平、细胞增殖抑制率及Bax蛋白水平高于pcDNA-NC组(P<0.05)。见表2、图1、2。
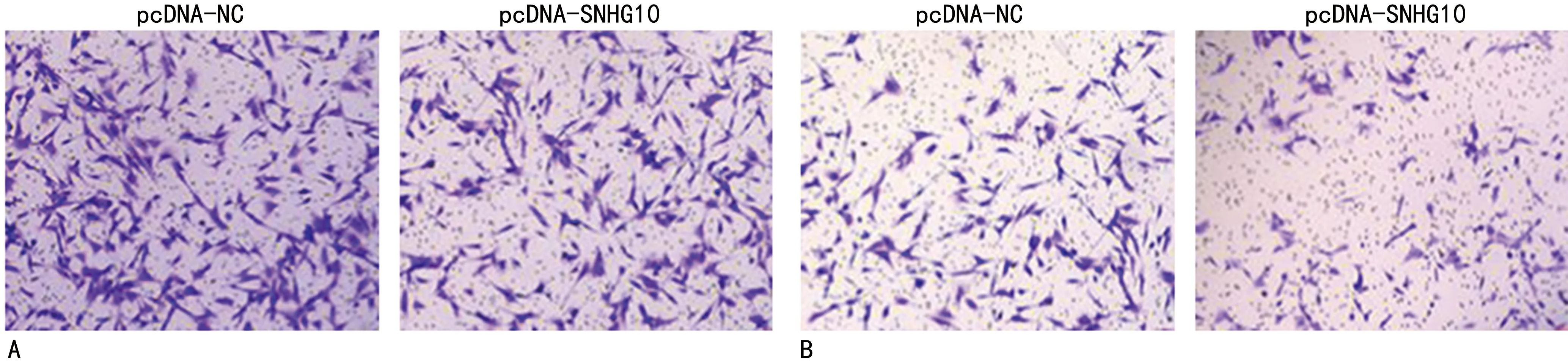
注:A为细胞迁移实验;
B为细胞侵袭实验。

表2 过表达SNHG10对A549细胞miR-154-5p水平、增殖、迁移、侵袭、PTX敏感性的影响

注:*P<0.05;
n=6。
2.2下调miR-154-5p对A549细胞增殖、迁移、侵袭、PTX敏感性的影响 anti-miR-154-5p组A549细胞miR-154-5p水平、PTX IC50值、迁移细胞数、侵袭细胞数、MRP1、MCMP及Bcl-2蛋白水平低于anti-NC组(P<0.05),细胞增殖抑制率及Bax蛋白水平高于anti-NC组(P<0.05)。见表3及图3、4。
2.3SNHG10靶向调控miR-154-5p表达 Starbase网站预测,SNHG10与miR-154-5p存在结合位点,见图5。双荧光素酶实验显示,共转染SNHG10-WT+miR-NC的A549细胞荧光素酶活性较共转染SNHG10-WT+miR-154-5p mimics的A549细胞高(P<0.05),见表4。

注:A为细胞迁移实验;
B为细胞侵袭实验。
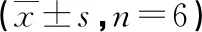
表3 下调miR-154-5p对A549细胞增殖、迁移、侵袭、PTX敏感性的影响

注:*P<0.05;
n=6。

注:WT表示野生型;
MTU表示突变型。
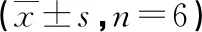
表4 荧光素酶活性检测
2.4过表达miR-154-5p可逆转SNHG10对A549细胞增殖、迁移、侵袭、PTX敏感性的影响 miR-154-5p mimics+pcDNA-SNHG10组A549细胞miR-154-5p水平、PTX IC50、迁移细胞数、侵袭细胞数、MRP1、MCMP及Bcl-2蛋白水平高于miR-NC+pcDNA-SNHG10组(P<0.05),细胞增殖抑制率及Bax蛋白水平低于miR-NC+pcDNA-SNHG10组(P<0.05)。见表5及图6、7。

注:A为细胞迁移实验;
B为细胞侵袭实验。
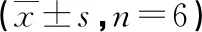
表5 过表达miR-154-5p可逆转SNHG10对A549细胞增殖、迁移、侵袭、PTX敏感性的影响

注:*表示P<0.05。
NSCLC是肺癌的主要亚型,是全球癌症相关死亡的主要原因[8]。NSCLC主要包括肺鳞状细胞癌和肺腺癌两种亚型。近年来,NSCLC靶向治疗及化疗等方面取得了一定的进展,但仍然只有不到15%的NSCLC患者能够存活5年以上[9]。PTX是第一个被确定的微管稳定剂,被认为是过去二十年化疗中最重要的进步,是使用最广泛的抗肿瘤药物之一,在多种癌症中具有广泛的活性,包括乳腺癌、子宫内膜癌、NSCLC、膀胱癌和宫颈癌[10]。临床治疗中PTX是晚期NSCLC的替代疗法,然而,内在的和获得性耐药经常出现在NSCLC治疗过程中,影响疗效[11]。为了提高PTX的化疗效果,迫切需要探索其潜在的作用机制,并制定有效的策略来克服NSCLC对PTX的耐药性。
多项研究表明,LncRNA可在不同癌症的进展中发挥关键作用,并与肿瘤转移及耐药性相关[12]。LI等[13]研究发现,LncRNA NEAT1在NSCLC PTX耐药细胞A549/PTX中显著上调,抑制NEAT1表达可逆转A549/PTX细胞的PTX抗性。YANG等[14]研究发现,LncRNA MALAT1过表达可显著增加NSCLC细胞对顺铂、吉非替尼、阿霉素和PTX等药物的化学抗性,MALAT1可通过靶向miR-197-3p调节NSCLC细胞的化学耐药性。据报道,SNHG10在多种人类癌症作为促癌基因发挥作用,SNHG10能够促进骨肉瘤的细胞增殖和侵袭[15],且在肝细胞癌[16]和胃癌[17]中促进肿瘤发生发展。但LIANG等[5]研究结果则表明,SNHG10在NSCLC中低表达,可能发挥抑癌作用。本研究中,过表达SNHG10后,A549细胞迁移及侵袭细胞数下降,细胞增殖抑制率升高,细胞增殖蛋白MCMP、抗凋亡蛋白Bcl-2水平下降,促凋亡蛋白Bax水平升高,提示过表达SNHG10可抑制细胞增殖、迁移、侵袭,与LIANG[5]结果一致。CAO等[18]研究证实,SNHG10通过海绵化miR-1271-5p上调TRIM66,可能是前列腺癌细胞多西他赛耐药的分子机制。本研究显示,过表达SNHG10可降低A549细胞对PTX的IC50值,耐药蛋白MRP1水平下降,提示过表达SNHG10可提高A549细胞的PTX敏感性。
LncRNA可充当miRNA海绵,从而调节靶向mRNA的稳定性,还可通过抑制miRNA活性参与肿瘤耐药[19]。文献[14]表明,MALAT1可能通过靶向miR-197-3p调节NSCLC细胞的化学耐药性。文献[18]则显示,SNHG10可通过海绵化miR-1271-5p,上调靶基因TRIM66的表达,参与前列腺癌多西他赛耐药过程。为探讨SNHG10在NSCLC细胞PTX耐药性中的可能作用机制,本研究首先通过Starbase网站搜索发现,SNHG10与miR-154-5p存在互补序列,双荧光素酶实验进一步证实,SNHG10可靶向调控miR-154-5p。miR-154-5p位于人类染色体14q32上,参与各种疾病的病理生理学过程。最近的研究表明,miR-154-5p在多种癌症中作为抑制因子发挥作用,miR-154-5p在乳腺癌、结直肠癌、神经胶质瘤、肝细胞癌、骨肉瘤、鼻咽癌下调[20]。本研究中,抑制miR-154-5p表达可降低A549细胞增殖、迁移及侵袭能力,提示miR-154-5p在NSCLC中发挥促癌作用,与其在多数癌症中的作用相反。推测造成这种现象的原因可能与癌症类型以及miR-154-5p下游靶基因不同有关,在后续的研究中将从其下游基因入手进行深入分析。此外,miR-154-5p过表达可增加乳腺癌细胞对阿霉素的治疗敏感性[21]。本研究结果表明,抑制miR-154-5p表达,可降低A549细胞对PTX的IC50值及MRP1水平,表明抑制miR-154-5p可提高A549细胞的PTX敏感性。进一步分析显示,过表达SNHG10可下调miR-154-5p表达,而过表达miR-154-5p可逆转过表达SNHG10对A549细胞IC50值、迁移、侵袭、增殖、MRP1、MCMP、Bcl-2、Bax蛋白的影响,提示SNHG10可通过靶向miR-154-5p提高NSCLC细胞的PTX敏感性。
有报道称,miR-154-5p可通过靶向抑制鼻咽癌中的KIF14抑制细胞侵袭和迁移[22];
在宫颈癌中,miR-154-5p直接靶向CUL2调控癌细胞的增殖、迁移和侵袭[23]。其中,KIF14已被鉴定为多种癌症的候选癌基因,过度表达KIF14的肺肿瘤患者显示出生存率下降的趋势[24];
KIF14是否参与miR-154-5p对NSCLC的调控作用还未可知,在未来的研究中将对此进行深入分析。
综上所述,过表达SNHG10可抑制NSCLC细胞增殖、迁移、侵袭,增加NSCLC细胞对PTX的敏感性,可能通过靶向miR-154-5p发挥作用。
猜你喜欢 荧光素酶耐药性敏感性 长丝鲈溃烂症病原分离鉴定和耐药性分析当代水产(2021年8期)2021-11-04NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20婴幼儿感染中的耐药菌分布及耐药性分析云南医药(2019年3期)2019-07-25WHO:HIV耐药性危机升级,普及耐药性检测意义重大中国生殖健康(2019年12期)2019-01-07钇对Mg-Zn-Y-Zr合金热裂敏感性影响中国有色金属学报(2018年2期)2018-03-26AH70DB钢焊接热影响区组织及其冷裂敏感性焊接(2016年1期)2016-02-27如何培养和提高新闻敏感性新闻传播(2015年8期)2015-07-18美洲大蠊逆转肝癌多药耐药性的研究中国生化药物杂志(2015年4期)2015-07-07推荐访问:细胞 肺癌 下调