一个中国原发性开角型青光眼家系致病基因研究
来源:优秀文章 发布时间:2023-02-28 点击:
颉娟娟,陈 颖,张国伟,崔海悦,郝梦瑶,王劭雯,贾 珍,徐春龙,陆 宏
青光眼是一种以进行性的视觉损害为特征的慢性退行性疾病,是全世界排名第二的主要致盲性眼病。全球40~80岁人群青光眼患病率为3.54%,据估计,到2040年,全球青光眼患者数量将增加到1.118亿人[1]。原发性开角型青光眼(primary open angle glaucoma, POAG)是最常见的青光眼类型,约占所有青光眼病例的(74%),可导致视力损害甚至失明[2],在欧洲和非洲后裔中尤其常见。近年来,我国青光眼的发病率随着近视和代谢性疾病的增加而有所增长[3]。POAG发病隐匿,患者早期通常无明显症状,待到患者觉察到视力下降或者视野缺损来就诊时病情往往已至中晚期。年龄、近视、高眼压、角膜厚度、阳性家族史、代谢性疾病是POAG的危险因素[4]。阳性家族史是青光眼最重要的危险因素之一,研究结果显示,与青光眼患者具有一级亲属关系的人,相对于普通人群,发展为青光眼的风险提高了9.4倍[5]。识别POAG致病基因及突变位点、筛查具有阳性家族史的高危人群,对青光眼的早期预防和治疗有重要意义。在本研究中,我们通过对江苏省南通市一个POAG家族进行基因检测,并对候选致病基因LTBP2基因在POAG致病作用进行了验证及讨论。
1.1对象于2020-01/12在临床工作中回顾并招募了一个江苏省南通市的POAG家系(图1),追踪到5代共26名,参与本研究者13名,由南通大学附属医院眼科青光眼专科医师对所有参与研究家系成员进行表型评估。POAG的诊断标准为:(1)患者的房角开放,具有正常外观;
(2)两眼中至少一眼眼压持续>22mmHg;
(3)有视神经损伤、视野缺损等青光眼特征性表现。排除继发性青光眼;
单纯眼压升高者诊断为高眼压症(ocular hypertension, OHT)。本研究遵循《赫尔辛基宣言》和《人类遗传疾病样本采集指南》的原则。本研究已通过我院伦理委员会审批通过。所有参与者或其监护人均知情同意。
1.2方法对参与者进行全面的眼科检查,包括视力、裂隙灯、眼压、眼底检查、视野检查、视觉电生理检查、光学相干断层扫描(optical coherence tomography, OCT)和角膜厚度。
基因检测及分析:采集所有参与研究家系成员的外周静脉血并提取基因组DNA。对已知青光眼相关致病基因进行靶向捕获测序,排除已报道的致病基因和突变。根据家系遗传图谱,选取7名家庭成员基因组DNA进行全外显子测序,以上测序工作由迈基诺公司完成。平均测序深度不小于200X,覆盖率不低于99.7%,排除低质量测序数据后,测序数据由Burrows-Wheeler Aligner(BWA)软件(http://bio-bwa.sourceforge.net/)与hg19进行比对。使用GATK和SOAPSNP软件查找数据中包含的Indel变异和单核苷酸多态性(SNPs),使用CCDS、人类基因组数据库(NCBI)、dbSNP(http://www.ncbi.nlm.nih.gov/projects/SNP/)、ESP6500 (https://esp.gs.washington.edu/dru)、1000Genome (ftp://ftp.1000genomes.ebi.ac.uk/vol1/ftp)、ExAC_ALL (http://exac.broadinstitute.org/)和蛋白质功能预测软件包括Ployphen_2 (http://genetics.bwh.harvard.edu/pph2/)、Mutation Taster (http://www.mutationtaster.org/) 、GERP++(https://www.Biostars.org/p/207518/)and SIFT (http://sift.bii.a-star.edu.sg/)对SNP和Indel进行注释。经过变异分析,然后根据数据库(1000Genome、ESP6500、ExAC ALL)排除最小等位基因频率(MAF)大于0.02的变异。同义突变、含内含子、UTR区域的变异体也被排除。经过筛选后,将获得的候选突变进行Sanger测序,以确定候选突变与疾病的致病关系。
2.1临床特征该家系诊断为POAG患者的年龄27~58(平均33.8±12.2)岁,最高记录眼压双眼均为46±5.8mmHg,见表1。先证者(Ⅳ-4)是一名35岁女性,27岁时发病。双眼视力OD:0.3, OS:0.15,矫正后无明显提高。眼底检查见双眼视盘苍白,杯盘比(C/D)0.8,双眼视野不同程度受损。另外4名受影响的成员也出现了典型青光眼表现,其中3名患者接受了抗青光眼手术,其中患者Ⅲ-3因术后眼压控制不理想,并出现了视网膜中央静脉阻塞和新生血管性青光眼,曾行多次手术治疗。另外两名受影响者Ⅳ-5和Ⅳ-2均需药物来控制眼压。家系成员的眼底和视野特征见图2。

表1 POAG家系成员临床特征
2.2系谱分析该POAG家系共跨越5代人(图1),参与本研究者13名,有4名成员被诊断为POAG,1名诊断为OHT。其余8名无明显青光眼表现,但其中5名年龄较小(8~14岁)。所有参与者均接受了DNA检测。根据该家系的遗传特征,发现该POAG家系遗传方式符合常染色体显性遗传。

图1 POAG家系系谱图。
2.3基因检测及分析经过靶向捕获测序对已知青光眼致病基因进行筛选,未发现符合要求的基因突变位点。全外显子测序筛选出了与青光眼致病可能相关的基因共18个,见表2,经基因筛选排除另外17个基因后,确定了1个可疑杂合突变LTBP2(c.1197C>A),该突变位于14号染色体。设计引物对LTBP2基因进行聚合酶链式反应进行验证。发现该基因与POAG家系并不共分离,见表3。在未受影响的家庭成员Ⅲ-7、Ⅴ-2基因组中检测到了LTBP2(c.1197C>A)突变,而POAG患者中只有先证者(Ⅳ-4)和先证者父亲(Ⅲ-3)的基因组中存在LTBP2的突变(图3)。由此可见,该突变位点基因并不是该POAG家系的致病基因。需要进一步进行全基因组测序来确定该POAG家系致病基因。
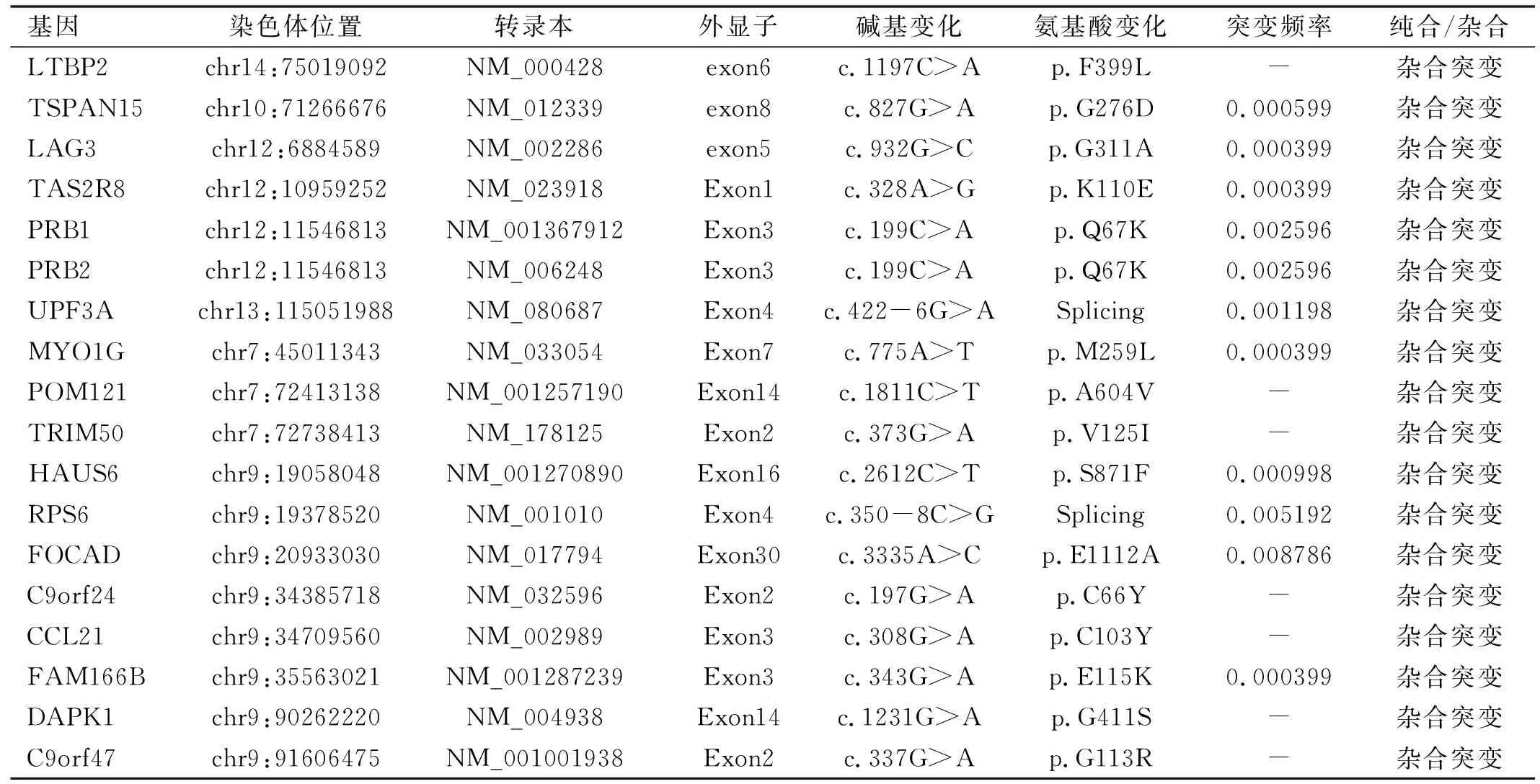
表2 全外显子测序结果
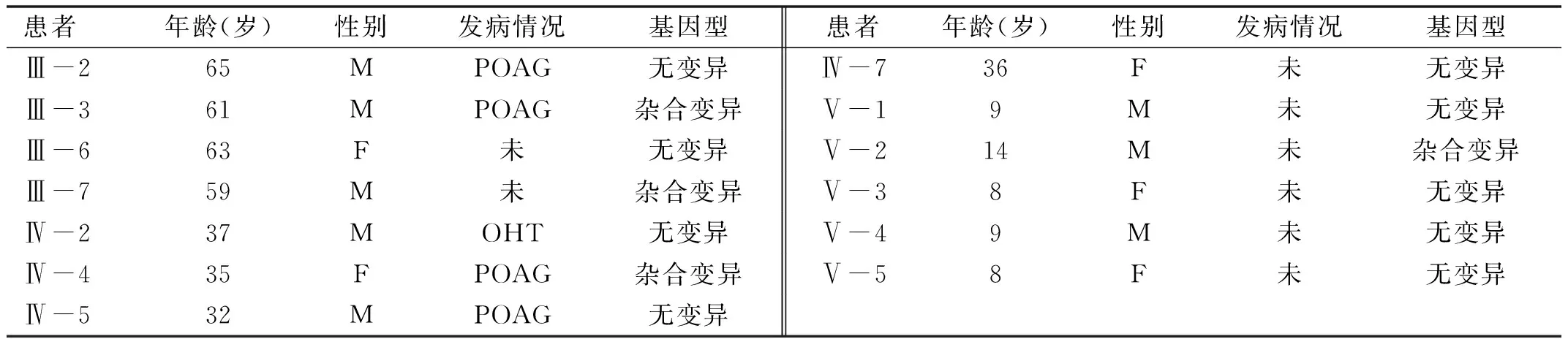
表3 家系成员携带突变情况

图2 家系患者眼部特征。

图3 Sanger测序结果。
在本研究中,我们通过靶向捕获测序和全外显子测序在一个中国POAG家族中发现了位于LTBP2基因上一个错义突变,该突变使基因第1197号位置上的胞嘧啶由腺嘌呤顶替,导致第399号密码子所翻译的氨基酸由苯丙氨酸转为亮氨酸。迄今为止,没有相关研究报道该突变在中国人群POAG中的致病作用。本研究中,我们采用Sanger测序验证了LTBP2基因在POAG家系中的致病作用。结果提示,LTBP2基因突变与该家族POAG的致病无关。
潜在转化生长因子β结合蛋白(LTBPs)是一组多结构域蛋白超家族,在结构和功能上有独特的生物学特性。作为LTBPs家族的成员之一,LTBP2(OMIM 231300)是一个具有36个外显子的大基因,编码一个含有1821个氨基酸的基质蛋白-转化生长因子TGF-β结合蛋白2(TGF-β2)[6]。LTBPs基因结构与纤维蛋白(FBN)结构相似,主要由两种结构域(表皮生长因子样结构域和包含8个半胱氨酸重复序列的结构域)组成。与FBN蛋白相比,LTBP基因组结构更短,在几个序列区域没有二硫键,也与已知区域没有同源性,这使得LTBP蛋白结构更具灵活性[7-8]。TGF-β以潜在复合物的形式存在于含有原纤维的微纤维中,而LTBPs可以结合TGF-β潜在蛋白,并影响TGF-β的活性[9]。LTBPs包含的四种异构体中,LTBP2是唯一不与TGF-βs形成复合物的亚型[10]。因此,LTBP2具有独立于潜在TGF-β的储存和激活的功能。尽管如此,但并没有排除LTBP2与TGF-β的非共价相互作用[11]。LTBP2在弹性组织中表达较多,如肺、心脏、骨骼肌等,在包括小梁网和睫状体在内的各种眼组织中也均有表达而且表达较高,在角膜基质、巩膜和虹膜中表达少量[12]。
LTBP2基因调节TGF-β信号转导的过程可能与青光眼的发病有关。以往研究表明,青光眼患者的房水中TGF-β含量增加[13],而LTBP2可以影响TGF-β细胞因子的活性。另有研究指出,LTBP2通过与LTBP1竞争含有微原纤维的原纤维蛋白上的结合位点而间接影响TGF-β的活性[14]。同时,LTBP2作为一种基质蛋白,还可以影响细胞外基质蛋白(extracellular matrix protein, ECM)的结构[15],显微镜下检测LTBP2突变阳性的POAG患者的成纤维细胞发现ECM的结构被明显破坏[16],而小梁网ECM缺陷会影响房水流出通道,从而引起眼压升高。Suri等[11]研究中指出,LTBP2基因的敲降会影响TGF-β和BMP信号通路,还会影响ECM编码基因的表达和细胞凋亡。
2009年,LTBP2基因首次在巴基斯坦人群中被确定为原发性先天性青光眼(primary congenital glaucoma, PCG)的致病基因[12],开启了LTBP2基因在青光眼中致病中作用的研究历程。此后,LTBP2基因缺陷在伊朗人、斯洛伐克母人、印度人以及美国人中陆续被报道与PCG的发病相关[17-20],是迄今为止已知的引起PCG发病的第二个基因,然而LTBP2突变引起PCG发病的确切机制尚不明确。有趣的是,在一项对CYP1B1阴性的散发PCG患者LTBP2基因筛查的研究中指出,LTBP2基因并不是汉族人PCG的致病基因[21]。LTBP2基因对继发性青光眼,如小球型晶状体和(或)巨角膜、晶状体异位伴/不伴青光眼和Weill-Marchesani综合征3型等也具有致病性[22-24],这些疾病均以常染色体显性遗传的模式影响后代。在对本研究家系成员临床信息收集的过程中我们发现,该家系家庭成员普遍存在身材矮小的特征,成年男性最高身高为168cm, 成年女性最高身高150cm,这与Weill-Marchesani综合征3型结缔组织疾病的症状有重合。在对该家族成员临床表型、遗传方式及LTBP2基因作用进一步研究分析后,我们否定了该家族继发性青光眼的可能。LTBP2基因在PACG、PEX及POAG中致病作用的研究再次为我们认识LTBP2基因提供了线索[16, 25],不同于以往LTBP2在青少年型开角型青光眼(juvenile open angle glaucoma, JOAG)[26]、原发性开角型青光眼3D型[27]家族中的遗传模式,POAG和PEX不被视为隐性遗传性疾病。通过对90例无关的POAG和PEX患者DNA进行LTBP2外显子测序,在5例POAG患者和2例PEX患者的基因组中检测到了LTBP2突变。且1例POAG患者的姐妹基因中也证实了LTBP2(p.Arg495Gln)突变,她们的父亲和祖父在生前均患有青光眼,母亲的基因型正常[16]。由此,LTBP2基因在POAG中的致病作用得到验证。然而,在本研究中,LTBP2 (c.1197C>A,p.Phe399Leu)位点证实并不是该POAG家族的致病基因。尽管如此,我们并不能否认LTBP2突变在POAG散发病例中的致病作用,也不能排除未来的观察将支持特定的基因型-表型相关性。
基因检测技术为遗传性疾病的基因诊断及治疗提供了可能的方法。作为一种先进的基因测序技术,全外显子组测序(whole-exome sequencing,WES)成为了遗传性疾病的主要诊断方法,具有短周期、低成本、高效率的特点,结合Sanger测序可以提高青光眼等遗传性眼病的诊断率,从而为阳性家族史的家庭提供生育指导。然而,人体中的基因组是一个复杂的网络系统,全外显子测序尽管为遗传性疾病的诊断及研究带来重大突破,但是只能检测到全基因组1%的序列,存在测序片段短、准确率低、测序数据量大的不足[28]。因此,在遗传性疾病的研究过程中,需要结合各种技术从基因转录组学、蛋白组学等多个层面分析遗传性疾病的致病机制。
POAG作为一种眼部常见的致盲性疾病,其发病隐匿,尽管目前已经检测到与青光眼致病相关的诸多基因及突变位点,POAG的致病基金研究仍是值得重点关注。LTBP2基因在POAG中作用的现象提示我们,对POAG患者LTBP2基因和其他相关ECM蛋白编码基因突变的筛选,对探索青光眼的发病机制具有现实的意义。
猜你喜欢 家系外显子眼压 外显子跳跃模式中组蛋白修饰的组合模式分析电子科技大学学报(2022年5期)2022-10-29发育性癫痫性脑病75型家系的遗传学分析中华实用诊断与治疗杂志(2022年1期)2022-08-31外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2020年4期)2021-01-18高眼压症及原发性开角型青光眼患者的24 h眼压波动规律中国眼耳鼻喉科杂志(2020年5期)2020-09-30轻压眼球自测眼压恋爱婚姻家庭(2019年15期)2019-01-27红松第一代种子园单亲本子代测定研究吉林林业科技(2018年6期)2018-11-21外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2018年4期)2018-11-06有些头疼是因为眼压高益寿宝典(2018年11期)2018-01-27正常眼压性青光眼24 h眼压测量的临床意义包头医学院学报(2016年2期)2016-06-13一个非综合征型聋家系的分子病因学研究听力学及言语疾病杂志(2015年5期)2015-12-24推荐访问:家系 青光眼 原发性