卵黄高磷蛋白磷酸肽及其钙螯合物在双细胞共培养体系中对成骨细胞分化的促进作用
来源:优秀文章 发布时间:2023-02-15 点击:
周聪聪,赵梦蝶,李松明,马美湖,金永国,黄茜
(华中农业大学食品科学技术学院,蛋品加工技术国家地方联合工程中心,湖北武汉 430070)
骨组织作为人体结构的重要组成部分,对人体健康具有重要意义,而骨质疏松症是目前最常见的骨骼病变。骨质疏松是一种以骨密度减少、骨脆性增加为特征,容易引起骨折的全身性骨病。据报道,年龄在50 岁以上的人群,有近20%的人患有骨质疏松症等骨骼疾病,且发病率一直呈现上升趋势[1]。可以通过增加成骨细胞活性与抑制破骨细胞活性来改善骨质疏松的病理状态[2]。
研究发现,骨髓基质干细胞、成骨细胞和破骨细胞在骨组织的正常生长和代谢中有重要作用,它们会形成一个动态平衡的生物过程,即成骨细胞分泌特征因子调节如:胶原蛋白、碱性磷酸酶、骨钙素和其他骨基质蛋白来诱导骨生成和破骨细胞相关因子调节诱导骨吸收[3-5],在这个过程中,若生骨量少于被吸收骨量,骨总量丢失,则会引起骨质疏松症[6]。这些过程受到雌激素、核因子κB 受体激活配体(RANKL)/骨保护素(OPG)通路、活性氧(ROS)、多种生长因子和其他相关激酶信号转导通路的调控[7]。
卵黄高磷蛋白(PV)是磷酸化程度最高的蛋白质。由于卵生动物的胚胎骨骼在发育过程中所需要的磷元素主要由卵内的卵黄提供,因此卵黄高磷蛋白PV 与卵生动物的骨矿化过程关系密切。PV 经过酶解后形成的一种短肽物质是卵黄高磷蛋白磷酸肽(PPP),PPP 因其多聚阴离子的结构表现出独特的金属螯合、抗氧化、乳化等特性[8]。已有实验证明PPP 可显著提高生长期大鼠的钙吸收[9]。牛奶中的酪蛋白磷酸肽(CPP)作为一种已知的磷酸肽补钙制剂,能够促进婴幼儿对钙元素的吸收,作为一种新型功能性食品添加剂,已被广泛添加到婴幼儿奶粉和保健食品当中[10]。PV 是自然界中磷酸化程度最高的蛋白质,更多的磷酸基团使PPP 具有比CPP 更强的持钙能力[11]。目前,PPP 的研究还处在实验室阶段,有望发展成为一种新型的食品添加剂。
前期实验室已证实PV 和PPP 能促进MC3T3-E1细胞增殖、分化和矿化结节的形成[12]。还研究了PV 对破骨前体细胞RAW264.7 的作用机制,主要是通过下调TRAP 的分泌活性来影响RAW264.7 细胞分化形成破骨细胞[13]。但关于PV 和PPP 在成骨细胞和破骨细胞共培育体系中作用还未见报道。通过测定AKP、TRAP 因子的分泌,以及成骨细胞中RANKL/OPG 通路的RT-PCR 表达量,进一步研究PPP 和PPP-Ca 在共培养体系中对成骨细胞分化的影响。为在细胞水平上更好的模拟体内骨细胞相互作用的微环境,本研究建立了MC3T3-E1-RAW264.7 细胞共培养体系,以便进一步探索PPP和PPP-Ca在共培养体系中对成骨细胞分化的影响。
1.1 材料与试剂
1.1.1 原料
PV 由实验室制得。成骨细胞(MC3T3-E1 cells)和破骨前体细胞(RAW264.7 cells),由武汉普诺赛生命科技有限公司提供。
1.1.2 试剂与药品
医用酒精、KBr、NaOH、CaCl2,国药集团化学试剂有限公司;
青霉素、链霉素、α-DMEM 培养基,美国HYCLONE 公司;
胰蛋白酶(EC 3.4.4.4)、磷酸二氢钾、HEPES、MTT、二甲基亚砜,美国SIGMA 公司;
胎牛血清、0.25%胰酶-EDTA,澳洲GIBCO 公司;
TRAP 染液、TRAP 活性试剂盒、碱性磷酸酶(AKP)试剂盒,南京建成生物有限公司。
1.1.3 仪器与设备
HERAcell 1501 二氧化碳培养箱,德国Thermo Scientific 公司;
IX71 荧光倒置显微镜,日本Olympus公司;
MS104S/01 分析天平,上海梅特勒-托利多仪器有限公司;
iMark 酶标仪,联想生物科技有限公司;
TDL-50B 台式低速离心机,上海安亭科学仪器厂;
Option S7 超纯水系统,英国ELGA 公司;
DL-CJ-2ND超净工作台,哈尔滨东联电子技术开发有限公司;
HH-4数显电子恒温水浴锅,巩义市予华仪器有限责任公司;
EDC-810 RT-PCR 仪,东胜创新生物科技有限公司;
QuantStudio 6 实时荧光定量PCR 仪,ABI;
Nano-100微量分光光度计,杭州奥盛仪器有限公司;
LS-100HD高压灭菌锅,江阴滨江医疗设备有限公司。
1.2 试验方法
1.2.1 溶液配制
细胞冻存液:按照DMEM:胎牛血清:DMSO=6:3:1 的体积比配制,现配现用。
完全培养基(m/m):89%的DMEM,10%的胎牛血清,1%的双抗(100 U/mL 青霉素和100 μg/mL 链霉素)。0.22 μm 无菌滤膜过滤,4 ℃储存。
成骨分化培养基:含有50 μg/mL 的L-抗坏血酸和10 mmol/L 的β-甘油磷酸钠的完全培养基。
1.2.2 PV、PPP、PPP-Ca 的制备
PV 的提取参照文献方法,主要为加入2 倍体积的蒸馏水稀释蛋黄液后,离心分离,收集下层沉淀。用4倍质量体积比的m=10% NaCl 和0.06 mol/L NaOH(pH值11.3~11.5)溶液均质沉淀5 min,再用5 mol/L HCl调节pH 值到3.5~4.0,加入3 倍体积的水离心,收集上清液。超滤脱盐,离心后将上清液冻干得到PV[14]。
前期实验室已通过单因素实验确定了嗜热菌蛋白酶的加酶量2 000 U/g、酶解时间24 h、复合酶解顺序(先胰蛋白酶后嗜热菌蛋白酶复合酶解)时钙螯合率最高并优化了PPP-Ca 的螯合条件(pH 值9.5,肽钙比7:1)[15]。PPP 的制备参照文献方法并加以修改,通过高温中压(HTMP)对PV 溶液进行预处理。配制10 mg/mL 的PV 溶液,调节pH 值6.5 后利用高压灭菌设备对PV 进行HTMP 处理,HTMP 预处理的条件为:温度121 ℃、压力0.1 MPa、时间30 min[16]。选择胰蛋白酶和嗜热菌蛋白酶复合酶解制备PPP,按照酶与底物比为1:50(m/m)加入胰蛋白酶,调节pH 值8.0,在37 ℃下酶解8 h。随后样品在100 ℃下水浴灭酶10 min。灭酶后再用嗜热菌蛋白酶对PV 进行酶解,按照酶与蛋白比为2 000 U/g 加入胰蛋白酶,调节pH 值6.8,在68 ℃下酶解24 h。进一步在100 ℃下水浴灭酶10 min 后冻干得到PPP。
将冻干后得到的PPP 溶于去离子水,配制成10 mg/mL 的溶液,以多肽与钙质量比7:1 的比例加入0.1 mol/L CaCl2混匀,调节pH值9.5,室温下反应30 min得到PPP-Ca。
1.2.3 细胞培养
对MC3T3-E1,加入m=0.25%胰酶37 ℃消化3 min,用完全培养基终止消化;
对RAW264.7,加入完全培养基,用细胞刮刀将贴壁的RAW264.7 细胞刮下,后续两种细胞分别按照1:2 比例分瓶,补加3 mL 完全培养基,于37 ℃ CO2培养箱中培养。细胞复苏后培养3~5 代,此时细胞活力上升,处于生长对数期,可进行实验操作。
1.2.4 MTT 法测细胞毒性
试验分为四组:①空白组:培养液+MTT 溶液;
②对照组:培养液+MTT 溶液+细胞;
③给药组1:PPP(1、2、4、8 mg/mL)+培养液+MTT 溶液+细胞;
④给药组2:PPP-Ca(1、2、4、8 mg/mL)+培养液+MTT 溶液+细胞。
取对数生长期的MC3T3-E1 和RAW264.7 细胞,以每毫升3×104~5×104个的细胞悬浊液100 μL 放入96孔培养板中,放置在37 ℃,5% CO2,湿度90%的培养箱中培育24 h,细胞贴壁后换液,分别加入含有不同质量浓度的样品的培养基100 μL(添加样品前经0.22 μm 滤膜过滤)。培养24 h 结束后,吸弃旧培养基,每孔加入含有0.5 mg/mL 的MTT 的无血清培养液MEM 200 μL,继续培养4 h 后,尽可能的吸去上清液,每孔加入150 μL DMSO,室温下在摇床上震荡10 min,充分混匀并溶解蓝紫色的甲臜颗粒。在酶联免疫检测仪上选择570 nm 波长,测定各孔吸光度值。实验重复3 次,取平均值。按以下公式计算细胞增殖率(B,%):

式中:
As——实验组吸光度值;
Ac——对照组吸光度值;
Ab——空白组吸光度值。
1.2.5 MC3T3-E1 与RAW264.7 共培养的建立
用含成骨诱导剂(抗坏血酸50 μg/mL、β-甘油磷酸钠10 mmol/L)以及m=10%胎牛血清、m=1%青霉素和m=1%链霉素的DMEM 培养基培养,置于37 ℃含体积分数5% CO2的培养箱中。隔天换液1 次,待分化为成熟的成骨细胞。
MC3T3-E1 细胞与RAW264.7 细胞以1:1(成骨细胞的种植密度为每毫升5×104个,破骨细胞为每毫升5×104个)和2:1(成骨细胞的种植密度为每毫升1×105个,破骨细胞为每毫升5×104个)的比例共同接种于6孔板。置于37 ℃含5% CO2的培养箱中。成骨细胞分泌的RANKL 因子能促使RAW264.7 单核巨噬细胞向多核的破骨细胞分化,培养7 d,对破骨细胞进行鉴定。
1.2.6 破骨细胞的鉴定
按照TRAP 染色试剂盒说明书进行染色,将细胞用PBS 缓冲液冲洗后晾干,TRAP 固定液4 ℃固定30 s~3 min,水洗,放置3 min,加入TRAP 孵育液,置于37 ℃温箱,避光侵染45~60 min,水洗。苏木素复染3 min,水洗,晾干,镜下观察。TRAP 能够将破骨细胞的细胞质染为酒红色,鉴定为破骨细胞。
1.2.7 抗酒石酸酸性磷酸酶(TRAP)活性测定
接种后,每2 d 更换新鲜培养基一次并添加不同浓度的PPP 和PPP-Ca,共培养7 d 后,收集细胞培养液,1 000 r/min 离心10 min,去除细胞沉淀后,进行抗酒石酸酸性磷酸酶活性检测。按照试剂盒说明书操作,依次加入检测缓冲液、显色底物和培养基上清,充分混匀后37 ℃下反应30 min,取出加入终止液终止其反应,于530 nm 处,光径1 cm,测定其吸光度。

式中:
u——TRAP 活力,U/L;
ε——呈色物微摩尔消光系数,为12.8×10-3L·μmol-1·cm-1;
l——比色光径,cm;
t——反应时间,s;
V0——反应液总体积,L;
V1——取样量,L;
OD1——测定OD值;
OD0——对照OD值。
1.2.8 碱性磷酸酶(Alkaline Phosphatase,AKP)活性检测
选择共培养7 d 后,收集细胞培养液上清,1 000 r/min 离心10 min 去除细胞沉淀后,进行AKP 活性检测。按照AKP 活性试剂盒说明书操作,依次加入检测缓冲液、显色底物和培养基上清,充分混匀后37 ℃下孵育30 min,取出加入终止液终止其反应,于405 nm处测定其吸光度。
1.2.9 MC3T3-E1 成骨细胞和RAW264.7 巨噬细胞共培养系统的蛋白基因RT-PCR
首先通过Trizol 法提取RNA,在细胞样品中加入1 mL Trizol 试剂,用枪吹打混匀,移至无RNase 的1.5 mL EP 管中,裂解10 min。按照试剂盒说明书提取总RNA 后,放于-80 ℃冰箱内保存以备用。接着RT逆转录成cDNA,最后实时荧光定量PCR 检测。基因检测使用引物序列如表1 所示。

表1 引物序列表Table 1 Primer sequence
1.2.10 数据处理
所有试验数据采用SPSS Statistics 软件进行单因素方差分析,采用邓肯分析法进行差异性分析,p<0.05为差异显著。使用Origin 软件作图。
2.1 细胞毒性试验
从图1 可知,MC3T3-E1 细胞(a)在经过PPP 处理24 h 后,细胞活性分别为95.53%、95.25%、94.79%、92.93%,经过PPP-Ca 处理后,细胞活性分别为94.49%、93.11%、93.00%、92.68%;
RAW264.7 细胞(b)在经过PPP 处理后,细胞活性分别为95.35%、95.70%、92.88%、92.23%,经过PPP-Ca 处理后,细胞活性分别为96.78%、95.70%、93.10%、92.82%。细胞活性均呈现下降趋势,但两种细胞的细胞活性均高于85%,说明PPP 和PPP-Ca 对MC3T3-E1 细胞和RAW264.7 细胞没有明显的毒性作用,可用于后续试验。


图1 不同质量浓度PPP 和PPP-Ca 对MC3T3-E1(a)细胞和RAW264.7(b)细胞的细胞毒性作用Fig.1 Cytotoxic effects of different concentrations of PPP and PPP-Ca on MC3T3-E1 (a) cells and RAW264.7 cells (b)
2.2 抗酒石酸酸性磷酸酶染色
倒置显微镜观察发现MC3T3-E1 细胞的细胞形态是贴壁的纤维状,而RAW264.7 细胞在未分化前是圆形,分化后形成破骨细胞。进行TRAP 染色可以观察到RAW264.7 细胞分化形成破骨细胞的形态变化。
如图2 所示,MC3T3-E1 细胞和RAW264.7 细胞的共培养体系中,RAW264.7 细胞体积增大,分化形成破骨细胞。这是由于MC3T3-E1 分泌的RANKL 因子可以通过 OPG/RANKL/RANK 通路将信号传递给RAW264.7 细胞,进而调节RAW264.7 细胞的分化,促使RAW264.7 单核的巨噬细胞向多核的破骨细胞分化。介怡琳[17]也发现了类似的现象:TRAP 染色后,细胞的体积变大,有三个以上的细胞核,有棕褐色的颗粒出现在细胞质中。杨兴等[18]也观察到了在共培养体系建立后,RAW264.7 细胞发生融合,体积变大,分化为了破骨细胞。

图2 MC3T3-E1 细胞和RAW264.7 细胞共培养的TRAP 染色Fig.2 TRAP staining of MC3T3-E1 cells and RAW264.7 cells co-cultured
2.3 碱性磷酸酶活性测定
碱性磷酸酶(AKP)是成骨细胞早期分化阶段分泌的标志酶,在分化后期可水解有机磷酸酯释放出游离磷酸盐与钙结合促进骨矿化的形成[19]。成骨细胞AKP 活性检测结果如图3 所示,在单一MC3T3-E1 成骨细胞中,PPP 和PPP-Ca 组的AKP 活性分别为2.07 金氏单位/100 mL 和2.13 金氏单位/100 mL,显著高于对照组的1.89 金氏单位/100 mL,这表明PPP 和PPP-Ca 处理可以促进成骨细胞AKP 的分泌。一方面,PPP 和PPP-Ca 中更多的磷酸基团增强了与MC3T3-E1细胞的相互作用,并通过MC3T3-E1 细胞表面受体介导的方式触发了信号的转化,刺激成骨细胞分化;
另一方面,这可能是因为Ca2+与PPP 表面的磷酸基团结合,并与为MC3T3-E1 细胞发生相互作用,为细胞矿化提供了大量的成核位点,从而加速了MC3T3-E1 细胞的矿化[12]。类似的研究发现,加入0.1、0.3、1.0 mg/mL的卵黄高磷蛋白后,碱性磷酸酶表达增加[20]。在MC3T3-E1 细胞与RAW264.7 细胞(1:1)的共培养体系中,对照组的AKP 活性为2.06 金氏单位/100 mL,经过PPP 和PPP-Ca 处理的AKP 活性上升到2.39 金氏单位/100 mL 和2.79 金氏单位/100 mL。MC3T3-E1 细胞与RAW264.7 细胞(2:1)的共培养体系中,AKP 活性表现出相同的趋势。这说明,PPP 和PPP-Ca 可能通过增加 AKP 的活性,进而诱导共培育体系中MC3T3-E1 细胞分化,并有利于后期的矿化。单一MC3T3-E1 细胞和MC3T3-E1 细胞与RAW264.7 细胞共培养体系之间的AKP 活性没有太大差异,表明在成骨细胞早期分化过程中,破骨前体细胞对成骨细胞并无显著性的影响。

图3 PPP 和PPP-Ca 对MC3T3-E1 细胞和RAW264.7 细胞共培养体系中AKP 活性的影响Fig.3 Effect of PPP and PPP-Ca on AKP activity in MC3T3-E1 cells and RAW264.7 cells co-culture system
2.4 TRAP 活力测定
破骨前体细胞RAW264.7 细胞在形成破骨细胞后会分泌TRAP 酶,因此,可用TRAP 酶活表示破骨细胞活性[21]。图4 表明无论是在单一RAW264.7 细胞中,还是MC3T3-E1 细胞和RAW264.7 细胞的共培养体系中,样品处理组的TRAP 酶活力显著低于对照组,表明PPP 和PPP-Ca,均可显著降低TRAP 的活性。有研究表明,PV 同样可以抑制RAW264.7 的分化,从而使TRAP 酶活降低[13]。
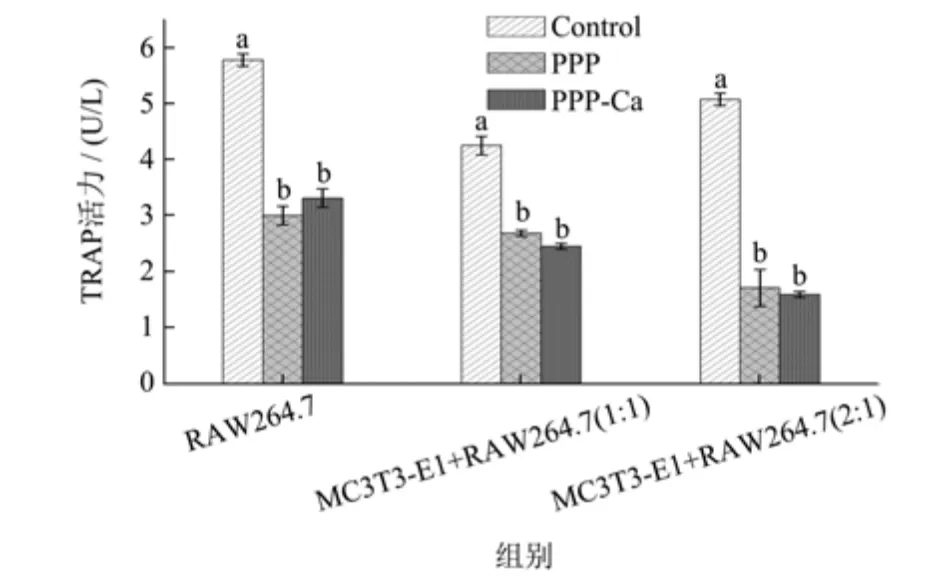
图4 PPP 和PPP-Ca 对MC3T3-E1 细胞和RAW264.7 细胞共培养体系中TRAP 活性的影响Fig.4 Effect of PPP and PPP-Ca on TRAP activity in MC3T3-E1 cells and RAW264.7 cells Co-culture system
在单一RAW264.7 细胞组中,空白组中对照的TRAP 活性为5.78 U/L,添加PPP 和PPP-Ca 的细胞TRAP 活性下降为3.01 U/L 和3.32 U/L,分别降低了48%和43%。在人体骨重建过程中,MC3T3-E1 细胞能分泌破骨细胞因子[6],从而影响破骨细胞的生理活性。结果显示,在MC3T3-E1 细胞与RAW264.7 细胞(1:1)的共培养体系中,对照组的TRAP 值为4.26 U/L,低于单一RAW264.7 细胞的对照组TRAP 活性,表明共培育体系中的MC3T3-E1 细胞会对RAW264.7 细胞分泌TRAP 产生影响,添加了PPP 和PPP-Ca 的共培育组,TRAP 值进一步减低到2.69 U/L和2.46 U/L。MC3T3-E1细胞与RAW264.7 细胞(2:1)的共培养体系中,PPP和PPP-Ca 的加入,使TRAP 活性从5.08 U/L 降低至1.72 U/L 和1.60 U/L,降幅达到66%和69%,比1:1 体系的降幅更大。类似研究发现,在MC3T3-E1 与RAW264.7 的共培养条件下,添加不同浓度的牛乳蛋白(20、100、500 μg/mL)后,共培养体系中的TRAP 活性呈现先上升后下降的变化,20、100、500 μg/mL 的TRAP活性分别为对照组的187.8%、168.9%与25.6%[22]。
2.5 PPP 和PPP-Ca 对共培养体系中MC3T3-E1细胞的OPG和RANKL基因mRNA表达的影响
通过RT-PCR 技术检测在MC3T3-E1 和RAW264.7细胞的共培养体系中成骨细胞骨保护素(OPG)、核因子κB 受体活化因子配体(RANKL)基因mRNA 表达量[23]。图5a 中可看出共培养7 d 后,单一MC3T3-E1细胞组中,PPP 和PPP-Ca 组的OPG mRNA 表达量分别为1.25 和1.39,高于对照组0.92,表明PPP 和PPP-Ca能促进OPG 基因的表达。同样如图5b 所示,在单一MC3T3-E1 培养体系中,PPP 和PPP-Ca 组的RANKL基因表达量为1.23 和1.45,高于对照组1.00。在共培养体系中,OPG 的表达量显著低于单一MC3T3-E1 细胞体系中的,说明RAW264.7 能抑制MC3T3-E1 细胞OPG mRNA 的表达。这是因为在共培养体系中,受到RAW264.7 破骨前体细胞的刺激,成骨细胞分泌RANKL,并通过与破骨前体细胞RAW264.7 表面受体RANK 结合,刺激破骨细胞的分化,从而影响成骨细胞的增殖。因此,在共培养体系中OPG 表达量比单一成骨细胞中低。但相较于共培养的空白对照组,PPP和PPP-Ca 仍提高了共培养体系的OPG 和RANKL mRNA 的表达量,这表明PPP 和PPP-Ca 在单一体系和共培养体系中均能促进OPG 和RANKL 的表达。

图5 a:PPP 和PPP-Ca 对MC3T3-E1 细胞和RAW264.7 细胞共培养体系中成骨细胞中OPG 和RANKL mRNA 的表达量的影响;
b:OPG 与RANKL 的比值;
c:OPG m RNA 的电泳图;
d:RANKL mRNA 的电泳图Fig.5 a: Effects of PPP and PPP-Ca on the expression of OPG and RANKL m RNA in osteoblast in co-culture system of MC3T3-E1 cells and RAW264.7 cells;b: OPG to RANKL ratio;c: Run plastic figure of OPG m RNA;d: Run plastic figure of RANKL m RNA
OPG 能抑制破骨细胞的形成和分化,诱导破骨细胞凋亡[24]。OPG 和RANKL 基因mRNA 的表达水平能反应出对破骨细胞的调控情况,OPG/RANKL 比值高,抑制破骨细胞分化;
OPG/RANKL 比值低,促进破骨细胞分化[25]。此外,共培养体系中,空白组、PPP 和PPP-Ca 处理下OPG 与RANKL 的比值为0.09、0.16、0.18,呈现上升的趋势,表明PPP 和PPP-Ca 处理能够增强对破骨细胞分化的抑制作用。介怡琳的研究表明,卵黄高磷蛋白能通过上调OPG/RANKL 的比例从而对RANKL 和OPG 的表达产生积极影响[17]。Li 等[26]也发现松果菊苷可以通过上调OPG/RANKL 的比值来促进成骨细胞的增殖和分化。
PPP 和PPP-Ca 可以显著提高单一MC3T3-E1 体系中的AKP 活性;
显著降低单一RAW264.7 体系中的TRAP 活性。无论是在单一体系还是共培育体系中,PPP及其钙处理后,成骨细胞OPG、RANKL mRNA 的表达量明显提高,表明磷酸肽及其钙螯合物能促进成骨细胞的分化,抑制破骨细胞的活性。该研究为进一步探索磷酸肽在多细胞模型体系中的作用提供了研究基础,同时为磷酸肽的功能活性开发提供理论依据。后期将进一步研究PPP 和PPP-Ca 在小肠上皮细胞、成骨细胞和破骨细胞等三细胞体系中的对细胞生理活性的影响,明确其作用机制。