具有铁螯合能力的驴骨胶原肽酶解条件优化及微观形态
来源:优秀文章 发布时间:2023-02-08 点击:
毛嘉敏,陈昱瑶,宋 洁,张 燕,王婧贤,李馨雨,范柳萍,成向荣
(江南大学 食品学院,江苏 无锡 214122)
驴产业是我国名优新特产业,正处于发展的重要战略机遇期,逐渐向肉用、药用、保健及生物制品开发等多用途的“活体经济”转变[1]。驴的众多副产品中,驴骨性平、味甘,入脾、肝、肾经,具有滋阴补肾,强筋壮骨的功效[2]。驴骨不仅含有丰富的钙质,还含有骨蛋白、骨多肽、骨多糖,以及磷、镁、锰、锌、铜等骨生长必需的全骨营养素[3]。其中驴骨胶原多肽在食品、化妆品行业都具有较大的应用前景。在目前国内消费市场上,大多数驴骨胶原多肽的开发利用以补充胶原蛋白和钙质为主要方向,制备生产相应的驴骨胶原钙片、驴骨胶原肽粉等[4-5],鲜有研究关注驴骨胶原特征氨基酸对其他微量元素的潜在作用。
铁是人体必需的微量元素之一,影响人体各代谢通路,铁摄入不足或吸收受到抑制时会发生缺铁性贫血(iron deficiency anemia,IDA),出现疲劳、虚弱等临床症状[6-7]。针对缺铁的主要饮食策略是补充与强化[8]。在各类补铁剂中,多肽铁螯合物可通过肽转运体系被机体吸收,因其较高的生物利用度与较低的副作用成为当前研究开发的热点[9]。曹丛丛[10]的研究表明,阿胶在消化过程中产生的活性肽能够与铁离子螯合,形成的螯合物可有效促进铁离子的吸收,具备潜在的补血活性。进一步动物试验研究证明,这一螯合物可以提高铁的生物利用率并改善机体铁稳态,有效改善IDA[11],同时改善IDA小鼠的肠道炎症,缓减IDA引起的肠道菌群失调[12]。另外,研究发现[13],驴骨胶和驴皮胶的胶原蛋白基本相同,同宗同源,但具体氨基酸含量有所差异,驴骨胶总蛋白含量高,为 75.3%,对比驴皮胶为 75.1%,与补血、免疫调节相关的氨基酸(甘氨酸、脯氨酸、赖氨酸、丙氨酸)含量更高。
基于前期研究,我们推测驴骨胶原肽是一种潜在的活性成分,与驴皮胶类似,具有螯合保护亚铁离子、促进亚铁离子吸收的作用。因此,本研究采用酶解法制备驴骨胶原肽,并采用正交法优化酶解条件,探究其与亚铁离子的螯合能力,以期为后续探究驴骨胶原肽的潜在补血活性奠定基础,为开发驴骨胶原肽相关产品提供科学参考。
1.1 材料与试剂
剔肉驴骨段:市场购置;
胰蛋白酶(1∶250)、木瓜蛋白酶(≥800 U/mg)、碱性蛋白酶(≥200 U/mg)、复合蛋白酶(≥120 U/mg)、风味蛋白酶(≥20 U/mg):阿拉丁生物科技有限公司;
浓盐酸、石油醚、氢氧化钠、乙二胺四乙酸二钠、冰醋酸、抗坏血酸、七水合硫酸亚铁(FeSO4·7H2O)、邻菲罗啉、无水乙醇等试剂均为分析纯:国药化学试剂有限公司;
BCA试剂盒:翌圣生物科技(上海)股份有限公司。
1.2 仪器与设备
破骨机:河北德科机械科技有限公司;
KJ-300超声波发生器:无锡市科洁超声电子设备有限公司;
高压灭菌锅:致微(厦门)仪器有限公司;
Centrifuge 5430R台式高速冷冻离心机:德国Eppendorf公司;
HH-3A恒温水浴锅:常州国华电器有限公司;
ST3100 pH计:常州奥豪斯仪器有限公司;
Epoch酶标仪:美国 Biotek公司;
SCIENTZ-10N冷冻干燥机:宁波新芝生物股份有限公司;
冷场发射扫描电子显微镜:日本株式会社日立高新技术公司。
1.3 实验方法
1.3.1 驴骨粉的制备
取解冻后的驴骨段,去除骨髓,并浸入5%(w/v)NaOH溶液中1 h,且骨与溶液之比为1∶2(w/v)。浸泡完毕后,用去离子水反复洗涤3次并除去附着于骨段的肉,待骨段晾干至恒重后称量。将骨段与沸程为60~90 ℃的石油醚以1∶2(w/v)的比例混合,每2 h更换溶剂并去除油脂。油脂去除后,用去离子水洗涤骨段3次并在干燥器中晾至骨段表面无明显水分残留后,使用 0.5 mol/L盐酸溶液以1∶10料液比对骨段进行脱钙处理,每三天更换一次盐酸,共更换三次。将脱脂、脱钙后的骨段使用粉碎机粉碎,放入烘箱中,在37 ℃下烘干至恒重并称量。驴骨粉避光保存于干燥器中。
1.3.2 驴骨蛋白酶解预处理
为了提高酶解效率,需要对蛋白质作变性预处理,该研究采用热处理法。烘干后的驴骨粉与蒸馏水以1∶20的比例进行混合,在没有酶参与的条件下,于121 ℃的高压灭菌锅中,对其进行加热预处理。分别处理0、10、20、30、40 min。随后离心,取上清液使用 BCA法测蛋白浓度,以确定最佳热处理时间。
1.3.3 驴骨酶解液的制备
取适量高温蒸煮过的驴骨液于4 ℃,6 000 r/min下离心20 min,取上清液20 mL于50 mL离心管中,添加相应量的蛋白酶,并调节温度和pH值,酶解相应时间后高温灭酶,冷却至室温后,于4 ℃,4 000 r/min离心20 min得到上清液,用0.45 μm水系微孔滤膜过滤得到滤液,即驴骨酶解液。
1.3.4 驴骨胶原肽铁螯合物的制备
取2 mL驴骨酶解液放入离心管中,空白组取2 mL同等条件下保温的驴骨原液,调节pH至5.5,加入1 mL乙酸钠缓冲溶液,为防止Fe2+被氧化,加入200 μL抗坏血酸溶液(20 mg/mL),然后加入 1 mL FeSO4·7H2O 溶液(100 μg/mL),于恒温振荡器中保持37 ℃螯合30 min。
1.3.5 螯合率的测定
参考曹丛丛[10]邻菲罗琳比色法测亚铁离子含量的方法并稍作改进。
1.3.5.1 标准曲线的绘制 配制 10 μg/mL FeSO4·7H2O 溶液,分别取 0、0.2、0.4、0.8、1.2、1.6、2.0、3.0 mL于10 mL离心管中,加水稀释至6 mL,而后依次加入20 mg/mL抗坏血酸0.2 mL,乙酸钠缓冲液1 mL,0.5%邻菲罗啉0.4 mL,混匀,加水稀释至10 mL。静置反应15 min,吸取200 μL至96孔板中,用酶标仪测定在510 nm波长下的吸光值。以吸光度值作为纵坐标,Fe2+浓度作为横坐标,绘制Fe2+浓度标准曲线,并计算线性回归方程,得到回归方程y=0.102 8x-0.006 3,R²=1。
1.3.5.2 样品铁螯合率的测定 取螯合完成的样品,加入400 μL邻菲罗琳溶液,用去离子水定容至10 mL,混合,静置15 min,测定在510 nm波长下的吸光值。根据标准曲线与样品吸光值计算样品在体系中的浓度。
螯合率计算公式为:

式中:X为螯合率;
C1为空白阿胶体系中的游离亚铁离子浓度;
C2为样品体系中的游离亚铁离子浓度。
1.3.6 最适蛋白酶筛选
取适量高温蒸煮过的驴骨液于4 ℃,6 000 r/min下离心20 min,取上清液20 mL于50 mL离心管中,分别添加等酶活的复合蛋白酶、木瓜蛋白酶、碱性蛋白酶、风味蛋白酶、胰蛋白酶,在各自最佳酶解温度和pH值下,酶解3 h后,制备驴骨胶原肽铁螯合物并测定驴骨肽与亚铁离子螯合率,以螯合率为主要指标,得到酶解效果最好的蛋白酶。各蛋白酶的最适温度、pH见表1。

表1 各蛋白酶的最适温度、pHTable 1 Optimum temperature and pH of each protease
1.3.7 最佳蛋白酶单因素酶解实验
确定最佳蛋白酶后,选取酶底比、酶解pH、酶解温度、酶解时间四个因素对进行考察。
1.3.7.1 酶底比对螯合率的影响 固定反应条件酶解时间3 h、温度50 ℃、pH=7.0,设定酶底比为750、1 000、1 250、1 500、1 750 U/mL,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.7.2 酶解 pH对螯合率的影响 固定反应条件酶解时间3 h、温度50 ℃、酶底比为1 250 U/mL,设定酶解pH为5.0、6.0、7.0、8.0、9.0,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.7.3 酶解温度对螯合率的影响 固定反应条件酶解时间3 h、酶解pH 7.0、酶底比为1 250 U/mL,设定酶解温度为 30、40、50、60、70 ℃,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.7.4 酶解时间对螯合率的影响 固定反应条件酶解温度50 ℃、酶解pH 7.0、酶底比为1 250 U/mL,设定酶解时间为1、2、3、4、5 h,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.8 正交法优化酶解条件
根据单因素实验结果,考虑交互作用的影响,设计四因素三水平的正交实验,选用 L27(313)正交表进行相应的正交实验,计算每次实验驴骨胶原肽和亚铁离子的螯合率,设计如表2。

表2 螯合正交因素水平表Table 2 Chelate orthogonal factor level table
1.3.9 螯合产物形态与微观结构表征
将最优配方得到的螯合产物冷冻干燥后放置阴凉、密闭环境下储存。拍照记录产物形态;
采用冷场发射扫描电子显微镜(FESEM)扫描,分别放大1 000倍、5 000倍观察其微观结构。
1.4 数据分析
实验数据用Graphpad Prism 8.0软件进行数据处理以及作图,正交法优化采用SPSS 26.0,数据为3次实验的平均值。显著性分析采用单因素方差分析,Duncan多重比较检验,以P<0.05表示为差异显著,用小写字母a、b、c、d表示差异。
2.1 驴骨蛋白酶解预处理时间的确定
高温蒸煮可使驴骨中的蛋白溶出,这可能是由于骨蛋白受热变性,内部非极性基团暴露到分子表面,增强了骨蛋白的水溶性[14]。同时,热预处理会导致分子间和分子内的重排,暴露隐藏的裂解位点,增加水解部位,利于酶解[15]。
由图1可知,随着预处理时间的延长,酶解驴骨蛋白的蛋白浓度逐渐增高,在121 ℃下高温加热30 min时蛋白浓度达到最高。超过该时间,蛋白浓度逐渐下降,原因可能为高温加热时间过长使大多数蛋白质发生变性,其分子内部和分子间发生聚合,形成了不溶解的产物。张永秀等[16]以牛骨粉为原料,发现经121 ℃,30 min的加热预处理能显著提高蛋白质水解度和氮溶出率,与本实验结果类似,说明蛋白质在不同变性程度时对水解度影响很大,变性程度过高反而不利于水解。因此确定驴骨蛋白酶解预处理条件为在121 ℃下高温加热30 min。
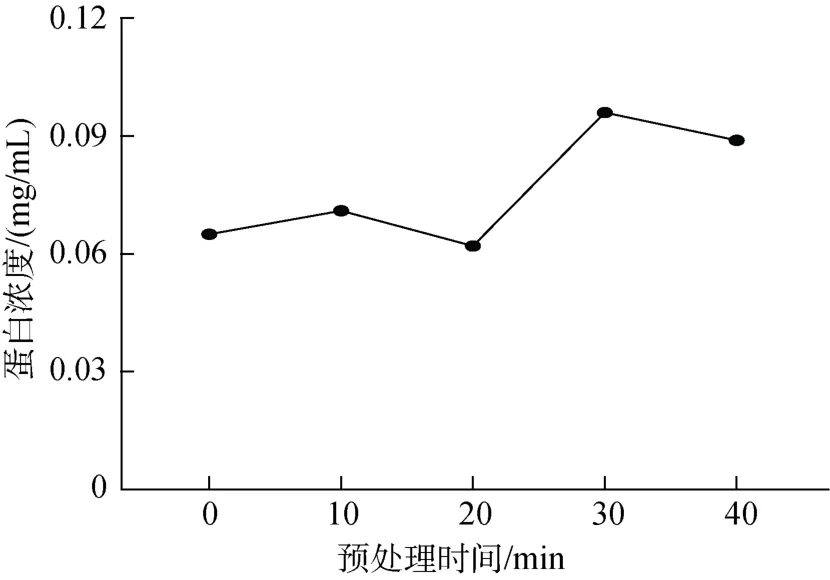
图1 不同预处理时间的蛋白液吸光度和蛋白浓度Fig.1 Absorbance and protein concentration of protein solution at different pretreatment times
2.2 最适蛋白酶筛选
酶解是制备降血压肽、抗氧化肽、免疫肽等生物活性肽的有效方法。酶解可以改善食品的功能特性,而不影响其营养价值[17]。由于酶的不同切割特异性,选择合适的蛋白水解酶至关重要,这会影响蛋白肽的释放量[18]。由图2可知,5种不同的食品级蛋白酶在各自最适反应条件下反应,保持酶活相同,对驴骨蛋白的水解能力不同,酶解后的产物多肽与铁的螯合率也不同。酶解得到的驴骨胶原肽与铁螯合能力为:木瓜蛋白酶>胰蛋白酶>碱性蛋白酶>风味蛋白酶>复合蛋白酶。木瓜蛋白酶为含疏基肽链内切酶,能适当降解结缔组织、胶原蛋白及弹性蛋白,其酶解 pH范围为5~11,在酸性、中性、碱性环境下均能分解蛋白[19],跨度较大,利于设变量梯度。结合酶解效果,选择木瓜蛋白酶进行下一步实验。

图2 不同蛋白酶酶解效果比较Fig.2 Comparison of enzymatic hydrolysis effects of different proteases
2.3 木瓜蛋白酶酶解条件优化
2.3.1 酶底比对螯合率的影响
不同酶底比对铁螯合率的影响如图3所示。由图可知,酶底比在750~1 000 U/mL的范围内,螯合率随着酶添加量的增多几乎不变,无显著差异(P>0.05),在1 250 U/mL时螯合率出现最大值,显著高于其他组螯合率水平(P<0.05),而后螯合率不断下降。这可能是由于酶底比小于1 000 U/mL时,酶与底物接触点较少,水解出的多肽含量低,螯合位点少[20]。随着加酶量不断增加,多肽含量增加,螯合位点增加,但是当加酶量达到饱和之后, 酶会继续水解小分子蛋白质及多肽,蛋白质水解会更加彻底,从而导致多肽含量的降低,螯合位点减少[21],故最适酶底比为1 250 U/mL。

图3 不同酶底比对螯合率的影响Fig.3 Effect of different enzyme substrate ratios on chelation rate
2.3.2 酶解时间对螯合率的影响
不同酶解时间对螯合率的影响如图4所示。在酶解时间为1~3 h的范围内,铁螯合率基本不变,无显著差异(P>0.05),在4 h时铁螯合率最大,显著高于其他组(P<0.05),4 h后铁螯合率逐渐降低。其原因可能在于反应初期,底物质量浓度较高,蛋白酶与底物蛋白有充足的位点相互结合,暴露出较多的酶切位点,有利于蛋白酶进行酶切,从而产生多肽,提供了大量的螯合位点[22]。此外酶切位点的暴露需要时间,但是当酶解时间过长时,多肽进一步被水解成氨基酸,多肽产率降低,螯合位点减少。同时,随着酶解时间的增加,底物特异性位点基本被完全反应,继续反应不会导致额外的活性基团暴露。因此,最适酶解时间选择4 h。

图4 不同酶解时间对螯合率的影响Fig.4 Effect of different enzymolysis time on chelation rate
2.3.3 酶解温度对螯合率的影响
不同酶解温度对铁螯合率的影响如图 5所示。温度在30~40 ℃范围内,铁螯合率随温度升高而显著提高(P<0.05),在40 ℃达到最大值后下降。这是因为在相对较低的温度下,酶的活性较小,分子的动能较小,酶与底物之间的碰撞也较少,反应效率低[23]。随着温度的升高,分子中的非共价键和二硫键逐渐断裂,导致蛋白质的解聚和去折叠,有利于暴露更多酶切位点,从而产生更多具有免疫活性的肽段[15]。而当超过其最适温度后,酶活性降低,导致酶解作用减弱。此时,过高的温度开始引起底物逐渐变性(热聚集),暴露出的酶切位点减少,具有铁螯合能力的肽段减少,螯合能力下降。因此,最适酶解温度选取40 ℃。

图5 酶解温度对螯合率的影响Fig.5 Effect of enzymatic hydrolysis temperature on chelation rate
2.3.4 酶解pH对螯合率的影响
作为生物催化剂,pH对蛋白酶的催化活性影响很大。研究表明,pH主要通过影响底物的解离状态、酶的空间结构、活性中心及与底物结合程度等影响酶解反应。YU等[24]认为,蛋白酶的空间结构改变会引起更多的活性位点暴露;
在一定的pH范围内,底物蛋白中的肽键被破坏会产生一些抗氧化水解物,可以增加DPPH自由基清除活性。
不同酶解pH对铁螯合率的影响如图6所示。蛋白酶作为生物活性物质,具有发挥作用的最适pH范围,过酸和过碱都会使得酶活力下降,致使多肽产率降低,螯合位点减少。在 pH高于实验酶的最适 pH条件下,驴骨液中较多的 OH-可能会抑制水解反应的发生,影响酶对蛋白质的水解效果[25]。pH为 8时,水解效果最好,螯合率最高,因此最适酶解pH选择8。

图6 酶解pH对螯合率的影响Fig.6 Effect of enzymatic hydrolysis pH on chelation rate
2.4 正交实验
根据正交表安排实验,同时留取3列空白,作为误差估计。按正交表实施实验,共27个组合,考察各组合的铁螯合率。对正交实验结果进行了极差和方差分析,见表3和表4。

表3 正交实验极差分析表Table 3 Range analysis table of orthogonal test

表4 正交实验结果方差分析表Table 4 Analysis of variance of orthogonal test results
本实验指标为螯合率,要求越大越好。分析可得,因素A、AC具有显著性(P<0.05),其他因素对指标的影响不显著,可忽略不计,并记入误差。因素影响主次顺序为A>AC>B>D>AB>BC>C,对于高度显著的因素A,直接由K值判断取A1为优水平。其中AC交互项的影响因素比C要大,所以通过二元表获得C的优先水平,如表5所示。

表5 A、C交互作用二元表Table 5 A and C interaction binary table
A1C3螯合率最大,且与A因素选择一致,所以C因素选取C3,根据K值,并结合生产实际,确定优水平组合为A1B1C3D1,由于此组合在正交实验中并没有出现,进行模拟。比较发现螯合率为38.40%,高于表4中各组螯合率,这一表现也优于同为产业副产品的椰子球蛋白多肽(30.67%)[26]、浒苔多糖(19.6%)[27]等,具有一定的开发利用价值。因此得到最优水平为A1B1C3D1,即酶底比1 000 U/mL,时间为3 h,温度为50 ℃,pH 7.0。
2.5 螯合产物形态与微观结构表征
对螯合产物拍照观察。如图7所示,该产物表面疏松干燥,颗粒均匀,呈现棕褐色粉末状结构。

图7 螯合产物外观图Fig.7 Appearance diagram of chelating product
使用冷场发射扫描电子显微镜对螯合产物进行扫描,分别放大1 000倍和5 000倍,观察其微观形态,如图8。可以发现,该产物的微观结构为疏松多孔的片状结构,孔洞大小较为均匀,但片状大小不一,可能是在冷冻干燥过程中产生了断裂。

图8 螯合产物的电镜扫描图(1 000倍、5 000倍)Fig.8 Scanning electron micrographs of chelated products(1 000 times, 5 000 times)
本研究建立了一种酶解制备驴骨胶原肽的方法,通过单因素和正交优化实验,优化了酶解条件,并考察了驴骨胶原肽与亚铁离子的螯合能力。结果发现,热处理可以提高驴骨蛋白肽的产率,121 ℃蒸煮处理30 min,可以得到溶出蛋白含量最高的驴骨蛋白溶液。使用木瓜蛋白酶,在酶底比1 000 U/mL、酶解pH 7.0、酶解温度50 ℃时酶解 3 h,得到与亚铁离子螯合能力最强的驴骨胶原肽,螯合率达到38.40%。对螯合产物进行冷冻干燥,此时产物为疏松的棕褐色粉末状,其微观形态呈现疏松多孔的片状结构。对驴骨胶原肽酶解条件的优化有利于提高酶解效率,使其表现出更高的铁螯合能力和促铁吸收潜力。这为后续研究驴骨胶原肽与亚铁离子的螯合机制以及产物功效评价奠定了基础。
猜你喜欢 亚铁螯合多肽 多肽类药物药代动力学研究进展化工管理(2022年14期)2022-12-02生根提苗就用碧邦有机多肽氮水溶肥今日农业(2022年4期)2022-06-01超声波辅助龙虾壳制备谷氨酸螯合钙的工艺优化中国调味品(2022年5期)2022-05-06再生亚铁络合物脱硝液研究进展能源工程(2022年1期)2022-03-29异化铁还原菌介导的硝酸盐还原亚铁氧化过程土木与环境工程学报(2021年5期)2021-09-06复合氨基酸锰螯合物的制备工艺条件优化农业与技术(2021年1期)2021-01-18响应面法制备小球藻多肽-钙螯合物的制备工艺农产品加工(2019年5期)2019-04-12核酸适配体在多肽研究中的应用分析化学(2017年12期)2017-12-25酸性高锰酸钾溶液滴定碘化亚铁溶液的实验分析中学生数理化·高二版(2016年5期)2016-05-14徐寒梅:创新多肽药物研究与开发科学中国人(2015年16期)2015-02-28推荐访问:肽酶 微观 形态