循环炎症标志物在宫颈肿瘤中的表达水平分析*
来源:优秀文章 发布时间:2023-01-21 点击:
郑佩芹,周海梅,王晓刚
[山东医学高等专科学校附属医院(临沂市老年病医院)1.妇产科;
2.内分泌科,山东 临沂276004]
目前,宫颈癌仍然是世界范围内的主要健康问题。美国的一项调查表面,宫颈癌仍然是20 至39 岁女性癌症死亡的第二大原因,在美国,该年龄组每周有9 人死亡[1-2]。根据世界卫生组织(WHO)提供的数据,全世界每年约有50 万女性患上宫颈癌,占女性所有恶性疾病12%。每两分钟就有一名女性死于宫颈癌,对于这些女性中的230 000 人来说,这种疾病多是晚期。根据2015 年的数据,在欧洲,有12~30/100 000 名女性受到宫颈癌的影响。欠发达国家的频率较高,而由于早期的筛查,大多数高度发达国家宫颈癌发生率正在下降。宫颈癌的发病率在女性恶性疾病中排在第二位,仅次于乳腺癌。99.7%的宫颈癌患者被检出人乳头瘤病毒(HPV)感染。持续性HPV 感染可能会显著增加宫颈上皮内瘤变(CIN)进展为宫颈癌的风险[3]。至此,宫颈癌成为世界上唯一病因明确的妇科恶性肿瘤。
高危人乳头瘤病毒(HR-HPV)被称为宫颈癌的主要危险因素,可能诱发癌前病变。HPV 本身也可以调节宿主免疫反应,从而影响病变从原位癌发展到宫颈癌,宫颈癌患者中观察到HPV 相关病变的免疫反应的下调。尽管如此,单独的HR-HPV 感染不足以诱导宫颈癌的发展。事实上,绝大多数感染HR-HPV 的女性从未发展为宫颈癌,因为足够的免疫反应可以控制感染并防止任何癌前病变的诱导形成[4]。
越来越多的证据表明宿主炎症反应在癌症的发展和进展中起着重要作用。癌症不仅与病变部位的炎症有关,还与整体全身免疫反应有关[5],减少炎症可有效治疗和预防多种癌症类型的进展。为了更好地了解炎症在宫颈癌中的作用,本研究评估了宫颈癌前病变及宫颈癌患者的炎症标志物的血清水平,并与健康对照者进行比较,现报道如下。
1.1 一般资料
选取2020 年9 月至2021 年9 月山东医学高等专科学校附属医院妇产科收治的162 名患者作为研究对象。其中60 名非宫颈疾病患者作为对照组,年龄40~72岁,平均(54.33±4.23)岁;
50 名组织学诊断为宫颈癌前病变患者为癌前病变组,年龄43~71岁,平均(55.22±3.34)岁;
52 名组织学诊断为宫颈癌患者为宫颈癌组,年龄45~70岁,平均(59.91±1.13)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:①术后病理学检查确诊为宫颈癌前病变或宫颈癌[6];
②年龄>18 岁;
③经检查无严重内科或外科疾病。④获得医院伦理委员会的批准,所有受试者均签署书面同意书。排除标准:①患有自身免疫性疾病、活动性或慢性感染、心血管疾病、结缔组织疾病;
②有恶性肿瘤病史;
③怀孕和/或<18 岁的女性;
④之前接受过免疫抑制治疗、放疗和/或化疗的任何受试者。
1.2 HPV 检测和基因分型
宫颈上皮组织样本(来自宫颈癌前病变、宫颈癌患者的活检,对照组患者的液基宫颈样本)用于基因组DNA 分离和HPV 状态确定。使用基于聚合酶链反应(PCR)的多重HPV 基因分型试剂盒检测、区分HPV 24 种基因型。
1.3 血清细胞因子的定量检测
在手术和癌症治疗之前,每个研究患者抽取静脉血样本。每个血样分离血清并储存在-80°C直至用于分析。使用商业ELISA 试剂盒(上海碧云天生物科技有限公司)测定干扰素-β(IFN-β)、干扰素-γ(IFN-γ)、白介素-1β(IL-1β)、白介素-2(IL-2)、白介素-6(IL-6)含量。
1.4 蛋白电泳检测髓样细胞触发受体-1(TREM-1)、肿瘤坏死因-α(TNF-α)水平
宫颈上皮组织样本剪切成细小的碎片,取40 mg 组织,加入500 μL 裂解液,15 000 g 离心5 min,取上清液以备后续实验,计算样品蛋白浓度,配胶、电泳、转膜、孵育一抗二抗、化学发光及凝胶图像分析。
1.5 观察指标
收集患者一般资料包括年龄进行组间分析。使用基于PCR 的多重HPV 基因分型试剂盒(宁波海尔施基因科技有限公司,批号:2021010201178)检测、区分HPV 24 种基因型,统计HPV 阳性率并进行组间比较。使用商业ELISA 试剂盒测定IFN-β、IFN-γ、IL-1β、IL-2、IL-6 含量并分析差异。使用凝胶成像分析系统测定TREM-1、TNF-α蛋白表达水平并进行分析。
1.6 统计学方法
采用SPSS 22.0 统计学软件进行数据分析。计量资料采用均数±标准差()来表示,采用单因素方差分析(One way ANOVA),方差齐时用LSD-t检验,方差不齐时用Dunnett"st检验进行两两比较。计数资料用百分率(%)表示,比较用χ2检验。P<0.05 为有差异有统计学意义。
2.1 各组HPV 感染率水平比较
与对照组比较,宫颈癌前病变组及宫颈癌组HPV 感染率水平明显升高;
宫颈癌组HPV 感染率明显高于宫颈癌前病变组,差异均有统计学意义(F/χ2=60.249,P=0.000),见表1。
表1 各组HPV 感染率水平比较()
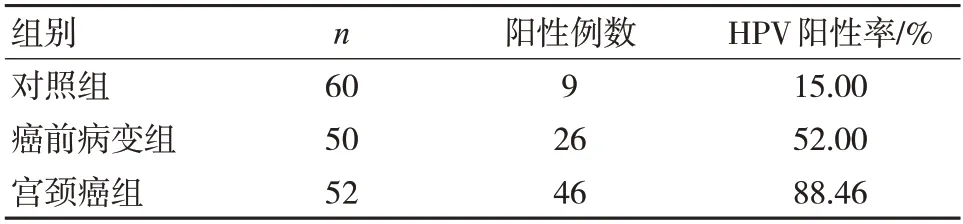
表1 各组HPV 感染率水平比较()
2.2 各组炎症因子数据比较
与对照组比较,宫颈癌前病变组及宫颈癌组IFN-β、IL-1β 水平明显升高,差异有统计学意义(P<0.05),宫颈癌前病变组及宫颈癌组组间比较,差异无统计学意义(P>0.05),见表2。
表2 各组炎症因子数据比较(,pg/mL)

表2 各组炎症因子数据比较(,pg/mL)
注:†与对照组比较,P<0.05。
2.3 各组TREM-1、TNF-α 蛋白表达水平比较
对照组比较,宫颈癌前病变组及宫颈癌组TREM-1、TNF-α 蛋白明显升高,差异有统计学意义(P<0.05),宫颈癌前病变组及宫颈癌组比较,差异无统计学意义(P>0.05),见图1、表3。

图1 TREM-1、TNF-α 蛋白表达
表3 各组TREM-1、TNF-α 蛋白比较()

表3 各组TREM-1、TNF-α 蛋白比较()
注:†与对照组比较,P<0.05。
本研究揭示了宫颈癌患者存在全身炎症,即与对照相比,宫颈癌患者HPV 感染率、IFN-β、IL-1β、TREM-1 和TNF-α 水平显著更高。
HPV 疫苗接种可预防致癌感染和癌前病变。然而,中国的疫苗接种和筛查覆盖率仍然很低。有证据表明,从宫颈癌前病变发展为宫颈癌需要数年甚至数十年的时间。因此,对宫颈癌前病变做出良好和准确的诊断并防止其恶化是一项持续的医学研究。已发现HPV 感染对宫颈癌的发病率有显着影响,是最常见的性传播感染,而其他途径包括母婴传播和胃肠道感染。
HPV 的基因组包含8 000 个碱基对的双链环状DNA。迄今为止,已鉴定出100 多种HPV。它们分为两类:高危型HPV 和低危型HPV。此外,80%的女性在一生中都感染了HPV,然而,大约90%的感染会消失[7]。HPV 基因型的流行与不同的种族、地区和习俗有关[8]。虽然大多数HPV 感染已被证明会在几个月或几年内清除,仍有5%~10%的持续感染女性CIN 及宫颈癌症发病率增加。几项研究表明,单一HPV 感染占主导地位,而多种HPV 感染在大量人群中普遍存在[9-10]。研究人员对多发HPV 感染与宫颈病变的关系有不同看法。一项研究表明,多重HPV 感染是一种普遍现象,并不会增加CIN 进展的风险。此外,由于竞争,它们可能会引起更有效的免疫反应,从而降低高级别CIN 的发生率[11]。其他研究表明,多种HPV 感染对宫颈癌的发展具有协同作用。与单一HPV 感染相比,CIN1 有多重HPV 感染的患者发展为CIN2 的风险更高[12-13]。
细胞因子已被证明与大多数肿瘤组织有关,并且可能在细胞转化、癌细胞增殖、存活、侵袭和转移中发挥作用。一些细胞因子(例如LCN2、IL-1、IL-2、IL-4、IL-6、TNF-α 等)的表达失调与宫颈癌前病变的发生率之间存在显著关系[14-16]。这些事件之间的潜在联系是基于这样一个事实,即免疫刺激性T 辅助细胞因子如TNF-α、IFN-γ、IL-2 和IL-12 可以诱导细胞介导的免疫和肿瘤抑制,它们还可以在宿主中具有促炎作用。相反,抑制性细胞因子(例如IL-4、IL-5、IL-6、IL-8、IL-10)降低细胞介导的免疫并同时诱导体液免疫。因此,上述事实表明,癌症过程中细胞因子相关的免疫反应是复杂和异质的。另外一种情况,有研究报告[17]了在偶发和持续性HPV 感染的宿主中全身细胞因子水平显著降低。但更重要的是,IFN-β 和IL-1β 在宿主免疫反应中具有多种作用;
因此,关于他们在宫颈癌中的实际变化和角色(如果有)的问题仍有待澄清。
TREM-1 是2000 年发现的一种新型生物标志物。它是一种免疫球蛋白家族成员,存在于中性粒细胞、单核细胞、巨噬细胞和内皮细胞表面。研究发现TREM-1 激活炎症反应、炎症介质的合成和抗炎介质的抑制,TREM-1 能够通过Toll 样受体(TLR)合成促炎细胞因子,并调节先天炎症反应增强TLR 介导的信号通路[18-19]。因此,TREM-1水平升高与宫颈癌患者全身炎症存在一致。TREM-1 的表达被描述为在各种肿瘤模型中促进肿瘤发生并支持肿瘤生长,包括肠癌和肺癌[20]。在非小细胞肺癌(NSCLC)患者中,TREM-1 的表达与肿瘤复发和低生存率相关。这些NSCLC 患者的血液单核细胞与肺癌细胞共培养导致单核细胞中TREM-1 上调,并且在同一研究中,shRNA 抑制TREM-1 表达与肺癌细胞侵袭性降低有关[21]。
TNF-α 是一种多功能细胞因子,通过两种受体发挥作用,参与细胞凋亡、细胞存活、炎症和免疫。TNF-α 是一种17-kDa 的蛋白质,由157 个氨基酸组成。在人类中,该基因被映射到第6 号染色体。其生物活性主要受可溶性TNF-α 结合受体的调节。TNF-α 主要由活化的巨噬细胞、T 淋巴细胞和自然杀伤(NK)细胞产生。TNF-α 在多种其他细胞中低表达,包括成纤维细胞、平滑肌细胞和肿瘤细胞。在细胞中,TNF-α 被合成为前TNF(26 kDa),它是膜结合的,并在其前结构域被TNF 转换酶(TACE)切割后释放。TNF-α 有助于感染期间的炎症和清除感染后的抗炎/组织修复过程。其在低表达水平下的作用有助于肿瘤发生。暴露于炎症刺激后,TNF-α 以及IL-1 和其他趋化因子主要由活化的巨噬细胞和其他髓系细胞产生,这些细胞将嗜中性粒细胞和单核细胞吸引并激活到肿瘤部位。在肿瘤中,肿瘤细胞上的TNF-α 主要与TNF-R2 相互作用,通过产生活性氧中间体和通过神经酰胺发出信号来促进肿瘤细胞的清除。因此,膜形式的瘤内保存(具有较低的瘤内TACE活性)与更好的预后相关。TNF-α 的抗肿瘤作用已通过血管破坏和肿瘤坏死对原发性肿瘤产生显著的抗癌作用得到证实。活化的巨噬细胞主要分泌TNF-α,这有助于解释为什么在发烧、败血症、癌症、阿尔茨海默病和肠易激综合征期间TNF-α的循环水平会增加。在目前的研究中,与对照相比,宫颈癌患者的全身TNF-α 水平显著上调,该结果与以往宫颈癌与TNF-α 关系的研究结果相一致[22-24]。但是宫颈癌患者体内TNF-α 升高的具体原因及TNF-α 对宫颈癌组织的作用还需要进一步研究。
总之,本研究发现在宫颈癌患者中血清IFN-β、IL-1β 增加,宫颈上皮组织TREM-1 和TNF-α 表达增加,这表明它们在宫颈癌的病理生理学中具有一些重要作用。观察到的表达变化很可能与宫颈癌相关,并支持全身炎症参与宫颈癌的假设。然而,需要更多的研究来阐明这些细胞因子改变在宫颈癌的发生、发展中的具体机制。
猜你喜欢 细胞因子宫颈宫颈癌 宫颈锥切术治疗宫颈上皮内瘤变的效果分析中国典型病例大全(2022年7期)2022-04-22硫利达嗪抗宫颈癌的潜在作用机制昆明医科大学学报(2022年3期)2022-04-19成人HPS临床特征及多种细胞因子水平与预后的相关性昆明医科大学学报(2021年12期)2021-12-30中老年女性的宫颈癌预防中老年保健(2021年12期)2021-08-24抗GD2抗体联合细胞因子在高危NB治疗中的研究进展现代临床医学(2021年4期)2021-07-31预防宫颈癌,筛查怎么做中国生殖健康(2020年7期)2021-01-18腹腔镜下改良保留盆腔自主神经宫颈癌根治术治疗早期宫颈癌患者的短期随访研究云南医药(2020年5期)2020-10-27说说宫颈环形电切除术家庭百事通·健康一点通(2016年7期)2016-08-04细胞因子在慢性肾缺血与肾小管-间质纤维化过程中的作用医学研究杂志(2015年12期)2015-06-10宫颈糜烂真的不是病恋爱婚姻家庭·养生版(2012年11期)2012-08-13推荐访问:宫颈 炎症 肿瘤