miR-193a调控WT1影响高糖诱导的小鼠足细胞凋亡
来源:优秀文章 发布时间:2023-01-17 点击:
高飞 张欣欣, 陈素枝 杨凤文 檀金川,
(1河北中医学院,河北 石家庄 050200;
2河北省中医院)
糖尿病肾病(DN)以蛋白尿和进行性肾衰竭为主要临床表现,是我国终末期肾脏病的主要病因之一〔1〕。足细胞的功能和形态学改变与DN尿蛋白的增加关系密切,DN足细胞损伤后发生肥大、间质转化、脱离和凋亡等,其中足细胞的过度凋亡是DN发生的重要原因〔2〕。由高糖诱导的足细胞凋亡是目前研究DN足细胞损伤发生机制的常用细胞模型〔3〕。研究表明微小RNA(miRNA)与足细胞损伤的发生关系密切,足细胞中miRNA的表达异常〔4〕。miR-193a可促进心肌缺血/再灌注损伤细胞凋亡,促进肝癌细胞、前列腺癌细胞、非小细胞肺癌和肾癌细胞等凋亡〔5~7〕。研究报道miR-193a在DN患者肾组织中高表达,且miR-193a的表达水平与DN病变程度正相关〔8〕。现阶段对于miR-193a在高糖诱导的足细胞中的作用尚不清楚。本研究旨在探讨miR-193a在高糖诱导的小鼠足细胞凋亡中的作用和机制。
1.1实验材料 小鼠肾足细胞MPC-5购自上海雅吉生物科技有限公司;
高糖培养基、Lipofectamine 3000购自Thermo Fisher公司;
聚合酶链反应(PCR)引物由Servicebio公司合成;
miR-NC inhibitor、miR-193a inhibitor、miR-NC mimic和miR-193a mimic由RiboBio公司合成。肾母细胞瘤(WT)1抗体购自ABclonal公司;
酶切半胱氨酸天冬氨酸蛋白酶(caspase)-3、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)抗体购自武汉赛维尔生物科技有限公司;
逆转录试剂盒购自Thermo公司;
通用型快速启动液购自Servicebio公司;
荧光素酶报告载体由上海吉凯基因有限公司构建。
1.2细胞培养 小鼠肾足细胞MPC-5培养方法参照文献〔9〕。细胞增殖:在33℃,5%CO2培养箱用含有10%胎牛血清(FBS)、20 U/ml 干扰素(IFN)-γ、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基培养未分化足细胞。细胞分化:1∶10传代,在37℃,5%CO2培养箱用含有10%FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基培养足细胞10~14 d。
1.3实验分组及转染 将足细胞分为6组:正常糖组(5.5 mmol/L葡萄糖);
高糖组(30 mmol/L葡萄糖);
miR-193a inhibitor组、miR-NC inhibitor组、miR-193a mimic组和miR-NC mimic组。其中后4组足细胞分别转染miR-193a inhibitor、miR-NC inhibitor、miR-193a mimic和miR-NC mimic质粒后在30 mmol/L的高糖培养基培养24 h。
1.4流式细胞术测定足细胞凋亡 胰酶-EDTA消化足细胞后室温离心(1 000 r/min,5 min),弃上清,1×磷酸盐缓冲液(PBS)洗涤。每组收集大约1×106个足细胞,加入500 μl结合缓冲液,反复吹打均匀,分别添加5μl碘化丙啶(PI)和膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)混匀后在暗室静置10 min,流式细胞仪检测足细胞凋亡。
1.5逆转录(RT)-qPCR 抽提各组足细胞总RNA,使用Nanodrop 2000检测RNA浓度及纯度。取10 μl RNA溶液,加入特异性引物,加去离子水,加反应缓冲液、三磷酸脱氧核苷酸混合液、RNA酶抑制剂和逆转录酶于PCR仪进行反转录。配制PCR体系,进行PCR扩增,使用ΔΔCT法计算miRNA表达水平。miR-193a:上游引物5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGT-CATCTTG,下游5′-ACACTCCAGCTGGGTGGGTCT-TTGCGGGCA-3′;
内参U6:上游引物5′-CTC-GCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATT-TGCGT-3′;
WT1:上游引物5′-GTGGCTCCTGCGT-TTCCCCC-3′,下游5′-CCACAGGCATG GCGCGG-3′。反应扩增条件:95℃ 10 min;
95℃ 15 s,60℃ 60 s,循环40次。
1.6Western印迹 使用添加苯甲基磺酰氟(PMSF)的放射免疫沉淀试验(RIPA)裂解液提取总蛋白,使用二喹啉甲酸(BCA)测定蛋白浓度,取50 μg总蛋白与上样缓冲液混合后100℃变性5 min,使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶90 V恒压电泳2~3 h,之后进行250 mA恒流聚偏氟乙烯(PVDF)转膜30~60 min。将PVDF膜放在5%牛血清白蛋白(BSA)37℃孵育1.5 h,加入一抗WT1(1∶5 000)、酶切caspase-3(1∶2 000)、Bax (1∶3 000)、Bcl-2(1∶2 000)和β-actin (1∶5 000),4℃孵育过夜。洗膜后加入相应二抗(1∶5 000),37℃孵育1 h。洗膜后使用电化学发光(ECL)法显色,用Quantity One软件分析条带的灰度值,以目的蛋白条带/β-actin条带灰度比值作为最终结果。
1.7靶基因预测及荧光素酶报告系统鉴定 TargetScan数据库(http://www.targetscan.org/vert_72/)预测WT1是miR-193a的靶基因,miR-193a与WT1的3′UTR端存在互补结合位点。分别构建突变型(MUT)和野生型(WT) WT1-3′UTR,并连接到psi-Check2载体,构建WT1-3′UTR WT和WT1-3′UTR Mut。足细胞接种在24孔板24 h后,用Lipofectamine 3000分别将WT1-3′UTR WT、WT1-3′UTR Mut与miR-193a mimics、miR-NC mimics共转染至足细胞中,继续培养24 h以后,使用Dual-Luciferase®双荧光素酶报告分析系统检测荧光素酶活性,以海参的荧光素酶荧光强度/萤火虫的值来判定miR-193a与WT1的结合力。
1.8统计学方法 采用SPSS19.0软件进行t检验、方差分析。
2.1miR-193a inhibitor下调高糖诱导的足细胞中miR-193a的表达水平 高糖组miR-193a水平(3.42±0.38)较正常糖组(0.09±0.07)显著升高(P<0.05),miR-193a inhibitor转染高糖培养的足细胞后,细胞中的miR-193a表达水平(1.83±0.20)较高糖组显著降低(P<0.05)。
2.2miR-193a 对高糖诱导的足细胞凋亡的影响 与正常糖组相比,高糖刺激小鼠足细胞后细胞凋亡率、酶切caspase-3和Bax蛋白水平显著升高,Bcl-2蛋白水平显著下降(P<0.05);
转染miR-193a inhibitor后,高糖诱导的足细胞凋亡率、酶切caspase-3和Bax蛋白水平显著降低,Bcl-2蛋白水平显著升高(P<0.05);
转染miR-193a mimic后,高糖诱导的足细胞凋亡率、酶切caspase-3和Bax蛋白水平显著升高,Bcl-2蛋白水平显著降低(P<0.05)。见图1、图2、表1。表明miR-193a inhibitor抑制高糖诱导的足细胞凋亡,而miR-193a mimic促进高糖诱导的足细胞凋亡。

1~6:正常糖组,高糖组,miR-NC inhibitor组,miR-193a inhibitor组,miR-NC mimic组,miR-193a mimic组,下图同图1 Western印迹检测各组凋亡蛋白

图2 各组凋亡流式细胞图

表1 miR-193a 对高糖诱导的足细胞凋亡的影响
2.3miR-193a靶向调控WT1在足细胞中的表达 通过TargetScan 预测miR-193a和 WT1的结合位点,见图3。分别构建WT1突变型(MUT)和野生型(WT)载体,与miR-193a mimics、miR-NC mimics共转染足细胞。结果显示:与miR-NC组 mimic相比,miR-193a mimic组可显著降低转染WT1-3′UTR WT的足细胞的相对荧光活性(P<0.05),而对WT1-3′UTR Mut的相对荧光活性无明显影响(P>0.05),见表2。
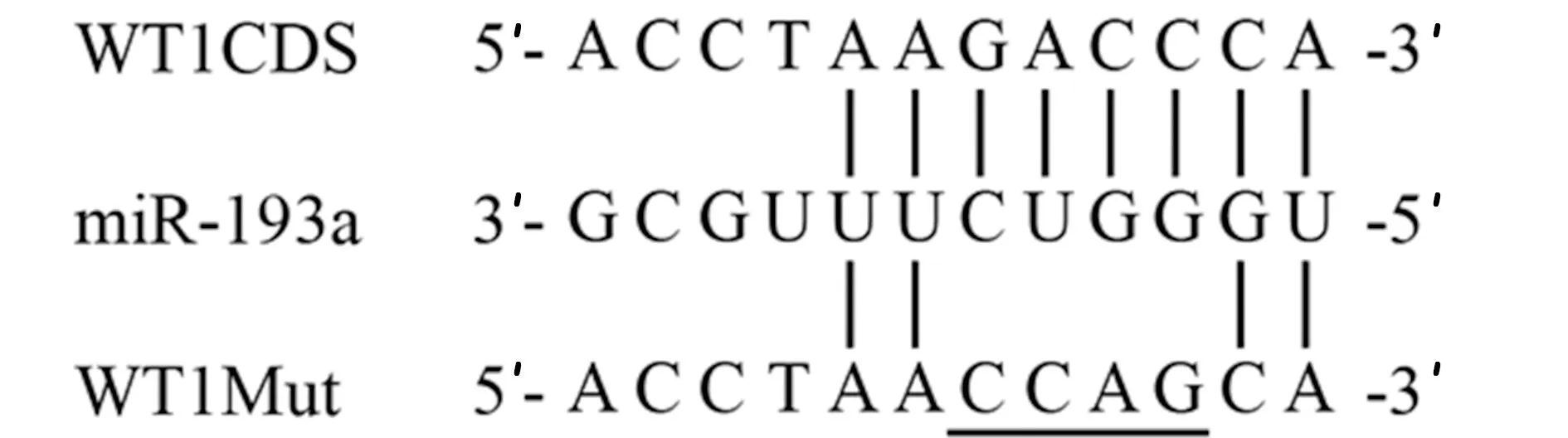
图3 miR-193a和WT1结合位点

表2 荧光素酶活性实验
2.4miR-193a inhibitor上调高糖诱导的足细胞中WT1的表达 与正常糖组相比,高糖组WT1 mRNA和蛋白表达水平显著降低(P<0.05)。miR-193a inhibitor转染后WT1 mRNA和蛋白表达水平显著升高(P<0.05),而miR-193a mimic转染后WT1 mRNA和蛋白表达水平显著降低(P<0.05),见图4、表3。表明miR-193a负向调控WT1蛋白的表达。

1~6:正常糖组,高糖组,miR-NC inhibitor组,miR-193a inhibitor组,miR-NC mimic组,miR-193a mimic组图4 miR-193a inhibitor上调高糖诱导的足细胞中WT1蛋白的表达

表3 miR-193a inhibitor上调高糖诱导的足细胞中WT1的表达
2.5miR-193a 靶向调控WT1抑制高糖诱导的足细胞凋亡 miR-193a+WT1组凋亡率、酶切caspase-3、Bax显著低于miR-193a+Vector组,WT1、Bcl-2水平显著高于miR-193a+vector组(均P<0.05)。见表4、图5,表明上调WT1可降低miR-193a对高糖诱导的足细胞凋亡的影响。

表4 miR-193a 调控WT1抑制高糖诱导的足细胞凋亡

图5 miR-193a 靶向调控WT1抑制高糖诱导的足细胞凋亡
足细胞是维持肾小球滤过膜结构和功能的主要细胞,足细胞损伤后蛋白从滤过膜漏出形成蛋白尿〔10〕。足细胞凋亡是足细胞数量减少和密度减低的重要原因之一。研究表明高水平葡萄糖刺激细胞线粒体释放大量活性氧基团,直接或间接导致足细胞凋亡,也可以通过肾素-血管紧张素-醛固酮系统、转化生长因子-β1 等多种信号通路介导足细胞凋亡〔11〕。
miR-193a是一种具有多种生物学作用的miRNA分子,在各种疾病的作用受到关注。如肝癌、前列腺癌、非小细胞肺癌和肾癌等多种类型癌症〔5~7〕。例如miR-193a通过靶向细胞外基质蛋白多糖(SPOCK)1抑制肝细胞癌的生长〔12〕,通过下调PLAU表达抑制大肠癌细胞的增殖和进展〔13〕。此外,miR-193a可减轻肝纤维化并抑制肝星状细胞的增殖和活化〔14〕,通过靶向负调控高迁移率族蛋白(HMGB)1减轻糖尿病模型小鼠神经性疼痛〔15〕。除了影响癌症,miR-193a与膜性肾病、局灶节段性肾小球硬化(FSGS)和DN等多种肾脏疾病的发生发展密切相关〔16~18〕。如Zhang等〔16〕研究发现,特发性膜性肾病患者的miR-193a高表达,同时高表达miR-193a与高蛋白尿(>3.79 g/24 h)、高血清肌酐>174.63 μmol/L)和肾小球滤过率下降〔≤68.13 ml/(min·1.73 m2)〕均为膜性肾病的肾存活不良的生物标志物,也是预测膜性肾病预后的生物标志物。Huang等〔17〕观察到FSGS患者的尿液外泌体miR-193a水平明显高于微小病变患者,提示miR-193a可能是诊断原发性FSGS非侵入性生物标志物。研究发现肾病综合征患者血清中miR-193a也是增加的〔19〕。足细胞分子表型的丧失是DN的重要特征。高糖诱导的足细胞去分化表现为WT1下调和配对框(PAX)2表达上调。Abheepsa等〔20〕研究显示,高糖诱导的足细胞去分化与miR-193a的高表达有关,而抑制miR-193a则阻止了高糖环境中足细胞的去分化。足细胞分化的丧失也可引起肾病范围蛋白尿及FSGS,这与miR193a的高表达也存在相关性〔21〕。
研究表明,包括miR-193a在内的miRNA可与多个靶基因结合发挥多种生物学作用,HMGB1〔22〕、生长因子受体结合蛋白(GRB)7〔23〕、早老素(PSEN)1〔24〕和鼠肉瘤原癌基因(KRAS)〔25〕等均是miR-193a的靶基因,参与人体不同组织细胞的病理和生理过程。WT1是成熟足细胞的特异性标志蛋白,常作为足细胞计数的标记物,对足细胞的发育,分化和稳态至关重要〔26〕。WT1通过调节裂隙膜nephrin和podocalyxin及足细胞特异性转录因子来维持足细胞结构和功能的稳态〔19〕。当足细胞受到损伤时,WT1表达降低。此外,WT1也是一个与细胞凋亡有关的抗凋亡因子,其可通过多种途径抑制细胞凋亡的发生。如WT1通过靶向cMyc增强KRAS突变型非小细胞肺癌(NSCLC)的增殖并阻止其凋亡〔27〕;
通过调控上游激活剂Bax及调控下游效应子酶切caspase-3和caspase-7抗细胞凋亡〔28〕;
通过抑制EZH2/β-catenin途径改善DN的足细胞损伤等〔26〕。Li等〔29〕研究显示,高果糖诱导足细胞凋亡模型中miR-193a高表达,WT1低表达,高果糖可通过增加miR-193a的表达从而下调WT1的表达,促进足细胞凋亡,而异甘草酸镁可以逆转这一过程。本研究结果提示miR-193a可通过靶向负调控WT1的表达影响酶切caspase-3和Bax等凋亡信号通络,从而减少高糖诱导的足细胞凋亡。
推荐文章
- 【想移民荷兰的朋友看过来,告诉你定居荷兰是一种怎样的生活体验】荷兰移民需要什么条件
- [关于训练口才的经典句子]训练口才的经典句子
- 【加拿大留学金融系专业排名】 加拿大留学专业排名
- 2018年四川省人民医院神经外科临床医师编外人员招聘公告 2018年神经外科年会
- 2018安徽高考志愿填报及征集志愿时间安排:2018高考志愿填报征集志愿时间
- 行政前台工作计划表_行政前台工作计划怎么写
- 和女朋友表白感人的话_和女朋友表白的句子
- 【英语语法:the,fact,that的语法功能】 in fact等于什么
- [2018入党培训心得体会范文2000字【三篇】]入党积极分子思想汇报
- 2018年中级审计师考试试题每日一练(6.14)|审计师报名时间2018