褐飞虱自噬相关基因NlATG13的表达与功能分析
来源:优秀文章 发布时间:2022-12-06 点击:
吴建艮, 矫启启, 俞飞飞, 郑园园, 陈桐桐, 郝培应, 俞晓平
(中国计量大学生命科学学院, 浙江省生物计量及检验检疫技术重点实验室, 杭州310018)
细胞自噬是细胞内一种受到高度调控的降解过程(van der Vaartetal., 2008)。细胞自噬通过溶酶体清除多余或受伤的蛋白质、细胞器和入侵病原体等维持细胞的生理稳态与生存(van der Vaartetal., 2008; Jing and Lim, 2012; Zhanetal., 2018),在细胞内物质转运、细胞生长、发育、抗衰老、细胞死亡、细胞免疫等过程中发挥作用(Mizushima, 2005; Maruzsetal., 2019)。ATG13是自噬通路的一个重要组成部分,自噬发生时,ATG13去磷酸化,并通过其中间区域与ATG1和ATG17相互作用,形成起始复合物,促进自噬(Chang and Neufeld, 2009; Suttangkakuletal., 2011; Chewetal., 2015)。在昆虫中,自噬参与细胞结构重建(Komatsuetal., 2006; Bartolomeoetal., 2010; Kimetal., 2013)、蜕皮(Papinski and Kraft, 2016)、饥饿(Periyasamy-Thandavanetal., 2009; Mari and Reggiori, 2007)和抑制病原体感染(Yamamotoetal., 2012; Wildetal., 2014; Baderetal., 2015; Yinetal., 2016)等多个过程。ATG13通过与ATG1形成复合物,促进自噬的启动,整合并传递自噬通路上游至下游的信号。在家蚕Bombyxmori、黑腹果蝇Drosophilamelanogaster和斜纹夜蛾Spodopteralitura中,ATG13与其他自噬相关蛋白相互作用并增强自噬降解,对ATG13基因的RNA干扰导致自噬水平降低(Chang and Neufeld, 2009; Xiaoetal., 2019)。
虽然自噬以及ATG13基因在完全变态昆虫研究较多,但有关不完全变态昆虫的自噬及ATG13基因却鲜有报道。褐飞虱Nilaparvatalugens是一种不完全变态昆虫,它与完全变态昆虫在取食方式、器官重建(比如消化器官)等方面存在较大差异,其细胞自噬行为与完全变态昆虫是否存在差异尚不清楚。因此,有必要探明褐飞虱细胞自噬行为以及自噬相关基因ATG13等的功能。本研究旨在分析NlATG13在褐飞虱不同发育阶段和若虫不同组织中的表达情况,揭示NlATG13基因在褐飞虱中的时空表达规律,并通过RNA干扰技术分析其在褐飞虱中的作用,评估NlATG13基因作为褐飞虱防治靶标的潜力。
1.1 供试虫源
供试褐飞虱是本课题组在水稻品种TN1(不含抗褐飞虱基因)上饲养了10年以上的群体。培养温度为26±2℃,相对湿度为75%±5%,光周期为16L∶8D。本研究试虫均为短翅型褐飞虱成虫及其后代。
1.2 褐飞虱总RNA提取与cDNA的合成
根据试剂盒的说明书,使用TRIzol Total RNA Isolation Kit(TaKaRa, Kyoto, 日本)从褐飞虱的不同发育阶段(1-5龄若虫各20~50头以及羽化后1, 3, 5, 7和9 d的雌成虫和雄成虫各15头)和不同组织(30头5龄若虫的头、胸、中肠和脂肪体及30头刚羽化雌虫的卵巢)的样本中提取总RNA。用琼脂糖凝胶电泳和NanoDrop 2000分光光度计(Thermo Fisher Scientific, Waltham, MA, 美国)检测RNA质量和浓度。按照PrimeScript RT Reagent Kit和gDNA Eraser(TaKaRa, Tokyo, 日本)说明书用1 μg总RNA合成cDNA第1链,保存在-20℃备用。
1.3 NlATG13的克隆
根据本课题组前期获得的褐飞虱转录组数据,获得自噬相关基因NlATG13的部分核心序列,通过Primer Premier 5.0软件设计该核心序列的引物NlATG13-F/-R(表1),使用1.2节反转录合成的cDNA为模板进行PCR扩增,对NlATG13核心序列信息进行验证,PCR反应体系(50 μL): Premix Taq 25 μL, ddH2O 19 μL, 正反向引物(10 μmol/L)各2 μL, cDNA模板2 μL。PCR反应程序: 94℃ 4 min; 94℃ 30 s,57℃ 30 s, 72℃ 3 min, 34 次循环; 72℃ 10 min, 4℃保存。通过1%琼脂糖凝胶电泳检测PCR扩增片段大小。目的条带割胶回收后送至桑尼生物科技有限公司(上海)测序,测序结果利用DNAMAN软件和原序列对比验证。
根据NlATG13基因的核心序列,通过Primer Premier 5.0设计RACE外围引物与内围引物(表1),以1 μg总RNA合成RACE模板,采用巢式PCR对褐飞虱NlATG13基因的3′端和5′端进行扩增。具体操作按照RACE试剂盒说明书步骤进行。通过1%的琼脂糖凝胶电泳检测扩增产物,将目的片段连到 pMD18-T Vector载体上,挑选5管阳性单克隆菌液送至公司测序。应用DNAMAN软件将NlATG13 基因的核心片段、3′RACE序列和5′RACE序列进行拼接,得到NlATG13基因的全长序列。

表1 引物信息
1.4 NlATG13的序列分析与进化树构建
克隆NlATG13基因的全长cDNA后,使用开放阅读框(ORF)查找工具ORF Finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)预测其开放阅读框及蛋白质翻译情况。通过NCBI的BLASTX搜索,查询不同物种氨基酸序列以进行同源性比对。使用ExPASy(http:∥web.expasy.org/protparam/)预测蛋白质的分子量和理论等电点,通过在线工具SignalP 4.1 Server(http:∥www.cbs.dtu.dk/services/SignalP/)对信号肽进行预测。在PROSITE数据库(http:∥prosite.expasy.org/)中预测蛋白质含有的结构域。通过MEGA 6.0.6中的邻接法(neighbor-joining, NJ),构建褐飞虱和其他物种的氨基酸序列的系统进化树,重复数为1 000,在进化树的每个节点上均显示大于50的百分比值。
1.5 NlATG13表达谱分析
根据1.3节克隆的NlATG13的全长cDNA序列信息,运用Primer Premier 5.0软件设计RT-qPCR特异性引物(表1),NlRPS11作为内参基因。以1.2节合成的不同发育阶段和组织的RNA为模板,采用RT-qPCR检测NlATG13基因在褐飞虱不同发育阶段和组织中的表达量。PCR反应体系(10 μL): SYBR 5 μL, ddH2O 3.4 μL, ROX 0.2 μL, 正反向引物(10 μmol/L)各 0.2 μL, cDNA模板 1 μL。PCR反应程序: 94℃ 45 s; 94℃ 5 s, 57℃ 34 s, 72℃ 30 s, 共40个循环。1-2龄若虫的中的基因表达量作为不同发育阶段的基因表达量参照,以头中的基因表达量作为不同组织中的基因表达量参照,每个样本设置3个生物学重复和3个技术重复。不同发育阶段和组织取样每个生物学重复样本量:若虫5~15头,成虫3~5头,头10头,胸10头,中肠30头,卵巢30头,脂肪体20头。
1.6 RNAi敲减NlATG13的表达
根据褐飞虱NlATG13的cDNA序列,利用Primer Premier 5.0设计引物dsNlATG13-F/-R(表1)合成NlATG13的dsRNA片段。根据绿色荧光蛋白基因GFP(GenBank登录号: MF169984.1)的序列信息,设计引物dsGFP-F/-R(表1)。参照课题组前期引物设计方法在5′端添加保护碱基(GGATCC)以及T7启动子(TAATACGACTCACTATA)。NlATG13和GFP的dsRNA片段不包含RT-qPCR所需的片段,以避免干扰目的基因的转录水平检测。NlATG13和GFP的dsRNA片段转化到pMD18-T载体上,转入JM109测序,确定正确性。测序后选择无突变菌液提取质粒,进行普通PCR并割胶回收,胶回收产物则为dsRNA合成的模板。根据MEGAscript®T7 High Yield Transcription Kit(Ambion, Austin, TX, 美国)试剂盒说明书合成NlATG13和GFP的dsRNA,-80℃保存备用。
将dsRNA加入拉针仪(Narishige, Tokyo, 日本)拉制的毛细管中,选择龄期相对一致的褐飞虱3龄若虫进行显微注射,注射部位位于中足和后足之间,以注射等量dsGFP为对照,dsRNA终浓度为5 μg/μL,每头褐飞虱大约注射50 nL的dsRNA,注射完后将褐飞虱放入装有水稻苗的杯中,待褐飞虱恢复后进行分组。
1.7 RNAi后中肠细胞的透射电镜观察
在普通显微镜下解剖1.6节RNAi处理4 d的褐飞虱,拉出中肠后用2.5%戊二醛过夜固定,PBS洗涤3次后用1%的OsO4固定1 h,PBS洗涤3次后用一系列浓度的乙醇(30%, 50%, 70%, 80%, 90%, 95%和100%)对其进行脱水。包埋后使用Leica EM UC7超薄切片机进行切片,切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液染色,最后在Hitachi H-7650透射电镜中对中肠上皮细胞自噬及糖原进行观察,dsGFP和dsNlATG13处理各观察5个重复样本。
1.8 RNAi后ATP含量的测定
为探明RNA干扰NlATG13导致的糖原积累及葡糖糖供应会不会影响ATP合成,检测RNA干扰NlATG13对ATP含量的影响。按照ATP检测试剂盒说明,取20 mg经1.6节dsNlATG13和dsGFP处理4 d的褐飞虱样品(整个虫体),加入150 μL裂解液,用电动组织研磨器研磨,后在12 000 r/min 4℃下离心5 min。吸取上清液20 μL,用96孔黑色板在酶标仪上检测样品的ATP含量。同时,使用BCA蛋白质检测试剂盒蛋白质浓度,用以计算ATP最终含量。每个样品3个技术重复。
1.9 RNAi后褐飞虱的干扰效率、糖原合成与代谢途径相关基因检测和存活率统计
待1.6节RNAi处理褐飞虱在显微镜灯光下放置5 min使其苏醒后放入4-5叶期TN1水稻幼苗杯中,每只杯子放入20头褐飞虱,每个处理设置3个重复。每天观察和统计成虫数量,计算存活率;
采集褐飞虱死亡标本,在立体显微镜下观察褐飞虱死亡特征。同时,设置3个平行组,每组30头褐飞虱进行取样,在RNAi处理后第2, 4, 6和8天进行取样,检测NlATG13的表达量,以检测RNA干扰效果;
为研究RNA干扰NlATG13对糖原合成与代谢通路相关基因糖原合成及代谢通路相关基因的影响,对dsNlATG13处理4 d褐飞虱3龄若虫的糖原合成酶基因NlGS、糖原合成激酶基因NlGSK3、糖原磷酸化酶基因NlGP的相对表达量进行了分析,采用RT-qPCR进行检测(方法同1.5节)。
1.10 数据分析
所有基因表达量数据均以3个技术重复的平均值±标准差表示,采用相对定量2-ΔΔCt法计算(Livak and Schmittgen, 2001),采用Student氏t检验进行分析。采用SPSS 22.0软件和GraphPad Prism 8.0软件对实验数据进行分析并绘制图表。所有数据均表示为至少3个独立生物学重复的平均值。采用t检验比较两组样本的差异,采用单因素方差分析检验处理3组或3组以上样本影响的显著性,存在显著影响时,采用Tukey检验比较平均值差异。
2.1 褐飞虱NlATG13的全长cDNA克隆和序列特征
克隆获得1 194 bp的NlATG13核心序列,经RACE获得NlATG13的1 325 bp的cDNA全长序列。通过ORF Finder预测,NlATG13包含一个1 203 bp的ORF(GenBank登录号: MF805752),编码一个含400个氨基酸的蛋白质(GenBank登录号: AWW05678.1),分子量为46.3 kD,等电点为5.39,没有信号肽,符合其在细胞质发挥作用的特征。
蛋白序列分析发现,NlATG13包含一个ATG13蛋白特征结构域(PF10033),位于第76-194位氨基酸。选择同源性较近的2种昆虫茶翅蝽Halyomorphahalys与温带臭虫Cimexlectularius的ATG13蛋白与褐飞虱NlATG13蛋白进行多重氨基酸序列比对。虽然,ATG13蛋白结构与上述2种昆虫的ATG13蛋白存在部分差异,但3条序列均具有一个与自噬相关的ATG13蛋白结构域并且位置相近(图1)。通过对其结构的分析,推测ATG13蛋白在不同种类昆虫中的生理功能相似。

图1 ATG13蛋白的多重序列比对
2.2 褐飞虱NlATG13的系统发育
进化分析表明,在纳入分析的物种中褐飞虱的NlATG13蛋白与半翅目昆虫温带臭虫和茶翅蝽的ATG13蛋白进化关系较为接近(图2)。

图2 邻接法构建的基于氨基酸序列的褐飞虱及其他物种ATG13蛋白的系统进化树(1 000次重复)
2.3 NlATG13的时空表达规律
RT-qPCR结果表明,NlATG13在褐飞虱的不同发育阶段均有表达,与1-2龄若虫相比,3和5龄若虫中的表达量高(P=0.003),4龄若虫、雌成虫和雄成虫中的表达量无显著性差异(P值分别为0.082, 0.258和0.725)(图3: A)。NlATG13在褐飞虱的不同组织中均有表达,与头中的表达量相比,胸、中肠、卵巢和脂肪体中的表达量均较低(P值分别为0.020, 0.015, 0.010和0.044),胸中的表达量最低(P=0.020)(图3: B)。
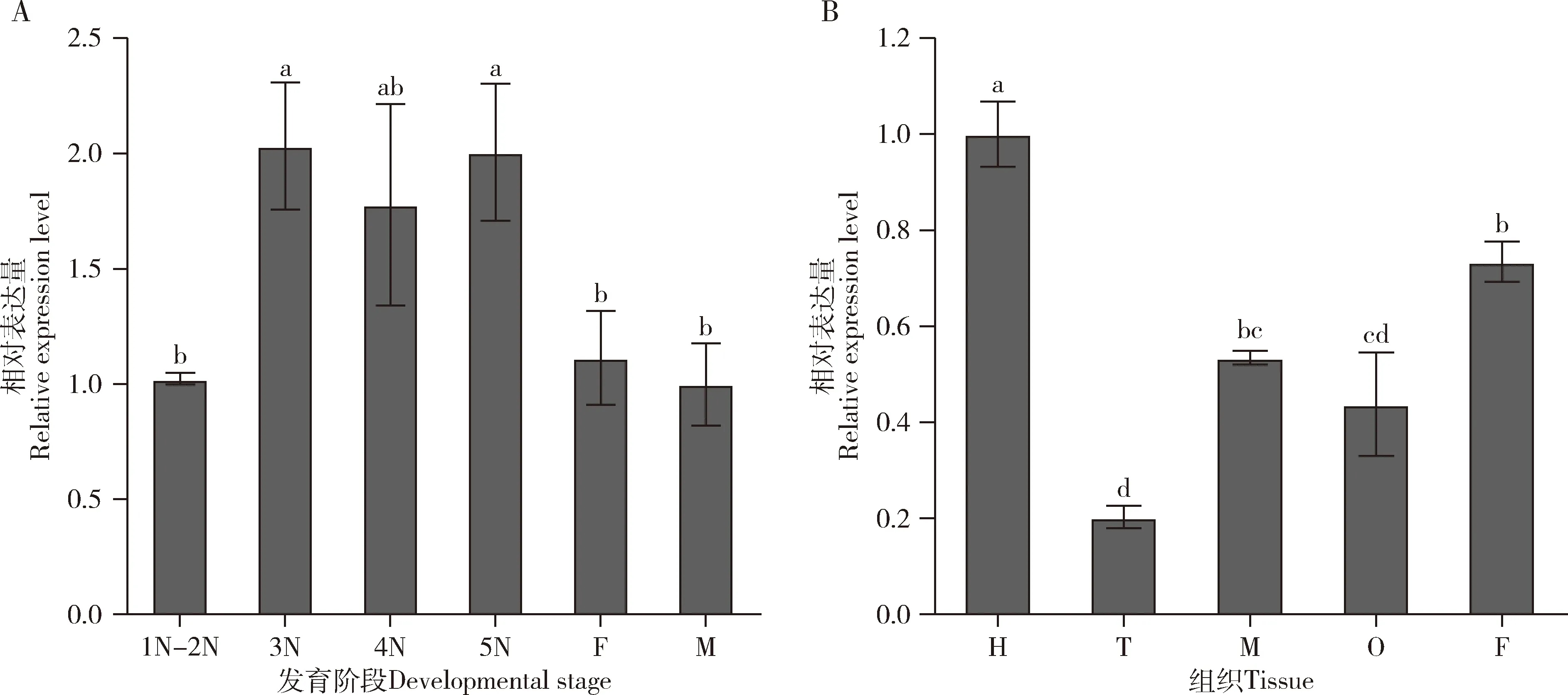
图3 NlATG13在褐飞虱不同发育阶段(A)和不同组织(5龄若虫头、胸、中肠和脂肪体以及刚羽化雌虫的卵巢)(B)中的相对表达量
2.4 NlATG13的RNAi效果
RT-qPCR结果显示,显微注射dsNlATG13进行干扰2, 4, 6和8 d后,目标基因NlATG13的表达水平较显微注射dsGFP的对照组显著降低(P值分别为0.007, 0.003, 0.024和0.009),分别下降到25.1%, 16.9%, 35.1%和26.7%(图4)。可见,RNA干扰有效降低了靶标基因的表达量。

图4 显微注射dsRNA至褐飞虱3龄若虫对NlATG13相对表达量的影响
2.5 RNA干扰NlATG13对褐飞虱中肠细胞自噬及糖原的影响
透射电镜结果显示,RNA干扰NlATG13后中肠上皮细胞自噬被明显抑制,细胞中仅有少量自噬泡,且伴有不同程度的糖原颗粒积累,有的细胞中糖原颗粒聚集在自噬泡的附近只被部分降解(图5: A),有的细胞有大量糖原颗粒积累,但只有极少量自噬泡参与降解(图5: B)。在显微注射dsGFP的对照组中褐飞虱中肠上皮细胞存在基本自噬,可以看到适量的自噬泡,但几乎没有糖原颗粒积累(图5: C, D)。上述结果表明,RNA干扰NlATG13抑制了褐飞虱中肠细胞自噬,影响了细胞正常的生理过程,并导致葡萄糖利用率下降和糖原的积累。

图5 显微注射dsRNA至褐飞虱3龄若虫4 d对中肠上皮细胞自噬及糖原的影响
2.6 RNA干扰NlATG13对糖原合成与代谢相关基因表达的影响
结果发现RNA干扰NlATG13对NlGS,NlGSK3和NlGP的表达量均无显著性影响(P值分别为0.377, 0.319和0.473)(图6: A)。据此推测,糖原积累可能主要由于RNA干扰NlATG13导致的糖原自噬受阻,而受糖原合成与代谢通路相关基因表达的影响较小。
2.7 RNA干扰NlATG13对机体细胞ATP含量的影响
结果表明,dsNlATG13处理组的ATP水平较dsGFP显微注射组(对照)显著降低(P=0.003),为0.24 nmol/L·μg,而对照ATP含量较高,为1.35 nmol/L·μg(图6: B)。
2.8 RNA干扰NlATG13对褐飞虱存活率的影响
在进行NlATG13 dsRNA显微注射后,褐飞虱的存活率从第2天开始较对照组明显下降(P<0.01);
在第10天,dsNlATG13处理组的存活率下降到41.4%(P<0.01),而对照组的存活率保持在85.6%的较高水平(图6: C)。因此,RNA干扰NlATG13对褐飞虱存活率有显著性影响。
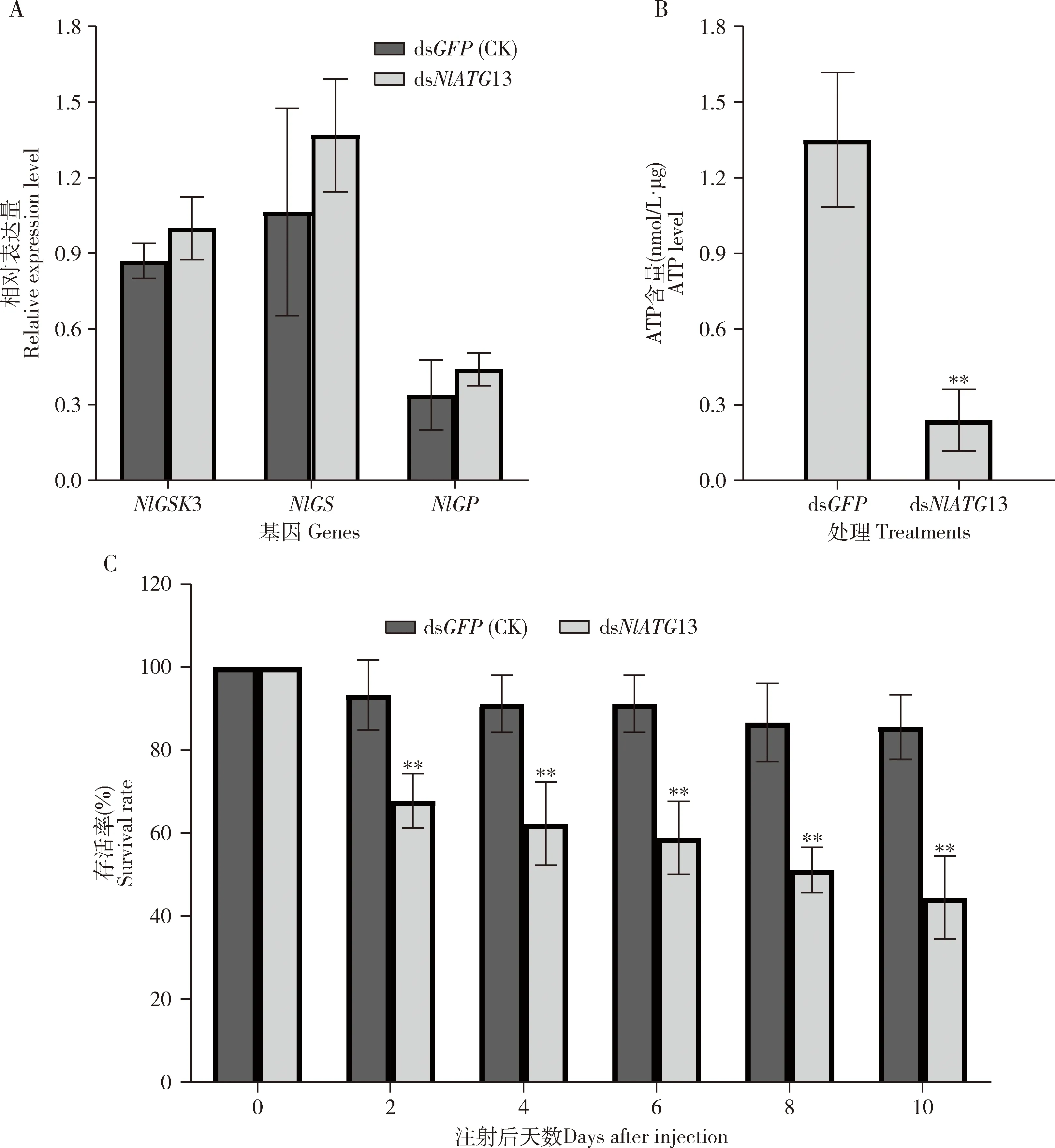
图6 显微注射dsRNA至褐飞虱3龄若虫4 d对糖原合成与代谢相关基因表达量(A)、ATP含量(B)和褐飞虱存活率(C)的影响
收集RNA干扰NlATG13后死亡的褐飞虱,在显微镜下观察形态,发现有部分死亡的褐飞虱蜕皮障碍,而对照组蜕皮顺利(图7)。

图7 RNA干扰NlATG13后褐飞虱死亡时的形态
本研究首次克隆了褐飞虱自噬相关基因NlATG13的全长cDNA,对其核酸序列及氨基酸序列进行了生物信息学分析,揭示了NlATG13在褐飞虱中的时空表达规律,明确了NlATG13参与褐飞虱中肠细胞自噬,在褐飞虱正常生理过程中发挥作用。目前,对昆虫自噬的研究主要集中在完全变态的昆虫,并且大多在昆虫的细胞水平上进行,侧重于自噬的调控机制阐释,很少探讨自噬对个体生存情况的影响(Leeetal., 2002; Scottetal., 2007; Casatietal., 2012; Liuetal., 2013; Zhanetal., 2018)。因此,本研究的发现丰富了褐飞虱等不完全变态昆虫的细胞自噬信息。同时,本研究还提供了一个新的褐飞虱防治的潜在靶标NlATG13,为后续研发基于RNA干扰的害虫防治技术提供了新的线索。
研究表明自噬在昆虫生长发育中的作用具有时空差异性,自噬相关基因在不同发育阶段,对不同组织器官有不同的影响(Wenetal., 2017; Nagyetal., 2018)。在本研究中,我们也发现,NlATG13在褐飞虱各发育阶段均有表达,3和5龄若虫的表达量显著高于1-2龄若虫、雌成虫和雄成虫的。可见,NlATG13在褐飞虱各发育阶段均发挥作用,对3-5龄若虫尤为重要(图3)。由于1-5龄若虫期褐飞虱的体长和体重均呈指数增长,从3龄开始其体长和体重均有较快增加(邹运鼎, 1984),因此,3和5龄若虫NlATG13表达量的增高可能与机体快速发育对物质和能量的需求增加有关。此外,本研究还发现,NlATG13被RNA干扰的若虫死亡时会出现蜕皮障碍,提示NlATG13可能参与蜕皮过程,而进入成虫期后,褐飞虱不再蜕皮,NlATG13与蜕皮相关的功能减退,其表达量也随着降低。NlATG13参与蜕皮过程,可能与旧皮成分回收和新皮合成有关,但具体机制有待进一步探明。
基因表达模式分析还表明,NlATG13在褐飞虱不同组织中的表达量也有差异,其中在头中的表达量最高,脂肪体、中肠和卵巢中的处于中等水平,胸部的表达量最低(图3)。头部是神经比较丰富的部位,而自噬在神经元细胞的功能维持中具有重要作用。自噬能够帮助清理神经元细胞中的蛋白质沉积物,比如在神经变性疾病发生过程中出现的蛋白质等,自噬也可以影响Ca2+的释放,进而影响神经递质的释放和神经冲动(Haraetal., 2006; Juhászetal., 2007; Simonsenetal., 2008; Kuijpersetal., 2021)。NlATG13在褐飞虱脂肪体的表达量也较高(图3:
B),脂肪体富含脂类成分,而自噬在脂类物质的动员过程发挥作用(Rustenetal., 2004; Scottetal., 2004);NlATG13在褐飞虱卵巢中表达量较高(图3:
B),可能参与卵子发育过程的营养物质吸收,以及卵黄蛋白原等的分解利用(Brennandetal., 2015);NlATG13在褐飞虱胸部的表达量最低(图3:
B),可能的原因在于,胸部是昆虫翅和足着生的部位,与昆虫的运动密切相关。由于本研究选择的褐飞虱为实验室饲养种群,饲料苗养分充足,褐飞虱可以长时间在相对固定的地方取食,无需太多的运动(如跳跃、迁飞等),因此胸部肌肉活动量小,肌肉线粒体的损伤相对较少,线粒体等细胞器的自噬水平相应较低。
本研究重点考察了中肠相关的自噬,发现RNA干扰NlATG13会抑制中肠细胞自噬,自噬泡明显减少,糖原在中肠积累,且有少量自噬泡参与糖原降解;
而RNA干扰GFP的对照组有较多自噬泡,部分自噬泡含有线粒体,但未见明显的糖原颗粒积累(图5)。我们认为可以从以下几方面进行解释:首先,自噬降解的细胞成分或细胞器种类会因细胞生理或病理状态不同而不同,因此,就会出现线粒体自噬、糖原自噬、核糖体自噬、内质网自噬等不同现象。在细胞正常生理状态下,比如本研究显微注射dsGFP情况下,中肠细胞基本不受RNA干扰的影响,细胞的吸收和分泌等功能正常进行(图5),由于这些生理过程需要不断消耗ATP,线粒体也因为不停地进行电子传递和ATP合成,很容易损伤,在这种情况下,细胞发生线粒体自噬为正常现象(Lipovšeketal., 2019; Kuijpersetal., 2021)。而自噬到后期,自噬泡就表现为空泡(图5: C, D)。其次,在细胞处于dsATG13处理情况下,细胞自噬受到干扰,细胞正常的生理过程因此受到影响,其中包括损伤的线粒体不能及时清除、细胞机能发生障碍,葡萄糖的利用率下降等,这时就会出现线粒体自噬减少,但糖原积累的现象(图5: A, B)。糖原的积累可以通过合成加快或分解受阻实现,本研究关于糖原合成与分解的研究表明,RNA干扰NlATG13对NlGS,NlGSK3和NlGP的表达量均无显著性影响(图6: A)。据此推测,由于糖原合成与代谢相关基因或酶的表达变化导致糖原积累的可能性较小,而自噬障碍导致的细胞机能下降及葡萄糖的利用率降低,即糖原合成的底物葡萄糖含量上升,可能是导致糖原积累的主要原因。
综上,本研究通过对NlATG13进行RNA干扰,明确了NlATG13在细胞自噬中的作用,并考察了糖原降解及褐飞虱存活等指标,初步探明了该基因在褐飞虱中的部分功能。今后,有必要进一步研究RNA干扰NlATG13对褐飞虱生长发育和繁殖力等的影响,进一步探明RNA干扰NlATG13影响褐飞虱生长发育、生存和繁殖能力的机制,全面评价其在褐飞虱防治中的潜力。
猜你喜欢 飞虱糖原若虫 基于轻量级SSD模型的夜间金蝉若虫检测农业工程学报(2022年10期)2022-08-2250%吡蚜酮WG对水稻褐飞虱田间药效试验上海农业科技(2022年4期)2022-08-15Bph36介导的抗性机制及相关信号通路的研究热带作物学报(2022年5期)2022-06-06Bph36介导的抗性机制及相关信号通路的研究热带农业科学(2022年5期)2022-06-0211种杀虫剂对透明疏广蜡蝉3龄若虫的毒力测定天津农业科学(2022年5期)2022-05-31环斑猛猎蝽对烟蚜若虫的捕食作用南方农业学报(2021年11期)2021-03-05商河县夏玉米灰飞虱综合防治技术研究农业与技术(2019年6期)2019-05-29长期服用奥氮平对大鼠糖原代谢及糖转运蛋白表达的影响中国医药导报(2019年3期)2019-03-18薇甘菊颈盲蝽基础生物学特性江苏农业科学(2017年12期)2017-09-16抑制糖原合成激酶3a可减轻6—羟基多巴引起的SH—SY5Y细胞损伤现代养生·下半月(2016年6期)2016-10-21推荐访问:基因 表达 功能