CRISPR/Cas9技术介导烟草CENH3基因突变体的获得
来源:优秀文章 发布时间:2022-12-03 点击:
韩平安 ,孙瑞芬 ,常 悦 ,唐宽刚 ,王 良 ,聂利珍 ,张自强 ,梁亚晖 ,吴新荣 ,李晓东
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;
2.内蒙古自治区甜菜品种遗传改良与种质创制重点实验室,内蒙古 呼和浩特 010031)
CENH3是组蛋白H3的一个变体,其特异性定位于着丝粒上[1],可募集其他着丝粒蛋白并与之形成复合体,在有丝分裂和减数分裂时参与着丝粒的组装并和纺锤丝连接,对染色体的正常分离与传递有决定作用[2-4]。编码着丝粒特异性组蛋白基因CENH3是近年来利用诱导系诱导单倍体的一个研究热点[5]。RAVI等[6]通过对拟南芥染色体着丝粒的突变体研究,开发出了通过着丝粒介导使父本或母本染色体选择性丢失,从而获得单倍体的方法。拟南芥CENH3突变体具有致死性,利用组蛋白H3的N末端尾部替换CENH3的N末端尾部,同时将绿色荧光蛋白(GFP)添加到N端终点,形成的GFPtailswap蛋白,定位于着丝粒上,该结构克服了CENH3突变体的致死表型。利用转基因技术获得GFPtailswap Cenh3-/-基因型植株,该植株雄性不育但是能够产生少量花粉,作为父本与野生型进行杂交能够产生5%的母本单倍体,作为母本与野生型进行杂交能够产生25%~50%的父本单倍体[7]。CENH3在不同物种都具有高度进化保守性,对CENH3基因进行修饰获得单倍体诱导系同样适用于其他作物[8-11]。CRISPR/Cas9技术是一种有效的基因组编辑工具[12-16],可以直接改良农艺性状控制基因,具有精准高效、构建简单、操作简便、成本低廉等特点,现已成功应用于模式植物拟南芥、烟草以及水稻、小麦、玉米、大豆、高粱等作物[17-21]。CRISPR/Cas9基因编辑技术的发展和应用为不同作物沉默着丝粒特异性组蛋白CENH3创造单倍体诱导系提供了可能。对玉米CENH3进行遗传修饰,成功获得单倍体,证明了CENH3-tailswap互补系统可以在玉米上作为单倍体诱导系[22-23]。通过筛选被基因组编辑的TaCENH3α-异等位基因组合,获得了可用于小麦商业化的父系单倍体诱导系,诱导率达7%[24]。对拟南芥CENH3进行点突变可以获得单倍体诱导系[7]。本研究以烟草CENH3基因为编辑目标,构建CRISPR/Cas9编辑载体,并通过农杆菌介导法进行烟草遗传转化获得CENH3突变株系,从而为采用CRISPR/Cas9-CENH3技术体系创建甜菜等作物的单倍体诱导系奠定了基础。
1.1 试验材料
本氏烟草(Nicotiana benthamiana)无菌苗、载体pBWA(V)K和 pBWA(V)-Cas9、EHA105农杆菌菌株由内蒙古自治区农牧业科学院甜菜分子育种课题组保存。试验所用试剂(盒)为TaKaRa产品。6 000 bp DNA marker、T4连接酶、限制性内切酶Eco31Ⅰ、LguⅠ、EcoRⅤ等均购自武汉伯远生物科技有限公司,大肠杆菌感受态细胞DH5α购自天根生化科技(北京)有限公司;
农杆菌感受态细胞EHA105购自北京华越洋生物有限公司,其他常规试剂主要购自TaKaRa公司。引物由南京金斯瑞公司合成,其序列见表1。
1.2 CENH3基因靶位点序列的设计及载体构建
1.2.1 CENH3基因靶标序列
根据烟草 CENH3基因(LOC107795199)cDNA保守序列设计2个靶标以提高编辑效率,靶标1序列:agagcactgagctgttgatcagg,靶标 2序列:gcttgttcgtgaaattgcacagg。扩增含2个靶标序列的sgRNA引物(1F/1R和2F/2R,并引入Eco31Ⅰ酶切位点),序列见表1。

表1 引物信息
1.2.2 sgRNA1和sgRNA2获得
靶标序列较短,故通过引物变性退火就可以得到目的序列。sgRNA1 反应体系(50 μL):ddH2O 40 μL,引物 1F 5 μL,引物 1R 5 μL。反应条件:95 ℃ 10 min,55℃10 min,14℃5 min,同样方法获得sgRNA2片段。
1.2.3 CENH3靶标中间载体构建
1.2.3.1 pBWA(V)-Cas9/CENH3-B1 构建
用Eco31Ⅰ分别酶切目的片段sgRNA1和空载体pBWA(V)-Cas9(细菌抗性为卡纳霉素,植物抗性为潮霉素)并用T4连接酶连接酶切片段。酶切连接反应体系(10.0 μL):10×buffer 1.0 μL,空载体 1.5 μL,sgRNA1 片段 2.0 μL,Eco31 Ⅰ 0.5 μL,T4-ligase 0.5 μL,ddH2O 4.5 μL。混匀后,37 ℃反应2 h。取5 μL连接物转化大肠杆菌感受态细胞DH5α,37℃培养16 h后获得白色单菌落,抽提质粒,测序检测目的片段,重组载体命名为pBWA(V)-CAS9/CENH3-B1。
1.2.3.2 pBWD/CENH3-B2构建
用Eco31Ⅰ分别酶切目的片段sgRNA2和空载体pBWD(LB)DNAi(AT),并用T4连接酶连接酶切片段。酶切连接反应体系(10.0 μL):10×buffer 1.0 μL,空载体 1.5 μL,sgRNA2 片段 2.0 μL,Eco31 Ⅰ0.5 μL,T4-ligase 0.5 μL,ddH2O 4.5 μL。反应条件和转化大肠杆菌同1.2.3.1,测序合格后,重组载体命名为pBWD-CENH3-B2。
1.2.4 双靶标载体CRISPR-Cas9/CENH3构建
用LguⅠ酶切2个中间载体pBWA(V)-Cas9/CENH3-B1和pBWD/CENH3-B2,并用T4连接酶进行连接。酶切连接反应体系(10.0 μL):10×T4 buffer 1.0 μL,pBWA(V)-Cas9/CENH3-B1 1.0 μL,pBWD/CENH3-B2 1.5 μL,Lgu I 0.5 μL,T4-ligase 0.5 μL,ddH2O 5.5 μL。均匀后,37℃反应 2 h。将 pBWD/CENH3-B2的酶切目的片段插入pBWA(V)-Cas9/CENH3-B1,获得含有双靶标的重组载体命名为CRISPR-Cas9/CENH3。将双靶标重组载体CRISPRCas9/CENH3转化到农杆菌EHA105中,用引物3F和3R进行菌落PCR扩增载体上的M13片段以检测重组质粒。提取1个PCR检测阳性质粒,用EcoRⅤ酶切进一步进行酶切鉴定。
1.3 烟草的遗传转化及转基因植株PCR检测
用含有编辑载体CRISPR-Cas9/CENH3的农杆菌EHA105转化烟草无菌苗叶片并诱导丛生芽产生,经Zmpl筛选获得抗性植株。提取抗性植株幼叶DNA,并以此为模板,用引物4F和4R扩增Cas9基因片段以检测阳性植株。PCR反应体系:2×PCR Mix 6.25 μL,4F/4R 引物各 0.50 μL,模板 DNA(50 ng/μL)1.00 μL,ddH2O 4.25 μL;
反应程序:94 ℃3 min;
94 ℃ 1 min,62 ℃ 1 min,72 ℃ 1 min,30 个循环;
72℃ 10 min,4℃保存。
1.4 目的基因拷贝数检测
利用数字PCR(ddPCR)技术,检测转基因植株中CENH3基因的拷贝数。首先对CENH3基因的扩增引物5F/5R(表1)和内参基因RNR2(拷贝数为1)的扩增引物6F/6R(表1)的特异性进行检测。之后用特异引物5F和5R对PCR检测阳性植株进行CENH3基因插入拷贝数检测。ddPCR扩增体系(25.0 μL):2×PerfeCTa Qpcr ToughMix UNG 5.0 μL,AlexaFluorTM6471.0 μL,EvaGreen20×inwater2.0 μL,上、下游引物各 0.4 μL,模板 2.0 μL,ddH2O 14.2 μL。数字 PCR扩增程序为94℃ 5 min;
95℃ 30 s,60℃30 s,72 ℃ 30 s,40 个循环;
72 ℃ 5 min。每个样品进行3个平行重复试验。外源基因拷贝数=外源基因浓度/内参基因浓度。
2.1 CENH3基因编辑载体构建
提取2个中间载体pBWA(V)-Cas9/CENH3-B1和pBWD/CENH3-B2质粒DNA,通过测序证实目的片段已正确插入。2个中间载体通过LguⅠ酶切并用T4连接酶后,获得的双靶标编辑载体CRISPRCas9/CENH3经PCR检测M13片段,获得条带大小为857 bp(图1a),符合预期。提取1个PCR检测阳性质粒进一步进行EcoRⅤ酶切鉴定,获得5条大小正确的条带,分别为 7 023、3 570、2 625、2 200、279 bp(图1b),表明双靶标编辑载体CRISPR-Cas9/CENH3构建成功。

图1 CRISPR-Cas9/CENH3的PCR检测(a)和酶切鉴定(b)
2.2 转基因植株获得及PCR检测
用含有编辑载体CRISPR-Cas9/CENH3的农杆菌转化烟草获得Zmpl抗性植株,随机提取11株抗性植株叶片基因组DNA进行Cas9基因的PCR检测,扩增片段大小均为577 bp,符合预期(图2),初步判断目的基因已整合到烟草基因组染色体上。

图2 转基因植株PCR检测
2.3 CENH3突变体检测
为了验证靶标序列是否发生突变,对转基因烟草T0代植株和野生型CENH3基因靶序列进行扩增并测序分析。测序结果表明,11株转基因植株中有6株为编辑植株(表2),编辑效率为54.5%。进一步分析表明,靶标1未发生突变,靶标2序列上发生4种突变类型,分别为单碱基插入纯合突变(两条染色体均插入1个碱基“T”,如1号和5号株系),一条染色体单碱基插入杂合突变(插入1个碱基“A”,如2号株系),单碱基插入杂合突变(其中一条染色体插入1个碱基“T”,另一条染色体插入1个碱基“C”,如4号株系),单碱基插入和多碱基缺失的杂合突变(其中一条染色体插入1个碱基“T”,另一条染色体缺失6个碱基“CAATTT”,如3号和6号株系)。
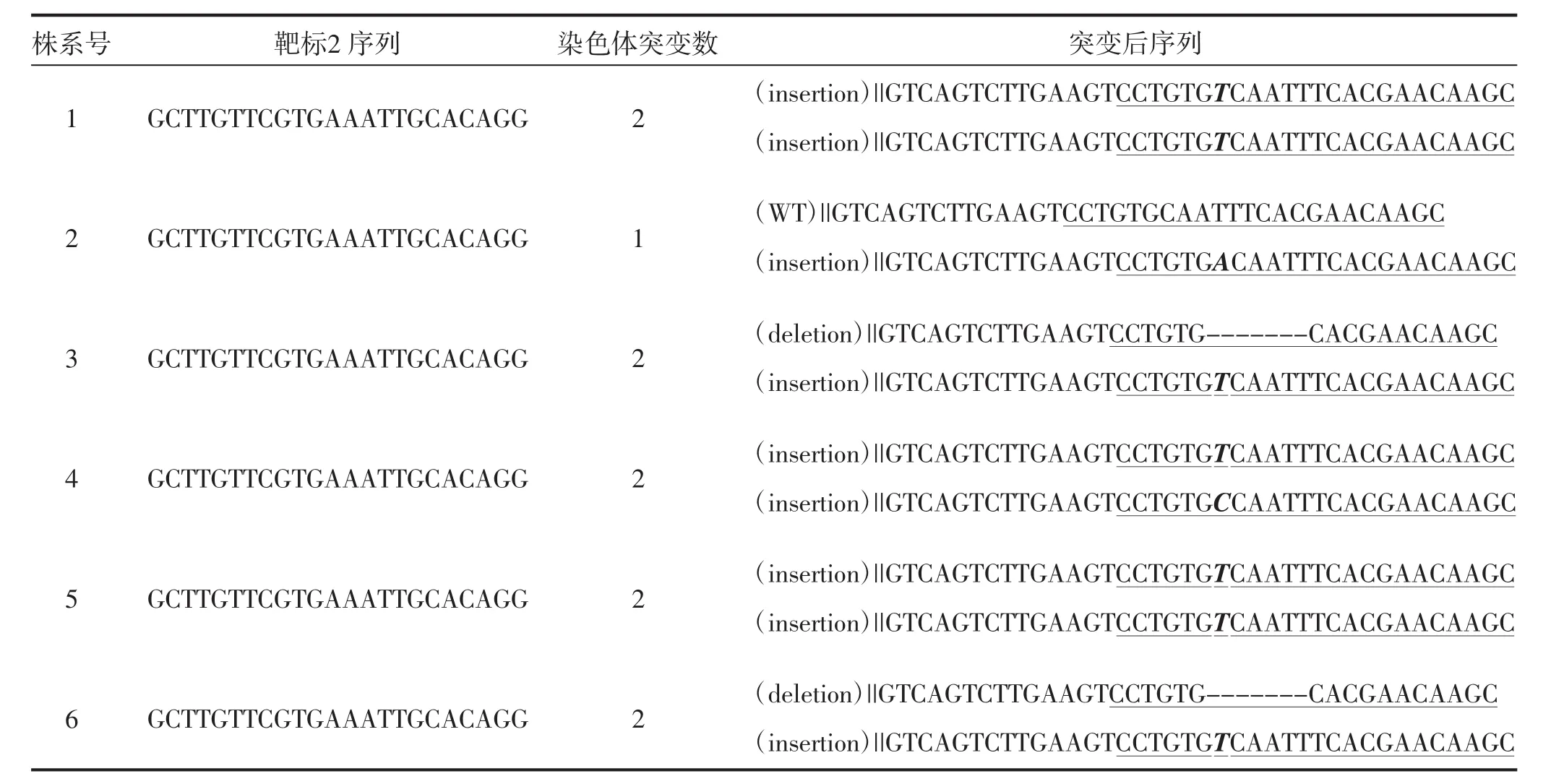
表2 转基因株系突变类型
2.4 目的基因拷贝数检测
利用ddPCR技术对6株突变体进行插入拷贝数检测。首先以烟草RNR2为内参基因,对目的基因CENH3的扩增引物(5F/5R)的特异性进行检测。由图3可知,2个基因对应引物的阳性微滴(蓝色带)与阴性微滴(黑色带)都能明显区分,表明CENH3引物的特异性较好。其次,对ddPCR的重复性进行分析,所有样品CENH3和RNR2基因的试验有效微滴总数平均为24 050~27 924(表3),满足微滴数字PCR微滴的分析要求,试验中生成微滴的相对标准偏差(relative standard deviation,RSD)为1.8%~3.6%(表3),小于25%,符合欧盟核酸定量检测的要求,说明试验中建立的微滴数字PCR体系微滴生成稳定,重复性良好,数据可靠性高。对6株突变体进行拷贝数分析,结果表明,所有突变体均为低拷贝转基因植株,CENH3基因的插入拷贝数均在 0.3~1.2(表 4)。

图3 ddPCR引物特异性检测

表3 引物ddPCR重复性检测

表4 转基因株系CENH3基因拷贝数检测
基因编辑是探究基因功能的重要技术之一,通过对目的基因的定点敲除、添加或修饰探究特定基因的功能[25]。CRISPR/Cas9技术是目前主流基因编辑技术,因其具有载体构建简单易行、特异性好、打靶效率高等特点,该系统已被广泛应用于作物改良育种[26]。
获得单倍体的方法有很多,如体外诱导(雄配子体诱导和雌配子体诱导)、种间或种内的选择性杂交、对着丝粒特异性组蛋白编码基因CENH3进行基因组编辑(CRISPR/Cas9)等均用于诱导单倍体的产生[27]。单倍体育种利用染色体加倍产生完全纯合的双单倍体,相比传统育种是一种高效快速的植物育种方法[28-29]。利用CRISPR/Cas9系统直接修饰CENH3 在拟南芥[6]、玉米[30-31]和小麦[24]、甘蓝[32]等植物上均获得了单倍体植株。研究表明,拟南芥CENH3无效突变体具有致死性,将经过遗传修饰的CENH3导入该拟南芥突变体,可恢复植株的野生表型,转基因植株与野生型植株杂交可产生只含野生型基因组的单倍体[6]。
本研究以烟草CENH3为编辑目标,利用CRISPR/Cas9技术对CENH3进行定点编辑获得了编辑植株,编辑效率为54.5%。从编辑效率来看,本研究设计的靶标及构建的编辑载体是合理有效的,实现了对烟草CENH3的定点编辑,为利用CRISPR/Cas9编辑系统进行甜菜CENH3基因编辑,为获得甜菜单倍体诱导系奠定了基础。
猜你喜欢 靶标引物诱导 纳米载体可缓解农药对靶标作物的负作用今日农业(2022年4期)2022-11-16隧道智能逃生诱导系统中国交通信息化(2022年8期)2022-10-28不同诱导系对不同基因型玉米材料的诱导率评价中国种业(2022年9期)2022-10-13香合欢EST-SSR标记开发及种间通用性研究广西植物(2022年8期)2022-09-07甜菜全基因组SSR引物的筛选与评价中国农学通报(2022年12期)2022-06-01基于网络药理学及分子对接技术分析清眩降压汤治疗高血压的作用机制福建中医药(2022年2期)2022-03-24基于异质信息网络元路径的药物‒靶标相互作用预测模型北京大学学报(自然科学版)(2022年1期)2022-02-21马铃薯SSR引物的开发、特征分析及在彩色马铃薯材料中的扩增研究作物学报(2022年4期)2022-02-10浅析诱导公式的导向功能中学生数理化·高一版(2021年12期)2021-09-05有关PCR扩增过程中的疑虑与剖析中学生物学(2019年7期)2019-10-17推荐访问:基因 烟草 技术